基于人血清白蛋白占位的内标型比率荧光探针检测抗癫痫药物盐酸噻加宾
廖小豆, 曹雅诗, 艾思欣, 杨 艳, 汤鑫慧, 刘 芸,周梦洁, 邹 振, 杨荣华
(长沙理工大学化学与食品工程学院,湖南长沙 410114)
癫痫是神经系统最常见的疾病之一,它严重威胁患者的健康并影响其生活质量[1]。目前,癫痫最主要及最常用的治疗手段仍然是药物治疗[2]。盐酸噻加宾(TGB)是一种新型的抗癫痫药物,其作用机制是阻滞神经元和神经胶质细胞对γ-氨基丁酸(GABA)的再摄取,增加突触部位GABA的水平,从而达到抗癫痫的作用[3]。然而,研究表明TGB的过量使用会产生一系列的副作用,例如头晕无力、腹部疼痛、体重变化、思想异常、认知能力下降、精神运动迟缓和抑郁等[4 - 7],甚至还可能导致患者产生自杀的想法或行为[8]。因此,TGB的检测对指导临床用药具有重大的意义。
目前,TGB的检测方法为高效液相色谱法(HPLC)[9 - 10]。该方法选择性好,准确度高,但是存在样品预处理复杂,分析成本高,检测时间长,对操作人员要求高等缺点[11]。荧光光谱法由于其灵敏度高、选择性好、检测成本低廉和操作简便等特点,已经在诊断学、药理学、病理学、化学生物学等领域得到了广泛的应用,已成为一种必不可少的分析手段[12]。但单一发射的荧光探针容易受到周围环境、自身浓度和检测仪器等因素的影响,导致检测结果的准确性降低[13]。而同时具有两个或多个荧光发射峰的比率型荧光探针,可以通过自身信号峰进行校正,提高检测的准确性[14]。
人血清白蛋白(HSA)是人血浆中含量最为丰富的蛋白质,其含量约占血浆总蛋白的60%[15]。HSA有两个主要的配体结合位点(位点Ⅰ和位点Ⅱ),能够与多种内源性和外源性物质相结合[16]。因此,HSA也常常被用作蛋白载体,用于脂肪酸、类固醇激素、药物等物质的输送[17]。同时,据文献报道有些荧光分子也可与HSA发生选择性位点结合,改变荧光分子的光致发光性质。然而,目前报道的HSA结合荧光探针皆为荧光增强型,只适用于HSA检测或 “Turn-off” 模式下的位点筛选[18 - 20]。在本工作中,我们发现染料苝二酰亚胺衍生物(PDI)能与HSA的位点Ⅱ结合,并发生荧光猝灭。本文利用这一独特的现象,并选择位点Ⅰ结合探针茜素络合指示剂(AC)为内标物,构建了内标型比率荧光探针(PDI-HSA-AC)。该荧光探针对尿液中TGB具有很好响应,并呈现出明显的比率荧光识别特点,有望用于临床药物分析。
1 实验部分
1.1 仪器及试剂
UV-2700紫外-可见分光光度计(日本,岛津公司);PTI荧光分光光度计(美国,PTI公司)。
人血清白蛋白(HSA)购于北京鼎国昌盛生物技术有限责任公司。布洛芬购于生工生物工程股份有限公司。丹酰胺(DNSA)购于梯希爱化成工业发展有限公司。盐酸噻加宾(TGB)以及其他生化试剂均购自上海阿拉丁生化科技股份有限公司。染料苝二酰亚胺衍生物(PDI)由于聪教授课题组提供。本研究所用的化学试剂均为分析纯,未经任何处理。实验用水为超纯水。
1.2 紫外-可见吸收光谱与荧光光谱的测定
将PDI和HSA分别溶于50%的乙醇和超纯水中,均配成1 mmol/L的母液,使用时均用超纯水稀释至所需浓度。取一定体积PDI母液稀释为10 μmol/L,通过紫外-可见分光光度计测量PDI的最大激发波长。在所得的最大激发波长处测定PDI中加入一系列呈梯度浓度的HSA之后的溶液荧光强度的变化。分别取一定体积的PDI和HSA,稀释为一系列比例浓度为1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1(PDI∶HSA)的溶液,通过荧光光谱仪测得一系列的荧光强度F,再将HSA换成超纯水作为空白对照,测得的一系列荧光强度F0,分别取最大发射处的荧光强度值计算F/F0,以此探究PDI和HSA的最佳结合比。
为考察PDI与HSA结合位点,选取两种HSA位点标志物:位点Ⅰ的标志物丹酰胺(DNSA),位点Ⅱ的标志物布洛芬(Ibuprofen)。将上述两种位点标志物分别加入到10 μmol/L PDI和10 μmol/L HSA的混合溶液体系中,分别改变位点Ⅰ和位点Ⅱ标志物的浓度,测量溶液荧光强度的变化。
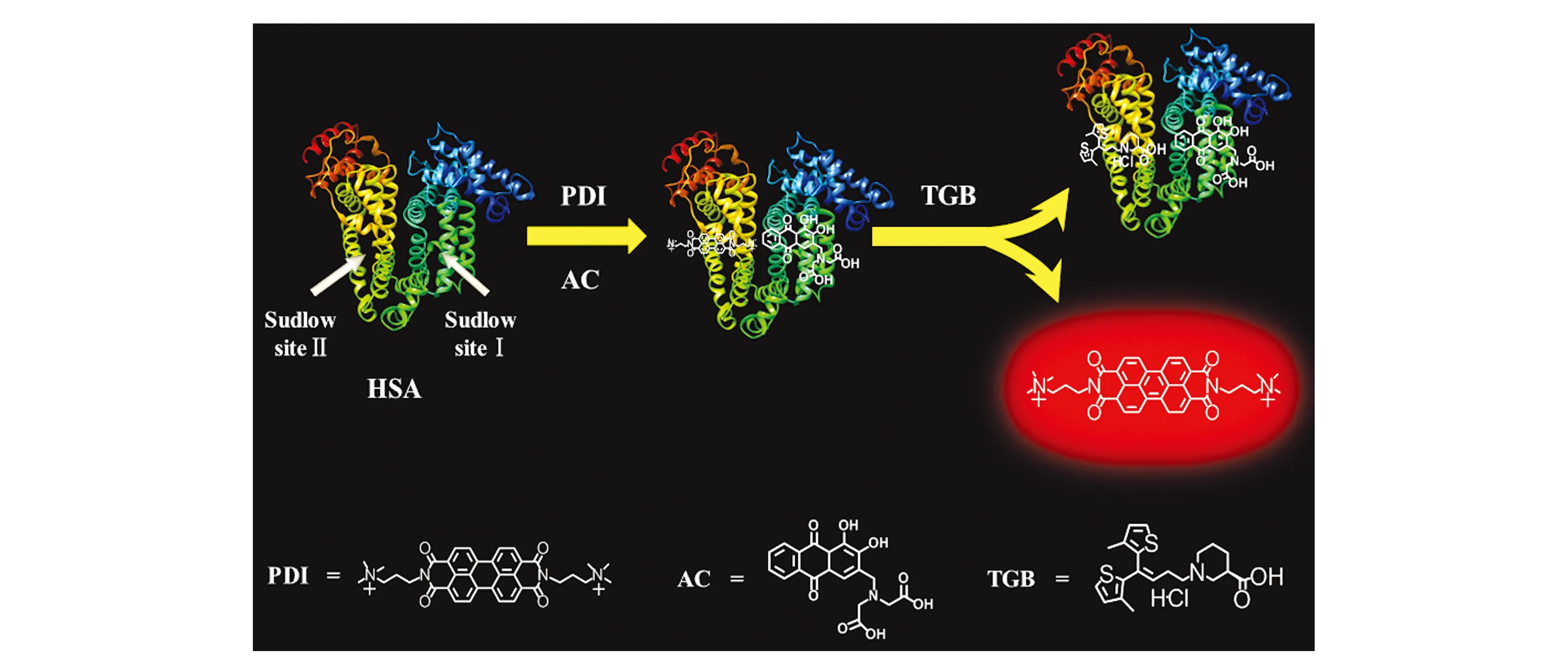
图1 基于人血清白蛋白占位的内标型比率荧光探针检测抗癫痫药物盐酸噻加宾的原理图Fig.1 Schematic illustration of human serum albumin-occupying-based internal standard ratio fluorescent probe for determination of anti-epileptic drug tiagabine hydrochloride
2 结果与讨论
2.1 内标型比率荧光探针PDI-HSA-AC的构建及检测原理
图1为基于HSA占位的内标型比率荧光探针检测抗癫痫药物TGB的原理图。染料苝二酰亚胺衍生物(PDI)具有强烈的荧光,当PDI结合在HSA的位点Ⅱ时,PDI的荧光发生猝灭,茜素络合指示剂(AC)作为内标物结合在HSA的位点Ⅰ。当存在TGB时,TGB与HSA发生位点竞争性结合,置换出具有荧光性质的PDI,并且TGB的存在基本不影响AC的荧光信号,从而实现对TGB的比率荧光法的检测。
2.2 PDI和HSA相互作用的光谱特性及选择性分析
图2A为10 μmol/L PDI溶液的激发和发射光谱。可以看出PDI在波长为385 nm和500 nm处均有吸收。其中,在500 nm处显示最强的吸收峰,故在后续考察PDI与HSA的相互作用实验中选择的激发波长为500 nm。此外,以500 nm为激发波长,发现PDI在549 nm波长处有最强的发射。
通过荧光变化研究了PDI与HSA之间的相互作用。实验结果如图2B所示,随着HSA的浓度不断升高,溶液的荧光强度逐渐降低。表明HSA对PDI的荧光具有猝灭作用,推测该猝灭作用是来源于PDI和HSA的结合。
采用了等摩尔连续变化法考察了PDI与HSA之间相互作用的结合比。如图2C所示,以荧光强度的比值F/F0(F和F0分别为存在和不存在HSA的体系的荧光强度)对两者摩尔比作图。从图中可以看出PDI与HSA之间是单一的键合模式,最佳的猝灭比即结合比为1∶1。
为了考察PDI对不同的氨基酸和蛋白质的选择性,在10 μmol/L PDI溶液中分别加入L-谷氨酸,L-精氨酸、葡萄糖氧化酶、胰蛋白酶、糜蛋白酶、木瓜蛋白酶、溶菌酶和HSA,结果如图2D所示。实验发现除了HSA之外,其它的氨基酸和蛋白质对溶液体系的荧光几乎无影响,由此可见PDI对HSA具有很好的选择性。

图2 (A)10 μmol/L PDI溶液的激发和发射光谱;(B)在10 μmol/L PDI溶液中加入不同浓度的HSA之后的荧光光谱(λex=500 nm);(C)PDI与HSA的等摩尔变化曲线(λex=500 nm,λem=549 nm);(D)不同氨基酸和蛋白质对PDI荧光强度的影响Fig.2 (A) Excitation and emission spectra of 10 μmol/L PDI solution;(B) Fluorescence spectra of PDI upon titrating with HSA(λex=500 nm);(C) Isomolar curve of PDI and HSA(λex=500 nm,λem=549 nm);(D) Effect of various amino acids and proteins on fluorescence intensity of PDI
2.3 PDI与HSA的结合位点研究
众所周知,HSA有两个主要的结合位点,分别是位点Ⅰ和位点Ⅱ。利用位点竞争实验,可以探究PDI与HSA的结合位点。如图3A和3B所示,在10 μmol/L PDI和10 μmol/L HSA的混合溶液体系中,分别加入不同浓度的位点Ⅰ的标志物丹酰胺(DNSA)和位点Ⅱ的标志物布洛芬(Ibuprofen),结果显示加入不同浓度的丹酰氯之后,溶液的荧光强度基本没有变化,而加入不同浓度的布洛芬之后,溶液的荧光强度随着其浓度的增加而升高。表明布洛芬的加入,使得与HSA结合的PDI被置换下来,从而恢复PDI的荧光,因此可以说明PDI与HSA的结合位点是位点Ⅱ。
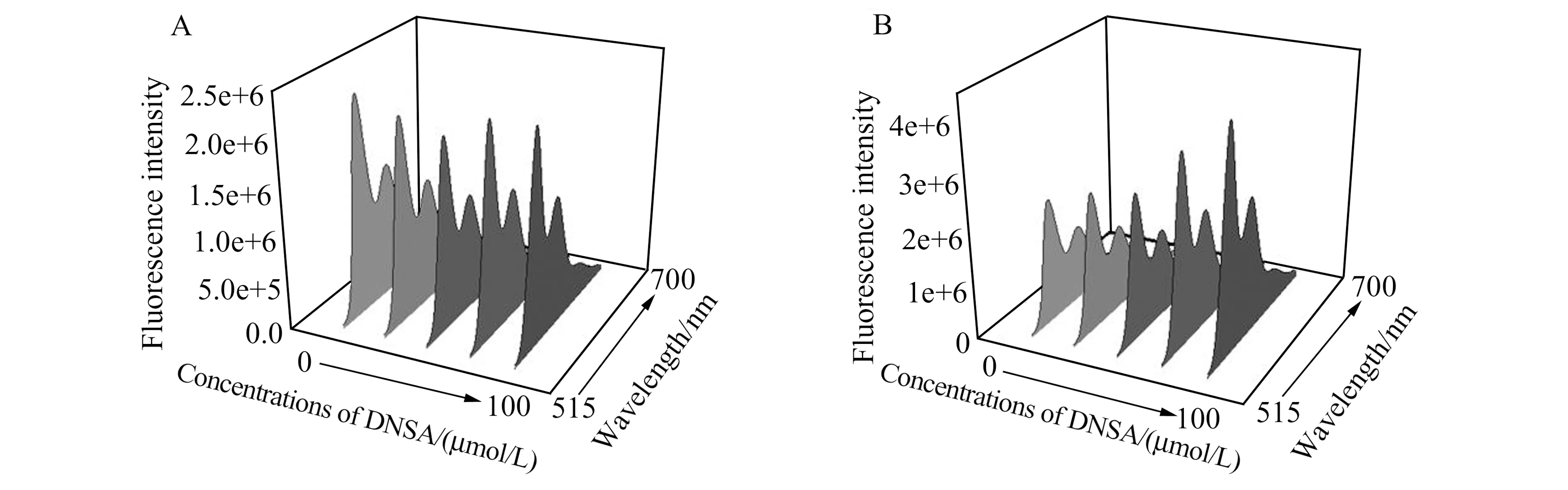
图3 PDI与HSA结合位点的荧光光谱。(A)不同浓度DNSA存在下HSA和PDI体系的荧光光谱;(B)不同浓度Ibuprofen存在下HSA和PDI体系的荧光光谱Fig.3 Fluorescence spectra of the binding sites of PDI and HSA.(A) Fluorescence spectra of HSA and PDI systems in the presence of various concentration of DNSA;(B) Fluorescence spectra of HSA and PDI systems in the presence of various concentration of Ibuprofen
2.4 探针对TGB的检测实验
根据文献报道,AC由于疏水性可与HSA的位点Ⅰ结合[21]。而TGB可以和HSA位点的Lys-414,Arg-410,Arg-485,Leu-453,Ser-489,Tyr-411等氨基酸残基相互作用,占据HSA的结合位点Ⅱ[8],这为TGB的比率荧光检测提供了理论依据。首先,考察了AC的光谱性质以及AC、HSA、PDI和TGB的相互影响,结果如图4A和图4B所示。图4A为20 μmol/L AC溶液的激发和发射光谱,由图可知AC的最大激发波长为385 nm,最大发射波长为443 nm,由于385 nm的激发光能同时激发PDI和AC,实验中选择激发波长为385 nm。由图4B的荧光光谱可以看出,TGB的加入恢复了PDI的荧光,且HSA、PDI和TGB对AC的荧光信号均无影响,表明AC可作为内标物,可实现比率荧光法检测TGB。

图4 (A)20 μmol/L AC溶液的激发和发射光谱;(B)AC、HSA、PDI和TGB相互作用的荧光光谱(λex=385 nm);(C)温度对检测TGB实验的影响(λex=385 nm,λem=549 nm);(D)PDI-HSA-AC探针对TGB响应时间的考察(λex=385 nm,λem=549 nm)Fig.4 (A) Excitation and emission spectra of 20 μmol/L AC solution;(B) Fluorescence spectra of AC HSA,PDI and TGB interactions(λex=385 nm);(C) The influence of temperature on TGB detection experiment(λex=385 nm,λem=549 nm);(D) Response time of PDI-HSA-AC probe to TGB(λex=385 nm,λem=549 nm)
经实验优化得到的浓度分别为10 μmol/L、10 μmol/L和70 μmol/L的PDI、HSA和AC三元复合物比率荧光探针(PDI-HSA-AC)对TGB进行检测。
2.4.1 温度对检测TGB的影响设置温度分别为20、25、30、35、37、40 ℃,考察不同温度下荧光探针PDI-HSA-AC(PDI、HSA和AC的浓度分别为10 μmol/L,10 μmol/L和70 μmol/L)的荧光强度(F0),以及在探针中加入200 μmol/L TGB之后的荧光强度(F),通过计算不同温度下F/F0比值的大小,研究温度对检测TGB实验的影响,如图4C所示。其中,F和F0分别为有和无TGB存在情况下体系的荧光强度。从图中可以看出,荧光强度比值F/F0几乎不随温度的变化而变化,表明温度对TGB的检测基本没有影响。
2.4.2 探针的灵敏度和稳定性通过荧光光谱时间扫描,考察内标型比率荧光探针PDI-HSA-AC对检测TGB的响应速度以及稳定性。首先对探针体系PDI-HSA-AC进行1 min的时间扫描,然后分别加入100 μmol/L、200 μmol/L和400 μmol/L TGB,继续时间扫描,观察溶液荧光强度的变化情况。如图4D所示,在探针体系中分别加入100 μmol/L、200 μmol/L和400 μmol/L TGB之后,溶液的荧光强度立即上升,并且在十几秒钟之内达到平衡并保持稳定。该实验结果表明探针PDI-HSA-AC对TGB的检测具有快速响应性以及优异的稳定性。
2.4.3 方法的线性范围和检出限利用探针测定不同浓度TGB对应的荧光强度。如图5A~5C所示,随着TGB的浓度增加,溶液的荧光强度逐渐增强。在TGB浓度为1~100 μmol/L的范围内,该探针对TGB的检测具有较好的线性关系,相关系数达到0.990,且通过检出限的计算公式(LOD=3σ/S,σ为11次空白样品的标准偏差,S为所得到的线性关系的斜率[22])得到该探针的检出限为0.527 μmol/L,由此可见该比率型荧光探针对TGB的检测具有较低的检出限。

图5 (A)内标型比率荧光探针PDI-HSA-AC检测不同浓度TGB的荧光光谱;(B)比率荧光强度(F549/F443)和TGB(1~600 μmol/L)浓度的关系;(C)比率荧光强度(F549/F443)和TGB(1~100 μmol/L)浓度的线性关系;(D)内标型比率荧光探针PDI-HSA-AC对TGB的选择性Fig.5 (A) The fluorescence spectra of different concentrations of TGB were detected by the internal standard ratio fluorescent probe PDI-HSA-AC;(B) Relationship between ratio fluorescence intensity(F549/F443) and the concentration of TGB(1~600 μmol/L);(C) The linear relationship between ratio fluorescence intensity(F549/F443) and the concentration of TGB(1~100 μmol/L);(D) Selectivity of the internal standard ratio fluorescent probe PDI-HSA-AC for TGB
2.4.4 探针的选择性实验为考察内标型比率荧光探针PDI-HSA-AC对TGB的选择性,选取Cl-、Na+、K+、Mg2+、Ca2+、葡萄糖、半胱氨酸、精氨酸、谷氨酸、甘氨酸、加巴喷丁、卡马西平、丙戊酸钠、苯妥英钠、尿素、尿酸等多种离子、氨基酸和药物等。将上述物质和TGB的浓度都固定为200 μmol/L,分别加入到荧光探针PDI-HSA-AC体系中,测量溶液荧光强度的变化。如图5D所示,除了TGB可以使得探针的比率荧光强度(F549/F443)增强之外,其它的离子、氨基酸和药物等对探针的比率荧光强度只有轻微的变化,这说明该探针对TGB具有较好的选择性。
2.5 实际样品尿液中TGB的检测
尿液样品取自健康的女性捐赠者。将尿液用超纯水稀释10倍,加入探针PDI-HSA-AC和不同浓度的TGB,分别测其荧光强度值,重复3次,计算TGB在尿液中的回收率。如表1所示,尿液中添加TGB的回收率较好,证明了我们构建的探针在复杂生物环境中检测TGB的准确性和选择性。因此,该探针为实际样品中TGB的检测提供了一种灵敏、选择性好的比率荧光检测方法。

表1 人体尿样中TGB含量测定结果(n=3)
3 结论
本工作成功构建了PDI-HSA-AC三元配合物体系的内标型比率荧光探针,探究了它的荧光光谱特性以及对盐酸噻加宾(TGB)的检测。结果表明该探针对TGB的检测具有很好的响应性和选择性,能够实现实际尿液中TGB的高灵敏分析。该内标型比率荧光探针具有构造简单、抗干扰能力强、易操作等优势,探针还可扩展至其它HSA结合药物的检测,在临床药物分析中具有潜在的应用价值。

