一种检测生物硫醇的荧光探针
周柯岩,杨瑜涛, 李华肖, 李玮
(1.河北大学 化学与环境科学学院,河北 保定 071002;2.河北大学 教育部药物化学与分子诊断重点实验室,河北 保定 071002)
硫醇是一种含有巯基官能团的一类非芳香族化合物.其中小分子生物硫醇主要包括半胱氨酸(Cys)、高半胱氨酸(Hcy)和谷胱甘肽(GSH),它们在生物体内参与多种生理活动,在蛋白质的合成、氧化还原、细胞的抗氧化等重要的生理过程中发挥着重要作用[1].作为一种可以天然产生的氨基酸——半胱氨酸(Cys),其具有刺激造血机能,促进皮肤损伤修复的作用[1-2],细胞内 Cys 的缺失,会造成肝脏损伤、毛发减少褪色等等.人体中一个非常重要的中间代谢产物——高半胱氨酸(Hcy),其在人体中的含量大于 10 μmol/L 则会表现为临床异常[3-8],含量过高会导致血管内皮细胞损伤、心血管病、骨软弱症、精神疾病等等.细胞内含量最高的一种硫醇——谷胱甘肽(GSH),可以参加多种机体的生化反应,其在免疫方面发挥着重要作用[9],其含量与衰老、过敏、肿瘤、脂肪肝、艾滋病等有着重要的联系. 近年来,用来检测生物硫醇类的小分子荧光探针受到了广泛关注.小分子生物硫醇的荧光探针的检测主要基于亲核加成反应[10-13]、断键分解反应[14-16]、金属络合物置换配位反应[17]等反应机理.本文成功设计并合成了一种基于色烯衍生物的荧光探针 1,该探针能够实现对生物硫醇的快速、高灵敏度和高选择性的“关”-“开”型荧光信号响应.
1 实验部分
1.1 实验仪器和试剂
1.1.1 主要实验仪器
ZF-20D 暗箱式紫外分析仪,600Hz 核磁共振仪(Bruker),Agilent Technologies Cary 60紫外-可见分光光度计,Agilent Technologies Cary Eclipse 荧光分光光度计,Agilent Technologies 质谱仪.
1.1.2 主要实验试剂
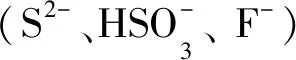
1.2 溶液配制及光谱测定
用 DMF 制备探针的储备液,配制溶度为 2×10-3mol/L,各种氨基酸和阴离子均用去离子水配制,浓度为 2×10-3mol/L.紫外和荧光光谱在 PBS-DMF(10 mmol/L,体积比1∶1,pH=7.4)中检测获得,荧光光谱激发波长为 395 nm,光栅狭缝 5 nm /5 nm,电压为 600 V 条件下获得.
1.3 荧光探针的制备与表征
荧光探针的合成路线见图1.
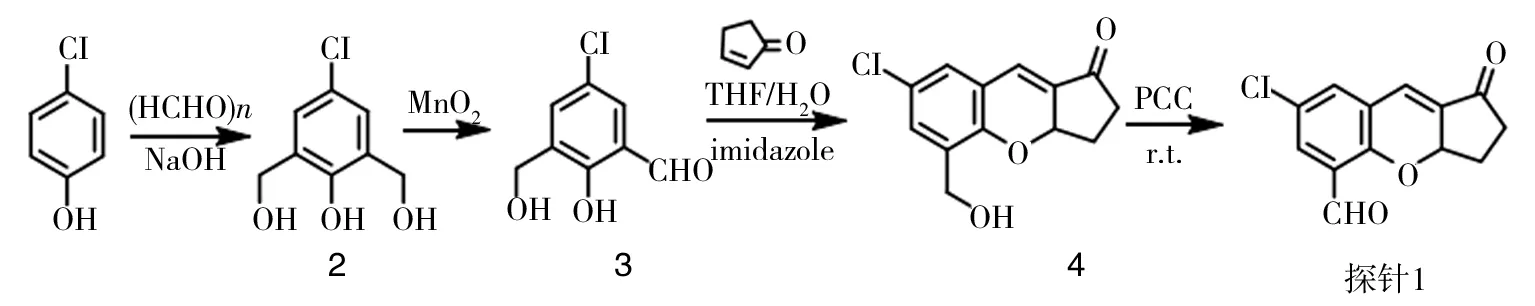
化合物2∶5-氯-2-羟基-1,3-(亚苯基)二甲醇;化合物3∶5-氯-2-羟基-3-(羟甲基)苯甲醛;化合物4∶色烯衍生物.
1.3.1 化合物4(色烯衍生物)的合成
将化合物3(0.372 g,2 mmol)、环戊烯酮(0.164 g,4 mmol)以及咪唑(0.136 g,2 mmol)加入到圆底烧瓶中,用溶剂V(THF)∶V(H2O)=1∶1进行溶解,在 30 ℃下缓慢搅拌 72 h,点板监测,直至反应完毕,得到深棕色溶液.用乙酸乙酯萃取3次,合并有机相,用无水硫酸钠干燥,通过真空浓缩,除去溶剂,粗产物通过硅胶柱色谱(V(PE)∶V(EA)=2∶1)分离得到黄色固体(0.25 g,质量分数50%).
1.3.2 化合物3(5-氯-2-羟基-3-(羟甲基)苯甲醛)的合成
将化合物2(20 g,106 mmol)和二氧化锰(20 g,230 mmol)加入到圆底烧瓶中,将其溶解于 300 mL 氯仿中,在0 ℃下搅拌反应 1 h,点板监测,直至反应完毕. 将反应液通过真空过滤,收集滤液,将其真空干燥,除去溶剂,粗产物通过硅胶柱色谱(V(PE) ∶V(EA)=15∶1)分离得到白色晶体(11.04 g,质量分数56%).
1.3.3 化合物2((5-氯-2-羟基-1、3-(亚苯基)二甲醇)苯甲醛的合成
将氢氧化钠(6 g,150 mmol)溶解在 20 mL 水中,向其溶液中加入对氯苯酚(19 g,150 mmol),缓慢搅拌至溶解,且溶液变为金黄色,再向其中加入多聚甲醛(9 g,300 mmol),加热到 50 ℃,反应 1 h,至有黄色固体产生,停止反应,将其溶解于热水100 mL中,用HCl调至 pH 1~2,真空过滤,真空干燥,得到浅黄色固体(26.89 g,质量分数98%).
1.3.4 探针1的合成
将化合物4(0.32 g,1.5 mmol)和氧化剂 PCC(0.32 g,1.5 mmol),溶解于二氯甲烷中,室温搅拌,点板监测,直至反应完毕,停止反应,真空浓缩除去溶剂,粗产物通过硅胶柱色谱(V(PE)∶V(EA)=7∶1)得到黄色固体(0.11g,46%质量分数).探针的核磁表征如图2.1H NMR(CDCl3,600 MHz)δ:10.40(s,1H),7.76(d,J=2.5 Hz,1H),7.4(d,J=2.5 Hz,1H),7.14(d,J=2.4 Hz,1H),5.42~5.39(m,1H),2.83~2.78(m,1H),2.69~2.64(m,1H),2.44~2.37(m,1H),2.28~2.21(m,1H),13C NMR(CDCl3,150 MHz)δ:200.3,187.2,155.9,135.0,133.4,129.6,127.8,125.3,125.1,124.6,76.4,36.9,27.9.

1H NMR(CDCl3,600 MHz);13C NMR(CDCl3,150 MHz).
2 结果与讨论
2.1 探针1对生物硫醇的光谱研究
首先,笔者进行了探针 1 识别生物硫醇的滴定光谱研究,在含有探针 1 (50 μmol/L) 的PBS-DMF(体积比1∶1,pH 7.4,10 mmol/L)缓冲体系中展开,以 GSH 为例进行研究.如图3a 所示,将 GSH 加入到探针 1 的溶液中,随着 GSH 的加入,最大吸收峰的波长不断增加,直至加入50 μmol/L当量的 GSH,最大吸收峰的波长不再增加.此时,最大吸收峰的波长发生了 47 nm的红移.如图 3b 所示,是与之相对应的荧光滴定光谱,探针 1 对生物硫醇有较强的响应,随着 GSH(50 μmol/L)的加入,在 514 nm 处的荧光强度不断增加.与空白体系相比,饱和体系的荧光强度是空白体系的 56 倍.
2.2 探针1对识别生物硫醇的选择性研究


图4 探针1对生物硫醇的(a)紫外-可见吸收光谱选择性实验和(b)荧光光谱选择性实验
2.3 探针1对生物硫醇检出限的研究
笔者根据探针 1 对 GSH 的荧光光谱数据分析计算得出检出限.首先通过对探针1溶液(50 μmol/L)扫描 10 次,测定其在 514 nm 处的荧光强度,计算出标准偏差σ,然后通过探针1在不同浓度的 GSH 在 514 nm 处荧光强度与 GSH 浓度的做出工作曲线,其线性方程为Y=14.583 87c(GSH)+30.372 53,R2为 0.990 02,根据检出限计算公式 3σ/k、经过计算得出探针1对GSH的检出限低达0.12 μmol/L,表明探针1对生物硫醇的检测有较高的灵敏度(图 5).
2.4 探针1对生物硫醇的动力学研究
笔者进行了探针1与生物硫醇的动力学研究,以GSH为例进行研究.如图 6 所示,探针1(50 μmol/L)溶液中加入GSH(50 μmol/L)后,荧光强度明显增加,直到 2 min 后不再增加. 结果表明,探针1能够快速检测生物硫醇.

图5 514 nm处荧光强度与不同浓度GSH的工作曲线

图6 探针1与GSH的反应时间
2.5 探针1的pH研究
研究了 pH 对探针 1 识别生物硫醇的影响,选择不同(3~12)pH 的PBS-DMF(体积比1∶1,10 mmol/L)作为缓冲条件,以GSH为例进一步展开.如图7所示,探针1本身在pH处于3~10内,探针基本维持不变;而加入GSH后,pH在6~12内荧光强度明显增加. 结果表明,探针 1 对生物硫醇的响应可以在较宽的范围内进行.

图7 pH对探针1识别 GSH 的影响
3 总结
成功合成一种色烯衍生物类的小分子荧光探针 1 用于生物硫醇的选择性检测.通过核磁对其结构进行了表征,并且紫外可见光谱和荧光光谱实验表明,该探针能够实现对生物硫醇的快速检测(2 min),检测限为 0.12 μmol/L. 因此,探针 1 可对细胞中的硫醇浓度进行检测.

