胶陀螺菌丝体液态发酵条件及体外抗氧化活性分析
钟 宝, 李应华, 李凤林, 刘 超, Youn-Soo Cha
(1.吉林农业科技学院 食品工程学院, 吉林 吉林 132101; 2.漯河职业技术学院 食品学院, 河南 漯河 462002; 3.韩国全北国立大学 食品科学与人类营养, 韩国 全罗北道 全州 54896)
胶陀螺〔Bulgariainquinans(Pers.) Fr.〕又名拱嘴蘑、猪嘴蘑,属子囊菌纲蜡钉菌目胶陀螺科胶鼓菌属;其子囊盘黑褐色,较小且似陀螺状、猪咀状而得名。胶陀螺主要分布于我国的吉林、辽宁和黑龙江等省,夏秋季生于桦树、柞树、榆树的倒木和木桩上,阴雨后大量出现。该菌为药食兼用真菌,被广泛用于食品和医药行业。其菌丝体含有大量多糖和苯并[j]荧蒽类、Azaphilone 类化合物,具有抗癌、抗菌作用,同时对血淤患者血流流变性可产生影响,如可增强红细胞变性能力,降低血液粘稠度[1];其独特的口感和丰富的营养价值使其近年来深受各国消费者青睐。由于胶陀螺生长季节性强,且随着森林环境日渐恶化,其资源量呈逐年减少趋势,产量少且不稳定,产品质量不能保证,无法满足商品化、市场化的需求,致使胶陀螺一直得不到有效的开发和利用。与子实体培养相比,液态发酵菌种具有生长周期短、营养价值高及产量大等优点[2]。目前,关于胶陀螺的研究主要集中在子实体化学成分分离、鉴定、药理活性分析及胶陀螺光敏毒性成分鉴定分析等方面,对菌丝体的研究较少。鉴于此,对胶陀螺菌丝体的液态发酵培养条件进行筛选,同时对体外抗氧化活性进行分析,以期为胶陀螺菌丝体液态培养及其作为潜在的抗氧化剂开发提供科学依据。
1材料与方法
1.1材料
1.1.1胶陀螺胶陀螺一级菌种,由蛟河市黄松甸镇食用菌合作社提供。
1.1.2试剂葡萄糖、蔗糖、麦芽糖、可溶性淀粉、玉米粉、蛋白胨、酵母浸膏、花生饼粉、硫酸铵、硝酸铵、KH2PO4、MgSO4·7H2O、马铃薯、琼脂粉、纯水、VB1和VC,均为分析纯或化学纯。
1.1.3仪器设备SW CJ ZD超净台,苏州净化仪器有限公司;HVE.50灭菌锅,日本Hirayama公司;PHS.3C pH计,上海科学仪器股份有限公司;TDL.5-A离心机,上海安亭科学仪器厂;UV-2660紫外分光光度计,日本岛津仪器有限公司;TG328A分析天平,上海天平仪器厂;FD-T12N-80冷冻干燥机,上海胜卫电子科技有限公司;BS-2F数显振荡培养箱,北京金坛市杰瑞尔电器有限公司。
1.2方法
1.2.1材料预处理
1) 培养基的制备。马铃薯汁2%(马铃薯去皮煮沸取汁),葡萄糖0.25%,琼脂0.2%,VB10.02%,KH2PO40.05%,MgSO4·7H2O 1%,水1 000 mL,121℃灭菌30 min备用。
2) 发酵培养液的制备。碳源4%,氮源0.3%,KH2PO40.05%,MgSO4·7H2O 1%,VB10.02%,水1 000 mL,121℃灭菌30 min备用。
3) 种子制备及液态培养。参照文献[3-5]的方法,选择菌种生长旺盛的斜面培养基,将其分割成2小块,其中1块在无菌条件下接种在100 mL培养液中,在25℃、150 r/min条件下摇床培养7 d,另一块保存备用;将培养好的种子液以接种量10%接种至250 mL培养液中,在25℃、150 r/min条件下摇床培养6 d,收集菌丝体,通过计算菌丝体干重(mg)与发酵液体积(mL)的比例得到菌丝体的生物量。
1.2.2不同因素对胶陀螺菌丝生长的影响
1) 碳源和氮源确定。碳源是菌丝体生长的重要物质基础,合适的碳源能使菌丝体的生物量增加。氮源是液态发酵过程中菌种细胞合成蛋白质、核酸的重要物质。
碳源。设5个处理,即在基础培养基中分别添加4%的葡萄糖、蔗糖、麦芽糖、可溶性淀粉及玉米粉作为碳源,将胶陀螺菌丝体接种于碳源筛选培养基/液中,3次重复,在25℃、150 r/min条件下摇床培养,接种后每隔24 h测量1次,其测6次,参照文献[6]的方法计算菌丝生长量。选取菌丝生长量最大、菌丝最为浓密的碳源为最佳碳源。
氮源。设5个处理,即在基础培养基中分别添加0.3%的蛋白胨、酵母浸膏、花生饼粉、硫酸铵和硝酸铵作为氮源,将胶陀螺菌丝体接种于氮源筛选培养基/液中,3次重复,在25℃、150 r/min条件下摇床培养,接种后每隔24 h测量1次,共测6次,计算菌丝生长量。选取菌丝生长量最大、菌丝最为浓密的氮源为最佳氮源。
2) 液态培养基发酵条件。在上述试验的基础上分别对培养基组分最佳碳源(葡萄糖)、氮源(酵母浸膏)、KH2PO4和MgSO4·7H2O的用量进行筛选,通过测定菌丝体生物量及胞外粗多糖含量[7-8],确定液态发酵培养基各组分的最佳用量。
葡萄糖。设5个处理,即葡萄糖的添加量分别为2%、3%、4%、5%和6%,酵母浸膏添加量为0.3%,KH2PO4添加量为0.5%,MgSO4·7H2O添加量为1.0%。
酵母浸膏。设5个处理,即酵母浸膏的添加量分别为0.1%、0.2%、0.3%、0.4%和0.5%,葡萄糖添加量为4%,KH2PO4添加量为0.5%,MgSO4·7H2O添加量为1.0%。
KH2PO4。设5个处理,即KH2PO4的添加量分别为0.1%、0.3%、0.5%、0.7%和0.9%,葡萄糖添加量为4%,酵母浸膏添加量为0.3%,MgSO4·7H2O添加量为1.0%。
MgSO4·7H2O。设5个处理,即MgSO4·7H2O的添加量分别为0.6%、0.8%、1.0%、1.2%和1.4%,葡萄糖添加量为4%,酵母浸膏添加量为0.3%,KH2PO4添加量为0.5%。
3) 响应面试验。选择葡萄糖(A)、酵母浸膏(B)、KH2PO4(C)和MgSO4·7H2O(D)为主要影响因素,以菌丝体生物量(Y)为响应值,运用Design-Expert 8.0.6的Box-Behnken设计,对胶陀螺菌丝体液态发酵培养基进行优化,并进行响应面分析,筛选最佳的发酵培养基条件。试验因素与水平方案见表1。
表1胶陀螺菌丝体液态发酵培养基响应面试验的因素与水平
Table 1 Factors and levels of response surface test of liquid fermentation medium ofB.inquinansasmycelium %

因素 Factor水平 Level-101葡萄糖(A)Glucose345酵母浸膏(B)Yeast extract0.20.30.4KH2PO4(C)0.30.50.7MgSO4·7H2O(D)0.81.01.2
1.2.3胶陀螺菌丝体的抗氧化活性取100 mL发酵液,在4℃、6 000 r/min的条件下离心8 min,吸出上清液,收集沉淀,并使用超纯水反复洗涤3次后进行真空冷冻干燥,获得菌丝体,然后将菌丝体分别配置成不同浓度的溶液,放入超声细胞粉碎机中超声5 min,在4℃、6 000 r/min的条件下离心5 min,取上清液待用。
1) DPPH自由基的清除能力。DPPH自由基清率(Y1)参照吴林秀等[9-11]的方法并加以改进后测定。取0.5 mL浓度分别为0.5%、0.7%、0.9%、1.1%及1.3%的待测液,加入0.5 mL DPPH溶液混匀,放在暗室中反应1 h后离心取上清液,在515 nm处测定吸光度(A1);再取0.5 mL蒸馏水分别与0.5 mL的不同浓度样品和0.5 mL的DPPH混合在515 nm处测定吸光度(A2、A3),采用VC作为阳性对照。
2) ABTS自由基的清除能力。ABTS自由基清率(Y2)参照陈旭峰等[12-14]的方法并加以改进后测定。取浓度分别为0.5%、0.7%、0.9%、1.1%及1.3%的待测液0.5 mL,加入0.5 mL ABTS 溶液,混匀后放在暗室中反应20 min,进行离心取上清液,在732 nm处测定吸光度(B1)。再取0.5 mL蒸馏水分别与0.5 mL的不同浓度的样品和0.5 mL的ABTS 混合,在732 nm处测定吸光度(B2、B3),采用VC作为阳性对照。
Y1=[1-(A1-A2)÷A3]×100%
Y2=[1-(B1-B2)÷B3]×100%
2结果与分析
2.1不同碳源和氮源处理胶陀螺菌丝体的生物量
碳源是菌丝体生长的重要物质基础,合适的碳源能使菌丝体的生物量增加;氮源是液态发酵过程中菌种细胞合成蛋白质、核酸的重要物质,对液态发酵影响极大。从图1看出,葡萄糖、蔗糖、麦芽糖、可溶性淀粉、玉米粉5种碳源对胶陀螺菌丝体生物量的影响差异较为明显。其中,葡萄糖作为碳源胶陀螺菌丝体的生物量最高,为13.2 g/L;其次是蔗糖,菌丝体的生物量为11.5 g/L。因此,选择葡萄糖作为发酵用碳源。蛋白胨、酵母浸膏、花生饼粉、硫酸铵、硝酸铵5种氮源对菌丝体生物量的影响存在一定差异,其中,酵母浸膏作氮源,胶陀螺菌丝体的生物量最高,为14.2 g/L;其次是花生饼粉,菌丝体的生物量为13.3 g/L。因此,选择酵母浸膏作为最优氮源。

图1不同碳源和氮源处理胶陀螺菌丝体的生物量
2.2不同液态培养基发酵条件胶陀螺菌丝体的生物量和胞外多糖含量
从图2看出,随着葡萄糖、酵母浸膏、KH2PO4和MgSO4·7H2O添加量的增加,菌丝体生物量呈先增后减趋势,胞外多糖含量的变化也随添加量的增加呈先增后减趋势。葡萄糖添加量为4%时菌丝体生物量和胞外多糖含量均达最大,分别为13.5 g/L和9.45 g/L,其最佳添加量为4%,选择3%、4%和5%添加量进行后续试验。酵母浸膏添加量为0.3%时菌丝体生物量和胞外多糖含量均达最大,分别为14.5 g/L和10.15 g/L,其最佳添加量为0.3%,选择0.2%、0.3%和0.4%添加量进行后续试验。KH2PO4添加量为0.5%时菌丝体生物量和胞外多糖含量均达最大,分别为13.0 g/L和9.1 g/L,其最佳添加量为0.5%,选择0.3%、0.5%和0.7%添加量进行后续试验。MgSO4·7H2O添加量为1%时菌丝体生物量和胞外多糖含量均达最大,分别为13.2 g/L和9.24 g/L,其最佳添加量为1%,选择0.8%、1%和1.2%添加量进行后续试验。
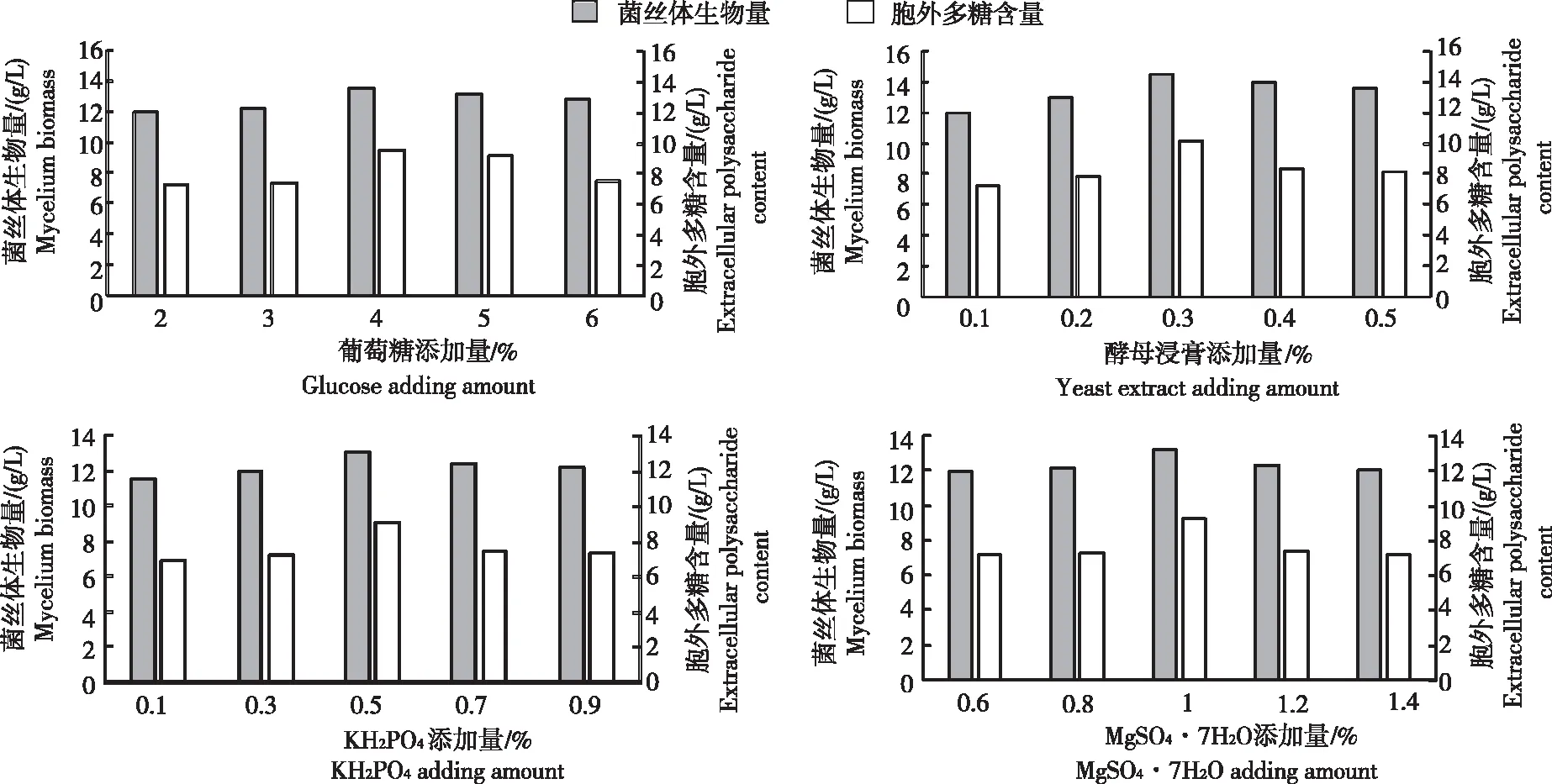
图2不同液态培养基发酵条件胶陀螺菌丝体的生物量与胞外多糖含量
2.3胶陀螺菌丝体液态发酵培养基的最优配方
从表2看出,处理4和处理8胶陀螺菌丝体的生物量最高,均为14.8 g/L;其次是处理14和处理13,分别为14.7 g/L和14.6 g/L;处理18最小,为11.9 g/L。对试验结果进行多项式拟合回归得回归方程为Y=14.60-0.11A-0.19B-0.017C-0.083D-0.30AB+0.000AC+0.43AD-0.17BC+0.25BD+0.23CD-1.09A2-0.64B2-1.30C2-1.00D2,模型P<0.000 1(表3),表明试验的二次多项式模拟极显著,模型的R2= 0.965 1(AdjR2= 0.930 1),说明,响应值的变化有93.01%来自所选变量;变异系数(CV)为1.81%,模型准确度较高,变异的可能性很小。同时,失拟项P值为极不显著,说明,该模型拟合程度较好。因此,可利用该模型对胶陀螺菌丝体的液态培养条件进行优化。该模型中一次项A和二次项A2、B2、C2、D2对菌丝体生物量的影响均为极显著,一次项B和交互项AB为显著。各因素对胶陀螺菌丝体生物量的影响依次为A、D、C、B。

表2胶陀螺菌丝体液态发酵培养基响应面试验的设计方案

表3胶陀螺菌丝体液态发酵培养基响应面回归方程的方差分析
注:**表示差异极显著(P<0.01);*表示差异显著(P<0.05)。
Note: ** indicates that the difference is extremely significant (P<0.01); * indicates significant difference (P<0.05).
从图3看出,各响应面均为开口向下的凸形曲面,说明,响应值存在极高值。葡萄糖(A)、酵母浸膏(B)、KH2PO4(C)和MgSO4·7H2O(D)4个因素之间彼此存在交互影响。通过线性回归方程得出胶陀螺菌丝体液态发酵培养基的最优配方:葡萄糖添加量为4.6%、酵母浸膏添加量为0.3%、KH2PO4添加量为0.5%和MgSO4·7H2O添加量为1%。此条件下胶陀螺菌丝体的生物量为14.95 g/L。

图3不同因素交互作用胶陀螺菌丝体的生物量响应面
2.4胶陀螺菌丝体的抗氧化活性
从图4可知,低浓度的胶陀螺菌丝体对DPPH自由基和ABTS自由基均具备清除能力,且随着浓度的增加该清除能力呈递增趋势。DPPH自由基作为一种抗氧化的反应,在515 nm处的吸光度有特征吸收峰。当菌丝体和VC浓度增至1.3 mg/mL时,对DPPH和ABTS自由基清除率分别为68.25%、78.38%和82.17%、85.78%,VC的清除能力均略高于菌丝体的。

图4胶陀螺菌丝体对 DPPH和 ABTS自由基的清除率
3结论与讨论
研究结果表明,在葡萄糖、酵母浸膏、KH2PO4和MgSO4·7H2O添加量分别为4.6%、0.3%、0.5%和1%时,胶陀螺菌丝体液态发酵的效果最佳,菌丝体生物量为14.95 g/L。胶陀螺菌丝体对DPPH和ABTS自由基均具备清除能力,当其浓度为1.3 mg/mL时,清除率分别达68.25%和78.38%。胶陀螺自然发酵液中富含多种氨基酸和无机元素,同时含有柠檬酸和酒石酸等物质[15];胶陀螺子实体含有蛋白质、脂肪和糖等多种营养成分,氨基酸含量达6.84%[16];胶陀螺子实体对水相对沙门氏菌、金黄色葡萄球菌、链球菌和大肠杆菌均有一定抑制作用[17];同时,前人对胶陀螺中含有的光敏活性物质进行过相关分析,并提出了相应的处理办法[18]。在今后研究中应该加强对液态发酵物营养成分以及抑菌功效的测定,同时,对液态发酵状况下光敏活性物质进行检测研究,为后续的动物试验及未来相关产品开发提供安全保障。

