膳食联合STZ诱导胰岛素抵抗的2型糖尿病大鼠模型的建立
桑延霞,张军军
(广东药科大学医药化工学院,广东 广州 510006)
全球约4.24亿人患有糖尿病,其中90%~95%患者为2型糖尿病[1],建立2型糖尿病动物模型是筛选糖尿病药物及深入研究2型糖尿病及其并发症的基础。目前,2型糖尿病大鼠建模方法主要有化学试剂诱发、自发性筛选、转基因和基因敲除、特殊膳食诱导等[2-5]。单一化学试剂诱发法对剂量把控要求较高,剂量过低,不易成模,剂量过高,死亡率大[6-8],易导致1型糖尿病。膳食诱导,耗时长,淘汰率高,造模成本高[9-11]。基因改造方法技术难度高,耗资大[12- 13]。目前多采用膳食诱导辅以低剂量STZ诱导构建2型糖尿病模型,但模型构建也受动物种类、年龄、性别、饮食、饲养环境、诱变剂量、禁食状态、诱导后的饮食状况等很多因素的影响[14-17]。本研究充分考虑了上述因素的影响,利用高糖高脂饮食诱发大鼠外周胰岛素抵抗,再以不同剂量的STZ诱导胰岛细胞的凋亡,最终建立一种符合2型糖尿病发病机制的动物模型。
1 仪器与材料
1.1 主要仪器
Elx800 酶标仪(Bio Tek);微量血糖测定仪(Onetouch Ultra,Johnson);ME104 电子天平(Mettler Toledo)。
1.2 试剂
STZ(Sigma公司);胰岛素检测试剂盒(Blue gene公司,上海);高糖高脂饲料(蔗糖20%+猪油10%+胆固醇2.5%+胆酸钠1% ,其余为维持料,广东省医学实验动物中心提供);真空采血管(沧州永康医药用品有限公司);葡萄糖、柠檬酸钠、乙醚均为国产分析纯试剂。
1.3 实验动物
雄性SD大鼠,4~5周龄,体质量90~100 g,广东省医学实验动物中心提供,生产许可证号SCXK(粤)2018-0002。
2 方法
2.1 模型的建立

喂养8周后,于注射STZ前2天,白天禁食16 h,测FPG、空腹胰岛素(FINS)。恢复正常饮食2 d,测定口服糖耐量(OGTT)。正常饮食2 d后,白天禁食16 h,称量体质量,L组、H组分别以30、60 mg/kg的剂量一次性腹腔注射用0.1 mmol/L柠檬酸缓冲液(pH 4.4)配制的0.5%STZ,Control组注射1 mL的柠檬酸缓冲液,注射1 h后给食和0.5%的葡萄糖水。STZ诱导2周后,白天禁食16 h,测定体质量、FBG、FINS。恢复休养2 d后,测定OGTT。
2.2 FINS的测定
大鼠乙醚麻醉后,眼丛静脉取血,1 000g离心10 min,取上清,按试剂盒说明书测定血清胰岛素含量。
2.3 OGTT实验
STZ诱导2周后,全部大鼠白天禁食16 h后,将20%的葡萄糖溶液以2 g/kg的剂量灌胃,期间可自由进水,分别在0 min(给糖前),给糖后30、60、120、180 min尾静脉采血测定血糖,绘制血糖-时间曲线,利用梯形法计算给糖2 h内血糖曲线下面积(GAUC)。
2.4 统计学方法
3 结果
3.1 各组大鼠体质量的变化

********#ControlLH48043038033028023018013080体质量/g0周4周8周10周
与对照组比较:*P<0.05,**P<0.01;与低剂量STZ组比较:#P<0.05。
图1各组大鼠体质量的变化
Figure1Changes of body weight of rats in each group
3.2 各组大鼠FBG的变化
由图2可以看出,STZ注射前的8周内,各组间FBG差异均无统计学意义,且都在正常范围内,第10周(STZ注射后2周)时,L、H组FBG显著高于Control组(P<0.01),分别为9.8、13.9 mmol/L,且H组也明显高于L组(P<0.05),表明STZ对胰腺细胞造成了一定的损伤,导致血糖代谢异常。
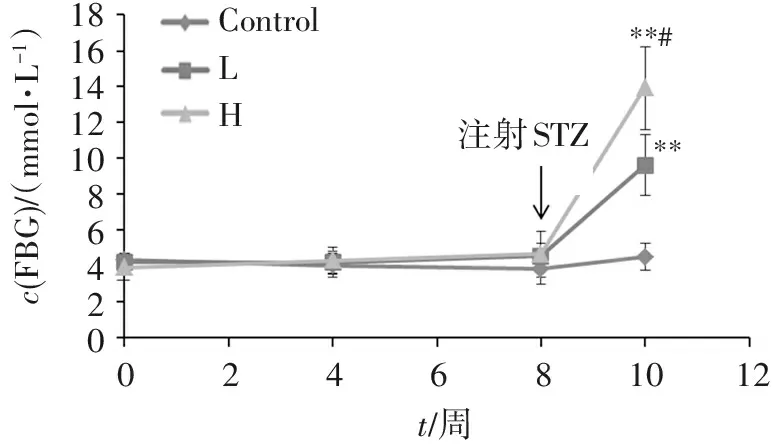
181614121086420c(FBG)/(mmol?L-1)注射STZ****#ControlLH101202468t/周
与对照组比较:**P<0.01;与低剂量STZ组比较:#P<0.05 。
图2各组大鼠FBG的变化
Figure2Changes of fasting blood glucose of rats in each group
3.3 各组大鼠FINS的变化
由图3可以看出,高糖高脂诱导4周后,各组FINS差异无统计学意义。第8周,L、H组FINS水平明显高于Control(P<0.05),出现高胰岛素血症。第10周(STZ注射2周后),L、H组FINS水平较第8周显著下降(P<0.01),但L组仍高于Control(P<0.05),继续维持高胰岛素血症,而H组则低于Control(P<0.05),出现低胰岛素血症,表明L、H组大鼠胰岛细胞受到了不同程度的损伤,且对STZ具有剂量依赖性。
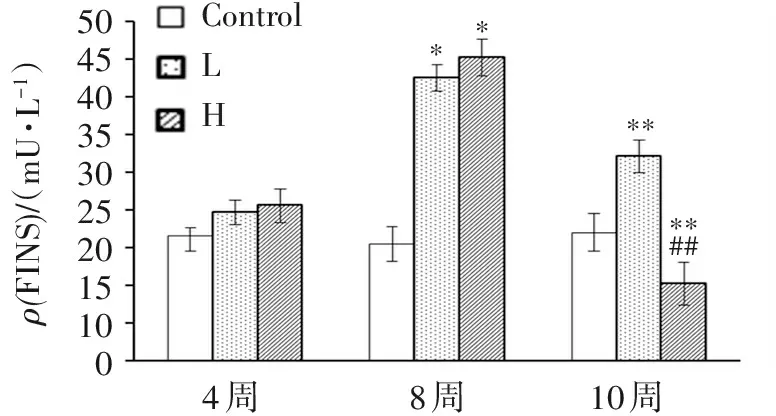
##***10周8周4周ControlLH*5045403530252015100ρ(FINS)/(mU?L-1)**
与对照组比较:*P<0.05,**P<0.01;与低剂量STZ组比较:##P<0.01。
图3各组大鼠FINS的变化
Figure3Changes of fasting insulin of rats in each group
3.4 各组大鼠糖耐受的变化
图4第8周的OGTT显示,仅在给糖后第1小时,L、H组与Control组血糖的差异有统计学意义,其他时间点差异均无统计学意义。图5第10周OGTT显示,经STZ诱导后,L、H组在各采血点的血糖均显著高于Control(P<0.01),且H明显高于L(P<0.05)。图6表明,第8周L、H组2 h血糖曲线下面积AUC都显著高于Control(P<0.05),预示高糖高脂诱导使大鼠出现了一定程度的糖耐量受损;第10周L、H组的GAUC均明显高于第8周(P<0.01),表明注射STZ后各组糖耐受的损伤加重。
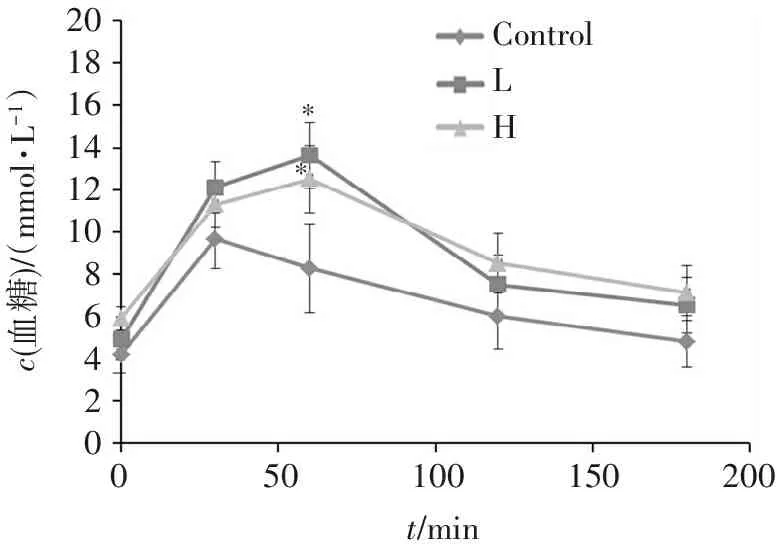
**20181614121086420c(血糖)/(mmol?L-1)ControlLH100150200500t/min
与对照组比较:*P<0.05。
图4第8周时各组大鼠的OGTT (STZ注射前)
Figure4OGTT of rats in each group at 8 weeks (before STZ injection)
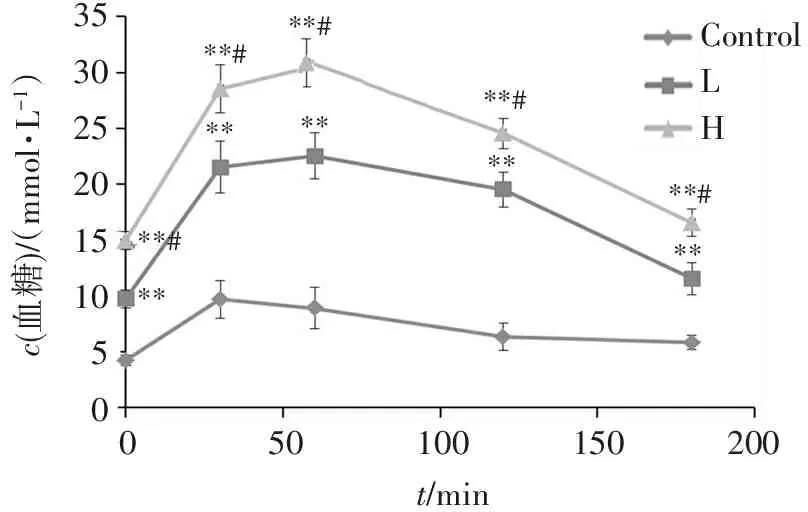
****#********#**#**#**#**35302520151050100150200500t/minControlLHc(血糖)/(mmol?L-1)
与对照组比较:**P<0.01;与低剂量STZ组比较:#P<0.05。
图5第10周时各组大鼠的OGTT (STZ注射后2周)
Figure5OGTT of rats in each group at 10 weeks (2 weeks after STZ injection)
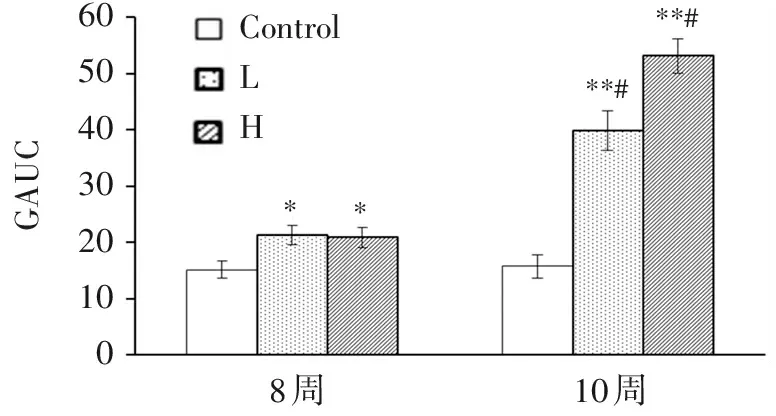
ControlLH**#**6050403020100GAUC10周8周**#
与对照组比较:*P<0.05;与8周时比较:**P<0.01;与低剂量STZ组比较:#P<0.05。
图6各组大鼠OGTT 2 h内GAUC(STZ注射后2周)
Figure6GAUC within 2 hours of OGTT in rats of each group (2weeks after STZ injection)
4 讨论
高热量饮食导致的肥胖使机体对胰岛素促进的葡萄糖摄取效率下降,机体代偿性分泌过多胰岛素产生胰岛素抵抗[22-23],同时糖毒性和脂毒性影响胰岛β细胞功能,造成胰岛素分泌障碍,最终形成2型糖尿病。
胰岛素抵抗和胰岛功能受损是2型糖尿病的典型病理生理特征[24],高热量饮食仅能诱导约50%的大鼠发生胰岛素抵抗,若用全部高热量饮食的大鼠进行STZ造模,必定有部分糖尿病大鼠无胰岛素抵抗而更类似1型糖尿病。因此本研究对4月龄雄鼠进行高糖高脂饮食诱导后,剔除食源诱导肥胖抵抗大鼠,选出有胰岛素抵抗的食源性肥胖大鼠,再进行STZ诱导,使模型更符合2型糖尿病的病理生理机制。本研究中,高糖高脂饮食8周大鼠出现了胰岛素抵抗,但血糖仍维持在正常水平,具有了早期糖尿病的特征。
腹腔注射不同剂量STZ后,胰岛细胞受到不同程度的损伤,60 mg/kg高剂量STZ严重导致胰岛β细胞功能性障碍,胰岛素分泌不足,致使血糖升高,糖耐量下降,体质量减轻,表现出1型糖尿病和晚期2型糖尿病的症状。30 mg/kg低剂量STZ对胰岛β细胞的损伤较轻,胰岛素分泌能力虽然有所下降,但血浆胰岛素仍显著高于对照组,继续保持胰岛素抵抗的症状,同时胰岛损致使血糖升高,达到糖尿病的诊断标准,使大鼠模型表现出早中期2型糖尿病的典型特征。
在2型糖尿病大鼠模型的构建中,动物性别、月龄、食源、造模方法等是影响模型成功率的主要因素。与多数文献报道的不同[6,9,15,21],本研究使用4月龄雄鼠,缩短了造模时间,减少了内源性激素的干扰;遵循大鼠昼的生活习性,采用白天禁食的方式,同时注射STZ后及时给予低浓度葡萄糖水,避免低血糖造成的死亡,以上措施使成模率达到64%。
本研究表明,高热量饮食辅以60 mg/kg STZ诱导4月龄雄性大鼠易致1型糖尿病和晚期2型糖尿病;高热量饮食辅以30 mg/kg STZ诱导能更快形成具胰岛素抵抗的早中期2型糖尿病,并能提高成模率。

