杜仲黄酮对脂多糖诱导小鼠急性肺损伤的保护作用及机制
曾文兰,吴朝文
(深圳市龙华区中心医院,广东 深圳 518110)
急性肺损伤(acute lung injury,ALI)是一类以中性粒细胞浸润,内皮细胞和肺泡上皮细胞完整性被破坏以及肺泡毛细血管弥漫性损伤为特征,最终导致呼吸衰竭,甚至死亡的呼吸道感染类疾病,其中肺水肿和急性呼吸性窘迫是其主要的临床表现[1]。ALI以其显著的高发病率和死亡率的特点对公共健康产生重大影响,研究统计ALI致死率已高达30%~50%[2]。机械通气、激素和抗炎药物是目前临床上常用的治疗方法,但均存在明显缺点,如应用机械通气,由于受各种条件限制,难以广泛推广,而激素和抗炎等药物副作用明显,预后差等[3],故寻找安全有效的防治ALI药物显得尤为紧迫。
杜仲(Eucommia ulmoides)是杜仲科植物杜仲的干燥树皮,具有强筋壮骨、调理冲任、固经安胎和补益肝肾的功效。近年来研究表明其主要有效成分杜仲黄酮具有抗氧化、抗炎和抗衰老等药理作用[4]。目前杜仲黄酮对脂多糖(Lipopolysaccharide,LPS)诱导ALI的研究尚未见报道,本实验拟基于TGF-β/smad信号通路探讨杜仲黄酮对LPS诱导小鼠ALI的影响及其作用机制,为临床应用提供实验依据。
1 材料与方法
1.1 药物与试剂
DMEM培养基、LPS(美国Sigma);胎牛血清(Sciencell生物技术公司);地塞米松(DEX)片(规格0.75 mg/片,广东南国药业有限公司);杜仲(亳州市安博药业有限公司);肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)ELISA检测试剂盒(博士德生物技术有限公司);超氧化物歧化酶(SOD)活性检测试剂盒、丙二醛(MDA)含量检测试剂盒(南京建成股份有限公司);TGF-β和Smad2单抗(上海钰博生物科技有限公司)。
1.2 主要仪器
RE-2000B旋转蒸发仪(郑州市亚荣仪器有限公司);752N紫外可见分光光度计(南京晓晓仪器设备有限公司);XDS-1倒置显微镜(南京山特仪器有限公司);BC-6900全自动血液细胞分析仪(深圳迈瑞生物医疗电子股份有限公司); H1650R台式高速冷冻离心机(湘仪离心机仪器有限公司);BS-1101多功能酶标仪(南京德铁实验设备有限公司);YB-6LF生物组织石蜡包埋机(亚光科技股份有限公司);KD-3390智能感知石蜡切片机(上海珂淮仪器有限公司);K8420全自动凝胶成像系统(南京世研仪器设备有限公司)。
1.3 细胞与动物
Raw264.7细胞由上海中科院细胞库提供。BALB/c小鼠,60只,SPF级,雌雄各半,体质量18~22 g,购买于广东省医学实验动物中心,生产许可证号:SCXK(粤)2015-0014。
1.4 方法
1.4.1 杜仲黄酮的提取及含量检测 参照文献[5]的方法提取杜仲黄酮,主要工艺条件如下:精确称取杜仲1 kg,使用质量分数为70%乙醇,料液比(g∶mL)为1∶10,80 ℃条件下分别提取3次,每次回流2.0 h,并使用旋转蒸发仪蒸去乙醇,浓缩至原体积1/30。使用紫外分光光度法,检测波长为500 nm,检测得杜仲黄酮质量分数为0.27%。
1.4.2 Raw264.7细胞培养 用0.25%的胰蛋白酶2.5 mL,37 ℃恒温水浴箱中振荡消化15 min,加入DMEM培养基终止消化。反复吹打并调整细胞密度为1×105/mL,吸出细胞悬液放入培养瓶,置于37 ℃、 5%(φ)CO2培养箱中培养。传代后的细胞接种于96孔培养板中,待细胞重新长满汇合后,用于细胞存活率和培养液中TNF-α和IL-1β的含量测定。
1.4.3 分组与给药 适应性喂养小鼠1周后,按动物体质量随机分为6组,包括假手术组、模型组、DEX组,杜仲黄酮低剂量(DZ-L)组、中剂量(DZ-M)组、高剂量(DZ-H)组,每组10只。于造模前连续灌胃给药7 d,DEX组灌胃给药2 mg/(kg·d),DZ-L、DZ-M和DZ-H组分别灌胃给药50、100、200 mg/(kg·d),假手术组和模型组以等量生理盐水灌胃。
1.4.4 小鼠ALI模型的建立 各组小鼠连续灌胃给药7 d后,末次给药1 h后开始造模,2%异戊巴比妥钠腹腔注射麻醉小鼠,仰卧固定于37 ℃恒温手术台。参照文献[6]方法造模,造模主要步骤如下:小心剃去颈部正中毛发,酒精消毒,正中切开颈部皮肤约2 cm,暴露及分离气管,利用胰岛素注射器于气管内慢慢滴注LPS 5 mg/kg(0.5 mL/kg),假手术组气管内滴注等量生理盐水,碘伏消毒伤口并缝合皮肤,建立小鼠急性肺损伤模型。造模24 h后,摘眼球取血,4 ℃冰箱静置3 h后,3 500 r/min离心15 min,分离血清,-20 ℃保存,待测。各组小鼠小心剪开颈部皮肤并分离气管,行气管插管。剖开胸部,结扎右支气管,用磷酸缓冲液灌洗左肺,共3次,2 mL/次,收集BALF并离心(4 ℃,1 300 r/min,5 min)。
1.5 指标检测
1.5.1 RAW264.7细胞存活率测定 将对数生长期的Raw264.7细胞,用含10%(φ)胎牛血清的DMEM培养基稀释为1×105/mL,100 μL接种于96孔板,空白对照组和模型组(LPS 80 ng/mL)更换成新鲜含10%胎牛血清的DMEM培养基,杜仲黄酮给药组加入不同浓度的杜仲黄酮含10%胎牛血清的DMEM培养基(终浓度分别为2、4、8、16、32、64 μmol/L),调零组为无细胞组,其他步骤同空白对照组,每组设立6个平行孔,24 h后,CCK-8法检测细胞存活率。按照下列公式计算存活率:存活率=(处理组吸光度值-调零组吸光度值)/(空白对照组吸光度值-调零组吸光度值)×100%。
1.5.2 RAW264.7细胞上清培养液TNF-α和IL-1β含量测定 将处于对数生长期的Raw264.7细胞用含10%胎牛血清的DMEM培养基稀释为1×105个细胞后接种于12孔板中,贴壁培养24 h后分为空白对照组、模型组(LPS 80 ng/mL)、DZ-L组(4 μmol/L)、DZ-M组(8 μmol/L)和DZ-H组(16 μmol/L)。细胞继续培养24 h,收集细胞上清液,离心5 min(3 500 r/min)。按照TNF-α和IL-1β检测试剂盒说明书步骤分别检测TNF-α和IL-1β的含量。
1.5.3 BALF蛋白含量测定 BCA蛋白定量试剂盒检测BALF中蛋白含量,实验操作均按照试剂盒说明书进行。
1.5.4 BALF中白细胞计数 用800 μL 0.01 mol/L(pH 7.4)的PBS缓冲液重悬BALF沉淀物,吹打均匀后,取400 μL于血液分析仪中检测白细胞数目。
1.5.5 肺湿干质量比(W/D) 称取左肺上叶为湿质量,将左肺上叶放入恒温干燥箱(105 ℃)烤72 h,干燥至恒质量,并称取记录为干质量,按下列公式计算:肺湿干质量比=湿质量/干质量。
1.5.6 肺组织病理形态学观察 取右肺下叶,10%(φ)中性甲醛浸泡固定24 h,流水冲洗12 h,常规石蜡包埋,切片,苏木精伊红染色,封片,显微镜下进行病理观察。
1.5.7 生化指标检测 血清中SOD活性和MDA的含量测定按照相应检测试剂盒说明书进行。
1.5.8 肺组织TGF-β1和Smad2的表达水平 BCA试剂盒检测肺组织匀浆总蛋白浓度,加入等量样品于电泳槽进行SDS-聚丙烯酰胺凝胶电泳。经过转膜、封闭、孵育TGF-β1(1∶3 000)、Smad2(1∶2 000)一抗过夜; 洗膜、孵育二抗(1∶7 000)、洗膜、显影,使用Image J软件半定量分析各条带灰度值。
1.6 统计学方法

2 结果
2.1 杜仲黄酮对RAW264.7细胞存活率的影响
从图1结果可知,2、4、8、16、32、64 μmol/L杜仲黄酮分别处理RAW264.7细胞24 h后,杜仲黄酮给药终浓度为32 μmol/L时,细胞存活率为84.23%;而给药终浓度为64 μmol/L时,细胞存活率为74.53%。

105100959085807570650248163264c(杜仲黄酮)/(μmo?L-1)存活率/%
图1杜仲黄酮对RAW264.7细胞存活率的影响
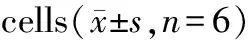
2.2 杜仲黄酮对RAW264.7细胞TNF-α和IL-1β的影响
从图2结果可见:与空白对照组比较,模型组TNF-α和TNF-1β含量明显升高(P<0.05)。与模型组比较,DEX组和杜仲黄酮给药组TNF-α和TNF-1β含量均明显降低(P<0.05)。与DEX组比较,DZ-L组TNF-α和TNF-1β含量明显升高(P<0.05)。与DZ-L组比较,DZ-H组TNF-α和TNF-1β含量明显降低(P<0.05)。
aabbdbcbbbbd9008007006005004003002001000TNF-α/(ng?mL-1)IL-β/(ng?mL-1)706050403020100aabbddbccbbddbABCDEF
A.空白对照组; B.模型组; C. DEX组; D. DZ-L组; E. DZ-M组; F. DZ-H组。
与空白对照组比较:aaP<0.01;与模型组比较:bP<0.05,bbP<0.01;与DEX组比较:cP<0.05,ccP<0.01;与DZ-L组比较:dP<0.05,ddP<0.01。
图2杜仲黄酮对RAW264.7细胞TNF-α和IL-1β含量的影响

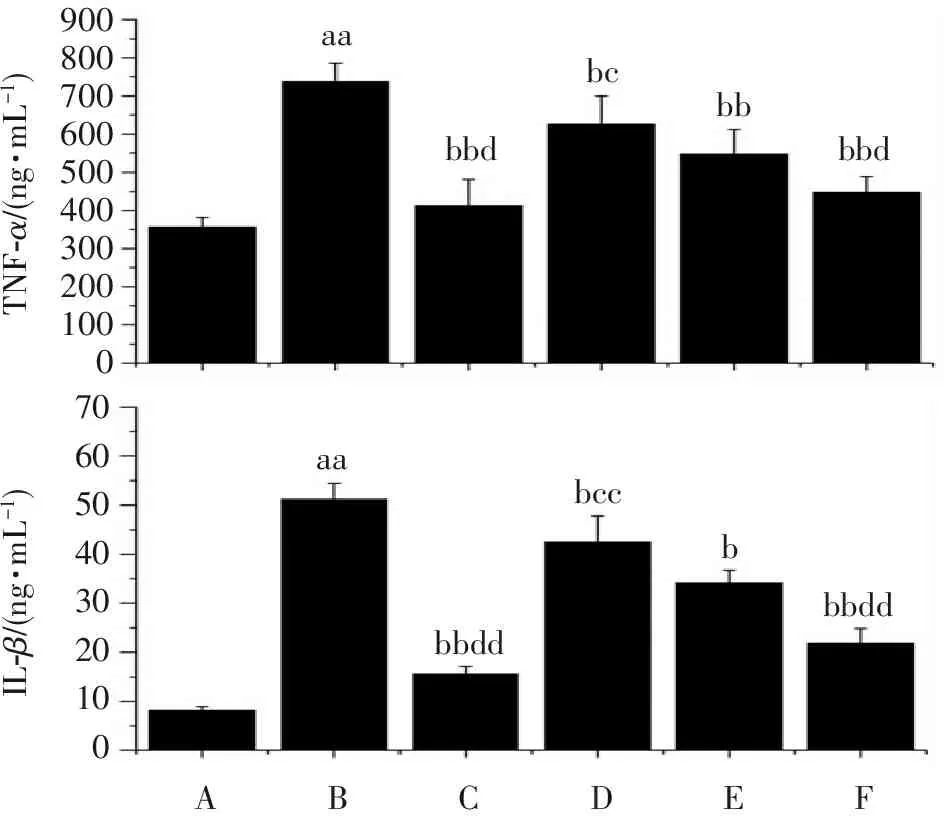
2.3 杜仲黄酮对BALF蛋白含量和白细胞的影响
从图3结果可见:与假手术组比较,模型组小鼠蛋白含量和白细胞数量均明显升高(P<0.05)。与模型组比较,DEX组和杜仲黄酮给药组小鼠蛋白含量和白细胞数量均明显降低(P<0.05)。与DEX组比较,DZ-L组小鼠蛋白含量和白细胞数量明显升高(P<0.05)。与DZ-L组比较,DZ-H组小鼠蛋白含量和白细胞数量明显降低(P<0.05)。
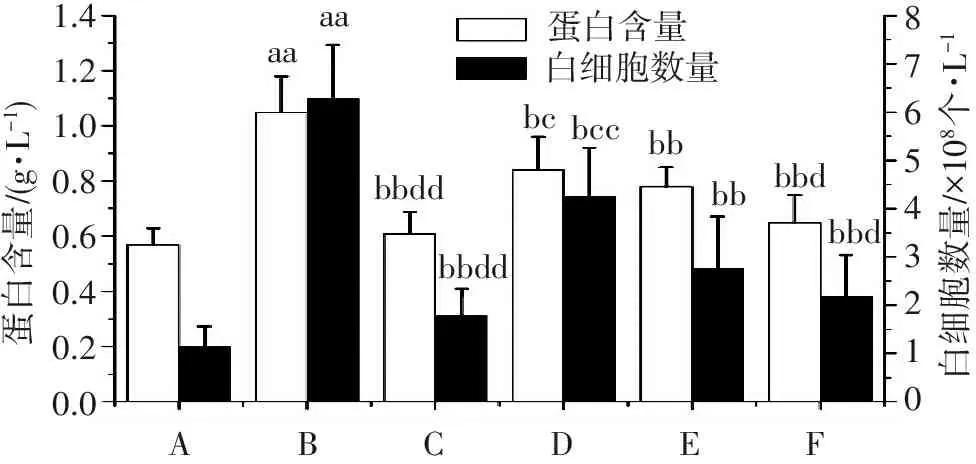
2.4 杜仲黄酮对肺组织湿干质量比的影响
从图4结果可见:与假手术组比较,模型组小鼠肺组织湿干质量比明显升高(P<0.05)。与模型组比较,DEX组和杜仲黄酮给药组小鼠肺组织湿干质量比均明显降低(P<0.05)。与DEX组比较,DZ-L组小鼠肺组织湿干质量比明显升高(P<0.05)。与DZ-L组比较,DZ-H组小鼠肺组织湿干质量比明显降低(P<0.05)。
2.5 杜仲黄酮对肺组织病理形态学的影响
从图5结果可见:假手术组小鼠肺组织结构清晰,肺泡腔无渗出液,肺泡间隔无水肿,无炎症细胞浸润。模型组小鼠肺组织有大小不一的散在出血斑块,弥漫性肺水肿,肺泡壁和肺泡间隔明显增宽,大量炎症细胞浸润。与模型组比较,DEX组小鼠肺泡结构比较完整,肺间隔未见明显增厚,肺泡渗出液少,炎症细胞浸润也较少;DZ-H组小鼠肺泡渗出液和炎症细胞浸润较少,肺间隔增厚较轻,出血现象较轻;DZ-L组和DZ-M组小鼠肺组织的病理变化改善不及DZ-H组。
蛋白含量/(g?L-1)1.41.21.00.80.60.40.20.0aabbddbccbbdbbaabbddbcbbdbb876543210白细胞数量/?108个?L-1蛋白含量白细胞数量ABCDEF
A.假手术组; B.模型组; C. DEX组; D. DZ-L组; E. DZ-M组; F. DZ-H组(下同)。
与假手术组比较:aaP<0.01;与模型组比较:bP<0.05,bbP<0.01;与DEX组比较:cP<0.05,ccP<0.01;与DZ-L组比较:dP<0.05,ddP<0.01。
图3杜仲黄酮对各组小鼠BALF蛋白含量和白细胞数量的影响

bbdaabbbcbbd121086420W/DABCDEF
与假手术组比较:aaP<0.01;与模型组比较:bP<0.05,bbP<0.01;与DEX组比较:cP<0.05;与DZ-L组比较:dP<0.05。
图4杜仲黄酮对各组小鼠肺组织湿干质量比的影响

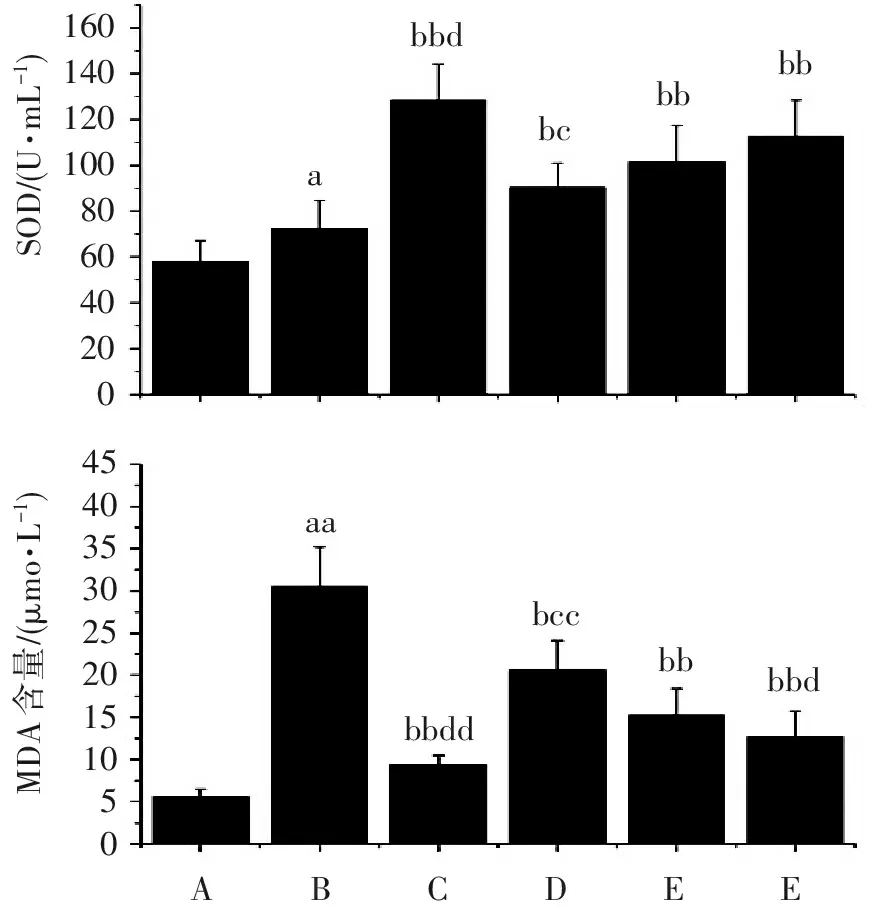
2.6 杜仲黄酮对小鼠血清SOD、MDA的影响
从图6结果可见:与假手术组比较,各组小鼠血清SOD活性和MDA含量明显升高(P<0.05);DEX组小鼠血清SOD活性明显比模型组升高(P<0.05),而MDA含量明显降低(P<0.05)。与DEX组比较,DZ-L组小鼠血清SOD活性明显升高(P<0.05),MDA含量明显降低(P<0.01)。与DZ-L组比较,DZ-H小鼠血清SOD活性明显升高(P<0.05),MDA含量明显降低(P<0.05)。

图5各组小鼠肺组织病理形态学观察(HE染色,20×)
Figure5Effect of flavonoids from Eucommia umoides on the pathological changes of lung tissues in each group (HE staining,20×)
abcbbbbdbbaabbddbccbbdbb160140120100806040200454035302520151050MDA含量/(μmo?L-1)SOD/(U?mL-1)ABCDEE
与假手术组比较:aP<0.05,aaP<0.01;与模型组比较:bP<0.05,bbP<0.01;与DEX组比较:cP<0.05,ccP<0.01;与DZ-L组比较:dP<0.05。
图6杜仲黄酮对各组小鼠血清SOD活性和MDA含量的影响

2.7 杜仲黄酮对各组小鼠肺组织TGF-β1和Smad2表达的影响
从图7结果可见:与假手术组比较,各组小鼠肺组织TGF-β1和Smad2表达量明显升高(P<0.05)。与模型组比较,DEX组小鼠肺组织TGF-β1和Smad2表达量明显降低(P<0.05),而DZ-H组小鼠TGF-β1和Smad2表达量明显比DEX组降低(P<0.05)。与DZ-L组比较,DZ-H组小鼠TGF-β1和Smad2表达量明显降低(P<0.05)。

ABCDEFTGF-β1β-ActinSmad2aabbbbcdbaabbbbbcdbb1.21.00.80.60.40.20.01.00.80.60.40.20.0TGD-β1/β-actinSmad2/β-actinABCDEF
与假手术组比较:aP<0.05,aaP<0.01;与模型组比较:bP<0.05,bbP<0.01;与DEX组比较:cP<0.05;与DZ-L组比较:dP<0.05。
图7杜仲黄酮对各组小鼠肺组织TGF-β1和Smad2表达的影响

3 讨论
急性肺损伤是由各种因素所致的肺弥漫性炎症损伤,以呼吸窘迫及进行性低氧血症为特征,是临床常见危重症。多种病因均可诱发ALI,其中革兰阴性菌感染所致的肺炎是ALI最常见的发病因素,内毒素是革兰阴性菌感染时解体后所释放的一种毒性物质,可激活机体的免疫体统,诱使TNF-α、IL-1β等炎症细胞因子的释放,引起机体急性炎症,是目前研究ALI较理想的诱导剂[7]。虽然ALI致病机制目前尚未完全明确,但较多研究认为肺组织的炎症反应失衡是导致各种ALI的根本原因[8],而氧化损伤也是导致ALI的重要原因之一[9]。地塞米松是临床上常见的一种糖皮质激素类药物,长期过量用药可引起较多的副作用,因此其临床应用受到一定限制。有研究表明地塞米松可较好地减轻ALI所致的肺组织损伤[10],故本研究以地塞米松作为阳性对照药,对比杜仲黄酮对ALI的影响。
近年研究发现杜仲黄酮具有抗氧化、消炎、抗衰老等多种药理作用[4]。TNF-α和IL-1β等细胞炎症因子,参与多种组织炎症损伤,两者含量高低可反映肺组织炎症的严重程度[11]。细胞实验研究发现,与空白对照组比较,模型组TNF-α和IL-1β含量显著升高(P<0.05),而给予杜仲黄酮后可明显降低细胞TNF-α和IL-1β含量(P<0.05),表明杜仲黄酮可明显减轻ALI所致的炎症反应。
BALF蛋白含量和肺湿干质量比可反映肺组织血管通透性的异常以及肺水肿的严重程度[12],而白细胞数量可间接反映肺组织中中性粒细胞的浸润情况以及炎症的严重程度[13]。本研究发现,与假手术组比较,模型组小鼠蛋白含量、肺湿干质量和白细胞数量均明显升高(P<0.05),表明模型组肺组织水肿和炎症比较严重,提示造模成功。与模型组比较,杜仲黄酮给药组小鼠蛋白含量、肺湿干质量比和白细胞数量均明显降低(P<0.05),提示杜仲黄酮给药组可改善肺组织水肿程度和炎症程度,并呈剂量依赖性。此外,肺组织病理学观察发现模型组小鼠肺组织损伤严重,可见弥漫性肺水肿,肺泡壁和肺泡间隔明显增宽,大量炎症细胞浸润。而给予杜仲黄酮后上述病理变化明显减轻。
SOD和MDA是临床常规使用的检测机体抗氧化活性的两个重要指标[14]。本研究发现,与假手术组比较,模型组小鼠血清SOD活性明显升高(P<0.05),MDA含量明显降低(P<0.01),给予杜仲黄酮后可明显升高血清SOD活性(P<0.05),降低MDA含量(P<0.05),且呈剂量依赖性,表明杜仲黄酮可明显减轻氧化应激损伤,从而保护肺组织。
TGF-β1是一种多功能的细胞因子,其在细胞的生长和分化、胚胎发育、免疫调节、损伤后修复等方面均起着十分重要的作用,TGF-β1是ALI后纤维化密切相关的细胞因子之一,其致纤维化作用最强[15]。Smads作为TGF-β1的重要信号转导分子,研究表明[16]TGF-β1多种生物功能的发挥需要Smads蛋白的信号转导及精准调控。本研究发现,与模型组比较,杜仲黄酮给药组小鼠肺组织TGF-β1和smads表达量明显降低,表明杜仲黄酮通过调节TGF-β/Smad信号通路,从而对ALI起保护作用。
综上所述,杜仲黄酮对LPS所致的急性肺损伤具有较好的保护作用,其作用机制可能是通过调节TGF-β/Smad信号通路有关。

