大肠杆菌高密度培养发酵L-色氨酸
张震,熊海波,徐庆阳,2,3*
1(天津科技大学 生物工程学院,天津,300457) 2(代谢控制发酵技术国家地方联合工程实验室,天津,300457) 3(天津市氨基酸高效绿色制造工程实验室,天津,300457)
L-色氨酸为8种必需氨基酸之一,在人体代谢过程中发挥着不可替代的重要作用,故又被称为第二必需氨基酸[1]。它可以促进人和动物的生长发育,调节其新陈代谢水平和生理功能,促进消化,提高机体免疫力,因而被广泛用于食品、医药、饲料和农业等行业,在氨基酸生产中占有重要地位[2-3]。微生物直接发酵法是当前L-色氨酸生产的主流方法,该法利用性能优越的工程菌株生产色氨酸,其中大肠杆菌应用较多[4-5]。
在工程菌的大规模发酵过程中,外源基因表达水平以及菌体密度决定了重组异源蛋白产物的宏观合成量[6]。从理论上说,在维持外源基因表达水平不变的前提下,提高工程菌的发酵密度可以大幅度提高目的产物产量,提高发酵效率,降低生产成本[7]。而大肠杆菌工程菌的高密度培养技术(high cell density cultivation, HCDC)为解决这一需要应运而生。但是,限制大肠杆菌高密度培养的因素有很多,如宿主菌类型、培养基组成、培养方式、发酵条件控制、抑制性副产物的积累等[9-11]。因此除应用目的产物高产工程菌外,确定合适的发酵工艺并对工程菌株发酵条件进行优化是提高发酵水平的有效手段之一。其中,发酵接种量和底物磷酸盐添加量是2个重要的限制性因素[8, 12],二者直接影响工程菌的生长和目的产物的合成,从而影响整体发酵质量。
本研究在大肠杆菌发酵产L-色氨酸时,通过梯度试验先后对发酵接种量和底物磷酸盐添加量进行了优化,大幅提高了菌体最高密度及L-色氨酸产量,实现了较高水平的大肠杆菌高密度培养,为大肠杆菌高密度培养在L-色氨酸发酵中的应用提供了新思路。同时,对底物磷酸盐添加量对发酵的影响进行了着重分析,为L-色氨酸发酵生产中底物磷酸盐的调控提供了参考。
1 材料与方法
1.1 菌种
L-色氨酸工程菌EscherichiacoliTRTH (trpEDCBA+TetR),由天津科技大学代谢工程研究室提供。
1.2.1 活化培养基
酵母粉5 g/L,蛋白胨10 g/L,牛肉膏10 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,琼脂粉20 g/L,四环素20 mg/L。
1.2 培养基
1.2.2 种子培养基
葡萄糖40 g/L,酵母粉4 g/L,柠檬酸0.5 g/L, (NH4)2SO41 g/L,KH2PO45 g/L,VB11 mg/L,VH0.3 mg/L,MgSO4·7H2O 1.5 g/L,FeSO4·7H2O 2.8 mg/L,微量元素混合溶液0.2%(体积分数),参照杨梦晨[13]的方法配制。
1.2.3 发酵培养基
葡萄糖10 g/L,酵母粉4 g/L,柠檬酸2 g/L,(NH4)2SO44 g/L,KH2PO46 g/L,MgSO4·7H2O 2 g/L,FeSO4·7H2O 75 mg/L,VB15 mg/L,VH0.2 mg/L,微量元素混合溶液0.2%(体积分数)。
注:对于底物KH2PO4添加量梯度试验,除KH2PO4分别改为相应浓度外,其他成分均与上述发酵培养基一致。
1.3 主要仪器
LDZH-100KBS立式压力蒸汽灭菌器,上海申安医疗器械厂; 5 L不锈钢机械搅拌发酵罐,上海保兴生物设备工程有限公司;30 L不锈钢机械搅拌发酵罐,上海保兴生物设备工程有限公司;SBA-40E生物传感分析仪,山东省科学院生物研究所;TU 1810紫外可见分光光度计,北京普析通用仪器有限责任公司;LC20AT高效液相色谱仪,日本岛津公司;S-433D氨基酸分析仪,德国赛卡姆公司。
1.4 培养方法
1.4.1 菌种活化
取甘油管中菌种接种于斜面培养基中,37 ℃培养,传代2次,每代培养12 h。
1.4.2 5 L发酵罐培养
种子培养:利用5 L发酵罐进行种子培养,初始发酵液体积定容至3 L。初始通气量为2 L/min,初始搅拌转速为200 r/min,通过自动流加25%(质量浓度)的氨水控制发酵液pH值在7.0~7.2之间, 37 ℃培养,通过搅拌和通风控制溶氧,维持在250~350 mg/L之间,培养至细胞干重达到5~6 g/L。
发酵培养:参照程立坤等[14]的方法,利用5 L发酵罐进行发酵培养,初始发酵液体积定容至3 L。通过自动流加25%(质量浓度)的氨水控制培养基pH值在7.0~7.2之间,控制溶氧在250~400 mg/L,发酵过程中以泡敌消泡。底物葡萄糖消耗完后,根据DO反馈补料策略,流加质量浓度为800 g/L的葡萄糖溶液,维持零残糖发酵[15]。过程中每隔2 h测样、记录数据。
1.5 试验方法
1.5.1 接种量梯度控制发酵
当种子培养至细胞干重达到5~6 g/L时,分别按10%、15%、20%、25%(体积分数)接种量接入到新鲜的发酵培养基中,进行发酵对比试验,以菌体密度和产量为评价标准,选择最优结果。
1.5.2 底物磷酸盐梯度添加控制发酵
在最适接种量的基础上,以KH2PO4添加量作为变量,在不同批次发酵实验的底物中分别添加6、8、10、12 g/L KH2PO4,其他培养条件不变,进行发酵对比试验,以综合表现为评价标准,选择最优结果。
1.6 检测方法
1.6.1 pH值测定
采用Hamilton pH电极在线检测,精密试纸(pH 6.4~8.0)辅助检测。
1.6.2 菌体生物量测定
菌体密度以菌体干重表示,取10 mL发酵液,13 000 r/min离心2 min,将菌体用蒸馏水洗涤2次后置于真空干燥箱中80 ℃干燥至恒重后用分析天平称重。
1.6.3L-色氨酸含量测定
采用高效液相色谱法检测L-色氨酸含量。具体方法见参考文献[11]。
1.6.4 有机酸副产物含量测定
采用高效液相色谱法检测有机酸含量。色谱柱Aminex HPX-87H Column(300 mm×7.8 mm);流动相5 mmol/L H2SO4;柱温30 ℃;流速0.5 mL/min;紫外检测波长215 nm。
1.6.5 氨基酸副产物含量测定
采用德国赛卡姆公司氨基酸分析仪(S-433D)进行测定,具体方法见参考文献[16]。
1.6.6 磷酸盐含量的测定[17]
磷酸盐含量测定采用田康明等[17]的方法,采用江苏锐阳生物科技有限公司磷酸盐快速检测试剂盒进行测定。
1.7 分析方法
1.7.1 糖酸转化率计算
糖酸转化率SA根据公式(1)计算:
(1)
式中:ρ,L-色氨酸质量浓度,g/L;V,发酵液总体积,L;m,总耗糖量,g。
1.7.2 菌体比生长速率[18]
菌体比生长速率μ定义为单位质量菌体的瞬时增量,根据李会等[18]的研究,用公式(2)计算:
(2)
式中:X,x,菌体量,g/L;t,时间,h;μ,菌体比生长速率,h-1。
所有试验数据取3次实验的平均值。利用软件IBM SPSS Statistics 25进行分析,来确定数据差异的显著性(P<0.05)。
2 结果与讨论
2.1 接种量梯度发酵试验结果分析
为探究提高接种量对菌体生长和产酸的影响,设置10%、15%、20%、25%(体积分数)四个接种量梯度,并以10%(体积分数)(初始发酵工艺)作为对照组,进行发酵对比试验,检测菌体在发酵过程中的菌体密度与产量变化并绘制L-色氨酸合成速率曲线,结果如图1、2所示。
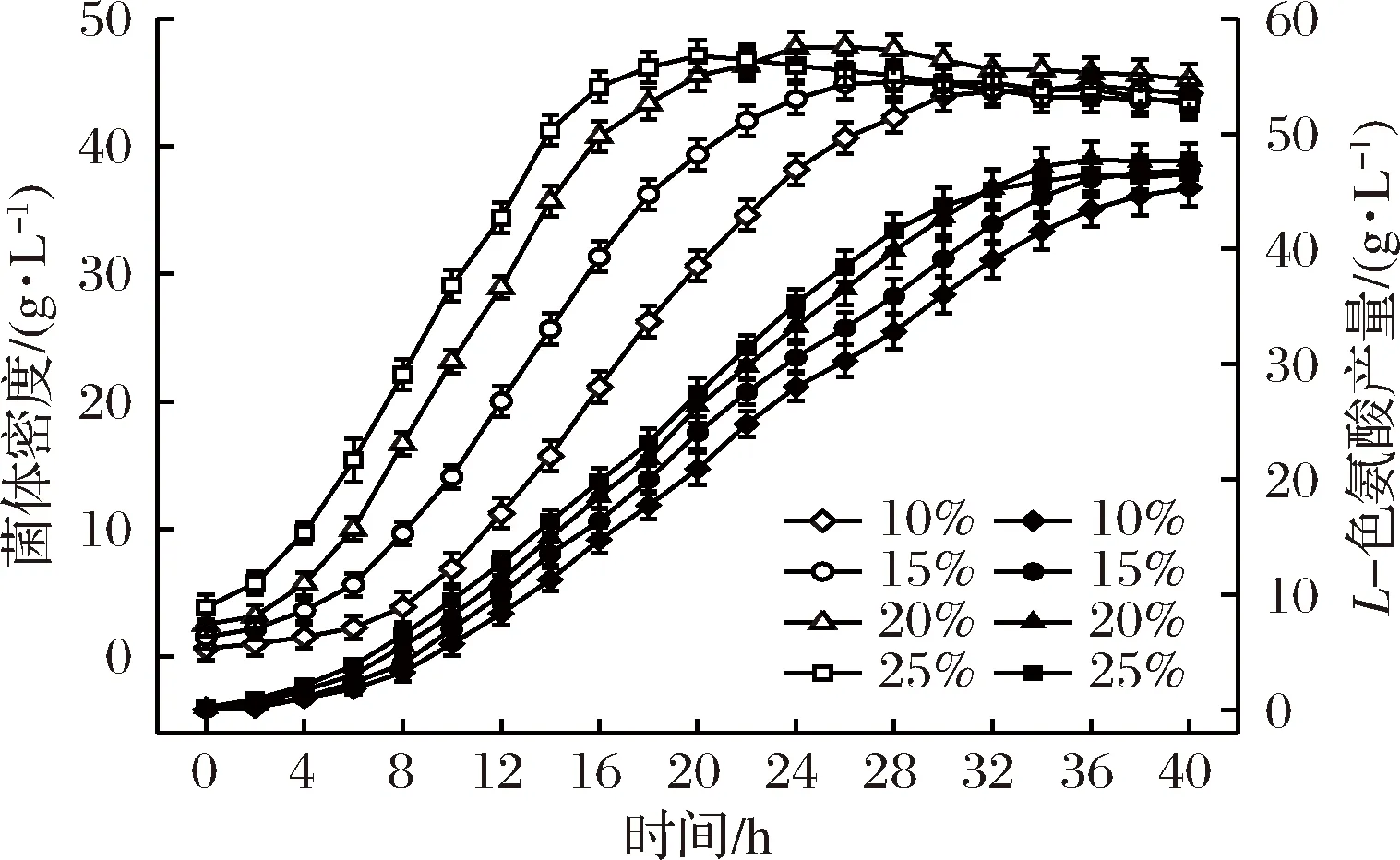
图1 接种量对菌体密度和L-色氨酸产量的影响Fig.1 Effects of inoculation amount on cell density and L-tryptophan production注:图1中空心图标为菌体密度,实心图标为L-色氨酸产量。
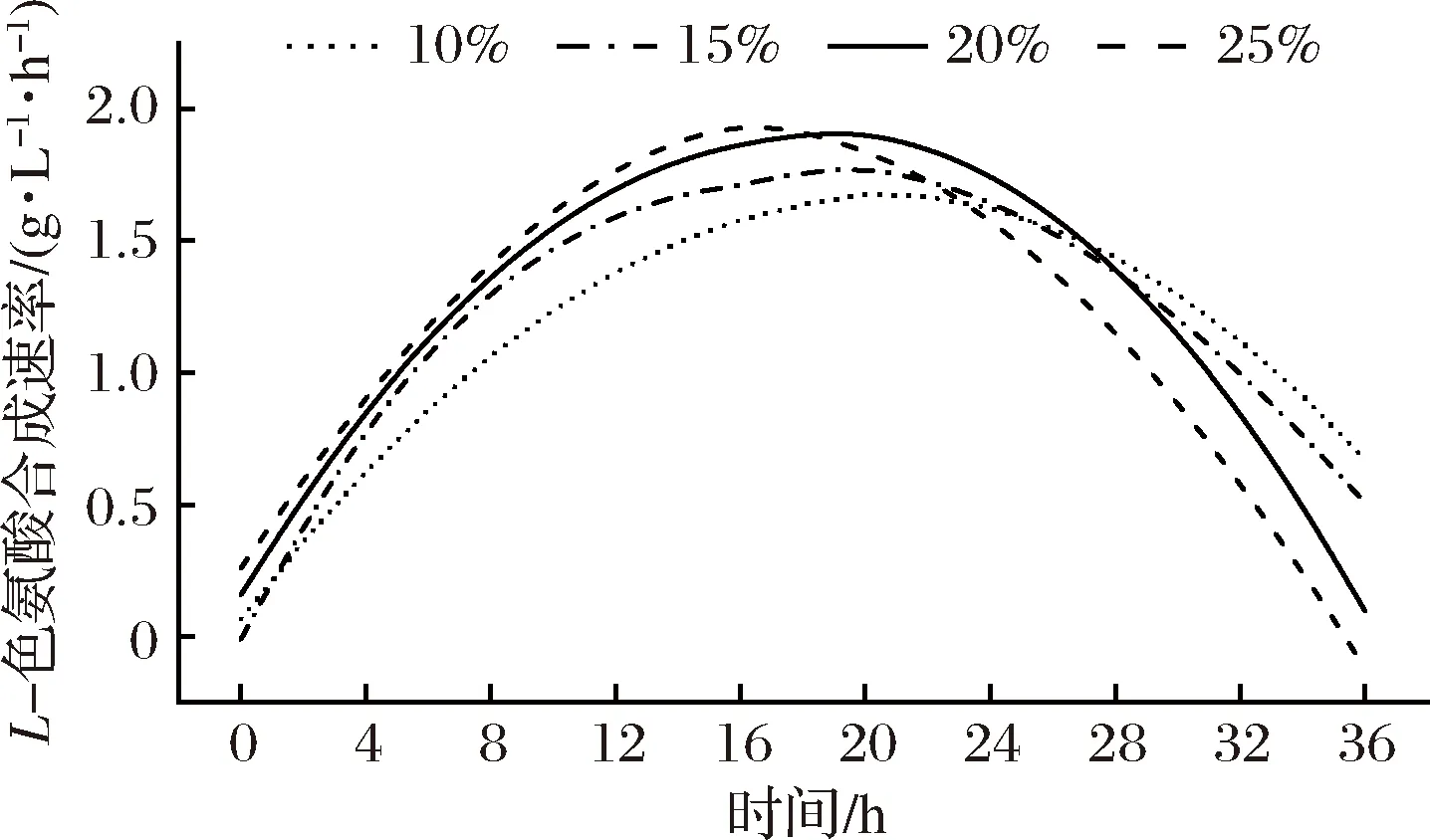
图2 接种量对L-色氨酸合成速率的影响Fig.2 Effects of inoculation amount on the rate of L-tryptophan synthesis
由图1可知,发酵延滞期随着接种量的增加逐渐缩短,接种量提高到20%(体积分数),发酵延滞期缩短至2 h以内;接种量继续提高至25%(体积分数),发酵延滞期几乎消失,菌体快速进入对数生长期。同时,接种量从10%逐步提高到20%(体积分数),最高菌体密度从44.79 g/L增加到47.76 g/L,有小幅增长(P<0.05);最终L-色氨酸产量分别为45.30 g/L与47.71 g/L,无显著差异(P>0.05)。接种量继续增加到25%(体积分数)时,最高菌体密度及最终L-色氨酸产量分别为47.07 g/L与46.51 g/L,与20%(体积分数)时相比没有明显提升,且发酵中后期菌体活力开始衰弱,菌体密度呈明显下降趋势。另外,从L-色氨酸合成速率(图2)来看,20%(体积分数)接种量时,发酵表现出更强的单位产酸能力,最高L-色氨酸合成速率为1.92 g/(L·h),远高于对照发酵的1.67 g/(L·h),产酸高峰期维持时间(6~30 h)也较长,这更有利于色氨酸的大量积累和实现菌体高密度培养。
分析可知,接种量影响菌体的适应能力和生长速率,是影响大肠杆菌高密度发酵的关键因素之一。种子液中含有大量的胞外水解酶,能促进菌体快速分解利用底物[19],接种量的增加使这些酶的量也相应增加,因此在营养物质充足的条件下,较大的接种量能强化菌体对新环境的适应能力,缩短延滞期,增强菌体活力,提高生长、产酸效率,为菌体的高密度培养打下良好基础。但同时,接种量过高可能会导致菌体生长过快,在发酵后期容易发生菌体自溶、迅速老化的情况,给发酵带来不利影响。综合考虑,选择20%(体积分数)作为接种量最优值,继续下一步优化。
2.2 底物磷酸盐梯度添加控制发酵试验结果分析
2.2.1 底物中KH2PO4添加量对菌体密度和产酸的影响
在接种量提高到20%(体积分数)的基础上,对底物K2HPO4添加量设置6、8、10、12 g/L四个梯度进行发酵对比试验,测定菌体在发酵过程中的菌体密度与产酸变化,计算并绘制比生长速率与L-色氨酸合成速率曲线,结果如图3所示。
由图3-a可知,随着底物KH2PO4添加量的提高,最高菌体密度逐渐增加,并在底物KH2PO4为12 g/L时达到峰值,为67.92 g/L,较底物KH2PO46 g/L(47.43 g/L)时提高了43.20%;最终L-色氨酸产量先增加,在底物KH2PO4为10 g/L时达到最高,为59.55 g/L,较6 g/L KH2PO4(47.49 g/L)时提高25.39%,之后开始下降。同时,从比生长速率μ(图3-b)和L-色氨酸合成速率(图3-c)来看,底物KH2PO4浓度的增加使菌体活力更加旺盛,前期生长速度明显加快,μmax也随之提高,并在12 g/L KH2PO4时达到最高,为0.53 h-1,较6 g/L KH2PO4时(0.34 h-1)提高了55.88%;10 g/L KH2PO4时,菌体表现出更持久的高单位产酸能力,其最高L-色氨酸合成速率为2.47 g/(L·h),较6 g/L KH2PO4时的1.87 g/(L·h)提高了46.52%,整体产酸水平随之大幅提升。

图3 不同KH2PO4添加量对菌体密度(a)、比生长速率(b)、L-色氨酸合成速率(c)的影响Fig.3 Effects of different KH2PO4 additions on cell density(a), specific growth rate(b),the rate of L-tryptophan synthesis(c)注:图3(a)中空心图标为菌体密度,实心图标为L-色氨酸产量。
2.2.2 底物KH2PO4添加量对发酵过程中磷酸盐消耗的影响
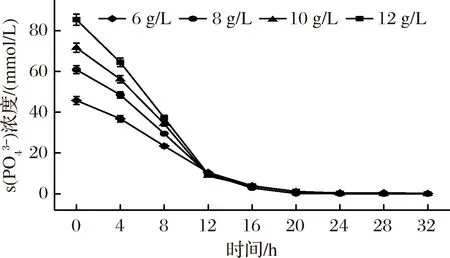
图4 底物KH2PO4添加量对发酵过程中磷酸盐消耗的影响Fig.4 Effect of substrate KH2PO4 addition on phosphate consumption during fermentation
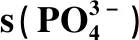
表1 不同KH2PO4添加量对每4 h内平均消耗速率的影响 单位:mmol/(L·h)Table 1 Effects of different KH2PO4 additions on average consumption rate of s every 4 h
2.2.3 底物中KH2PO4添加量对发酵耗糖和糖酸转化率的影响
发酵结束后,计算并绘制补糖速率与糖酸转化率过程曲线,结果如图5所示。由图5-a可知,底物KH2PO4为由6 g/L增加至12 g/L,最高补糖速率由13.06 g/(L·h)提升至15.51 g/(L·h),菌体糖代谢水平显著提升。同时,就糖酸转化率(图5-b)而言,底物KH2PO4为10 g/L时的糖酸转化率在整个发酵周期内均处于较高水平,其峰值达到了21.35%,较6 g/L KH2PO4时(18.82%)提高了13.44%,更多的碳源流向了目的产物,原料利用率大幅提高。
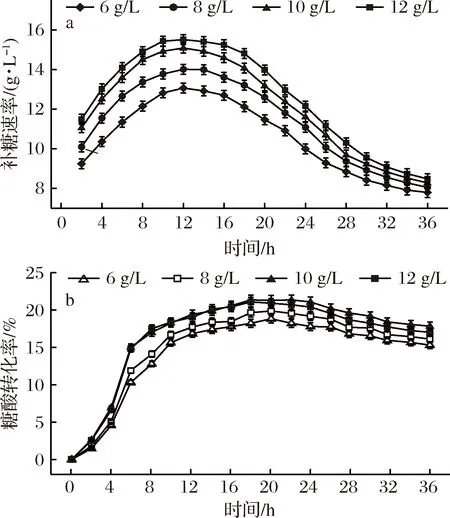
图5 不同KH2PO4添加量对补糖速率(a)和糖酸转化率(b)的影响Fig.5 Effects of different KH2PO4 additions on glucose feeding rate (a) and glucose conversion rate (b)
2.2.4 底物中KH2PO4添加量对发酵副产物的影响[20]
发酵结束后,对主要抑制性副产物乙酸、乳酸及丙氨酸最终含量进行检测,结果如图6所示。可知,底物KH2PO4添加量由6 g/L提高至10 g/L,各副产物积累量均有小幅上涨,但整体差异不大,且都处于合理水平,不会对发酵造成负面影响;底物KH2PO4添加量继续增加至12 g/L时,3种副产物积累量均大幅增加,其中,乙酸和乳酸均超过5 g/L,菌体代谢异常,正常生长受到严重影响[11],进而出现糖酸转化率降低、产品质量下降、提取难度加大等一系列问题。
图6 不同KH2PO4添加量对发酵副产物的影响Fig.6 Effects of different KH2PO4 additions on fermentation by-products
3 结论
在大肠杆菌的高密度发酵中,接种量和底物磷酸盐添加量是2个重要的限制性因素,二者直接影响最终发酵结果。本试验利用梯度试验先后对发酵接种量及底物KH2PO4添加量进行了优化,最终确定最佳接种量为20%(体积分数),底物KH2PO4添加量为10 g/L。试验结果表明,在优化后的条件下,底物磷酸盐能被菌体充分有效利用,发酵整体糖代谢水平提升,细胞生长和目的产物表达得到促进,最高菌体密度达到65.39 g/L,最终L-色氨酸产量为59.55 g/L,分别较优化前(10%(体积分数)接种量,6 g/L KH2PO4)的44.79 g/L(最高菌体密度)和45.30 g/L(最终L-色氨酸产量),增加了45.99%和31.17%,设备利用率大幅提高。同时,由于延滞期的缩短和生长期的提前优化后的发酵批次在24 h左右就达到了优化前40 h时的产酸水平(45.30 g/L),在原有产酸指标不变的情况下,压缩了发酵周期,降低了时间成本,极大提高了发酵效率。

