冬凌草甲素对甲状腺癌细胞放射敏感性的影响及机制
黄清波
(淄博市第一医院药学部,山东 淄博 255200)
甲状腺癌属于内分泌系统恶性肿瘤,其发生可能与电离辐射、雌激素、遗传、碘的不合理摄入等多种因素有关,总体发病率呈上升趋势〔1〕。1974~2013年,美国甲状腺癌发病率和死亡率平均每年分别增加3.6%和1.1%,根据人口统计等数据预测,到2030年甲状腺癌将成为美国第4大恶性肿瘤〔2,3〕。在甲状腺癌的治疗中,综合手术、放疗、化疗等多模式治疗提高了患者生存率,而放射敏感性的降低是限制放疗效果的主要因素〔4〕。冬凌草具有活血止痛、抗菌消炎、清热解毒等功效,可用于治疗癌症〔5〕。冬凌草甲素(Ori)是冬凌草抗肿瘤的主要活性成分,可从香茶菜、毛叶香茶菜等多种植物中提取,具有调节细胞周期,诱导细胞自噬、凋亡等功能〔6,7〕。研究表明〔8~10〕,Ori可有效抑制人结肠癌、胃癌等多种肿瘤细胞增殖并调节细胞耐药性,但其对癌细胞放射敏感性的研究较少。本文拟探讨Ori对BCPAP细胞放射敏感性的影响及作用机制。
1 材料与方法
1.1材料 胎牛血清(批号:SH41288)、RPMI1640培养液(批号:SH30807)购自美国Gibco-BRL公司;噻唑蓝(MTT,批号:M2129)、碘化丙啶(PI,批号:D4543)购自美国Sigma公司;Annexin V-异硫氰酸荧光素(FITC)凋亡检测试剂盒(批号:170207)购自美国Coulter公司;二喹啉甲酸(BCA)试剂盒(批号:PC0020)、吉姆萨染色液(批号:G1015)、二甲基亚砜(DMSO,批号:D8370)购自北京Solarbio公司;硝酸纤维素膜(批号:HATF00010)购自Millipore公司;caspase-3(批号:20220)、caspase-9活性检测试剂盒(批号:20009)购自美国R&D 公司;一抗购自美国Santa Cruz公司;辣根过氧化物酶(HRP)标记的二抗购自武汉博海生物公司;MCO-18AC型CO2培养箱购自日本SANYO公司;流式细胞仪购自美国BD公司;HBS-1096B型酶标仪购自南京德铁实验设备公司。
1.2细胞培养及照射 使用含10%胎牛血清的RPMI1640培养液于37℃、5% CO2饱和湿度的细胞培养箱培养Nthy-ori 3-1和BCPAP细胞。待细胞生长至对数期,胰酶消化收集,以5×103个/孔接种至96孔板,以Varian IX直线加速器6 MV X射线照射,剂量率3 Gy/min,源皮距100 cm。
1.3克隆形成实验检测细胞存活分数 取生长对数期的Nthy-ori 3-1和BCPAP细胞,消化离心收集,以适宜浓度接种于6孔板,分为Ori组和照射组。Ori组给予不同浓度(2.5、5.0、10.0、20.0、50.0 μmol/L)的Ori作用24 h,以等量DMSO处理为对照组;照射组细胞给予2.5、5.0、10.0 μmol/L Ori作用24 h后,以0、2、4、6、8 Gy X射线照射,继续培养14 d。磷酸盐缓冲液(PBS)洗涤后4 % 多聚甲醛固定,吉姆萨液染色30 min,洗去染液,晾干后进行克隆计数。每组3个复孔,实验重复5次,计算细胞存活分数。
1.4MTT法检测细胞活力 取Nthy-ori 3-1和BCPAP细胞以5×103个/孔接种于96孔板,以含终浓度2.5、5.0、10.0、20.0、50.0 μmol/L Ori的RPMI1640培养液常规培养24 h,DMSO组为对照;收集BCPAP细胞接种至96孔板,分为DMSO(对照)组、Ori 5 μmol/L组(5 μmol/L Ori干预)、IR组(4 Gy X射线照射)、Ori 5 μmol/L+IR组(5 μmol/L Ori干预联合4 Gy X射线照射)、Ori 5 μmol/L+IR+丙二醇甲醚酯酸酯(PMA)组〔5 μmol/L Ori和100 μmol/L PMA干预联合4 Gy X射线照射〕。以上各组细胞培养24 h,加入20 μl MTT(5 mg/ml),孵育4 h后吸除培养液,加入150 μl DMSO振荡反应10 min,酶标仪检测490 nm处吸光度(A)值,实验重复5次。
1.5流式细胞术检测细胞周期 收集DMSO组、Ori 5 μmol/L组、IR组、Ori 5 μmol/L+IR组细胞,消化离心,PBS重悬细胞。以75%预冷无水乙醇4℃固定过夜,离心去上清,加入5 μl PI,室温染色30 min,流式细胞仪检测各组细胞周期。
1.6细胞凋亡检测 收集DMSO组、Ori 5 μmol/L组、IR组、Ori 5 μmol/L+IR组细胞,PBS洗涤3次;按照Annexin V-FITC细胞凋亡检测试剂盒说明书分别加入195 μl Annexin V-FITC结合液和5 μl Annexin V-FITC轻轻混匀,10 μl PI室温避光孵育20 min,立即使用流式细胞仪检测细胞凋亡情况。
1.7Western印迹法检测P53、P21、细胞周期蛋白依赖性激酶(CDK)1、B淋巴细胞瘤(Bcl)2、Bcl-2相关X蛋白(Bax)、天冬氨酸蛋白水解酶(Caspase)-3、caspase-9、细胞外信号调节激酶(ERK)、磷酸化(p)-ERK蛋白表达 使用含蛋白酶抑制剂的RIPA裂解液于冰上裂解细胞,4℃,3 000 r/min离心20 min,取上清,BCA试剂盒测定蛋白样品浓度。取40 μg蛋白样品进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)后电转至硝酸纤维素膜上,含5%脱脂奶粉TBST液室温封闭1 h;分别加入相应的一抗(1∶1 000)4℃孵育过夜,洗膜后加入HRP标记的二抗(1∶5 000)室温孵育1 h,洗涤,使用电化学发光(ECL)试剂盒显示条带,以β-actin为内参,实验重复3次。
1.8统计学分析 采用SPSS22.0软件进行t检验、单因素方差分析。
2 结 果
2.1Ori抑制Nthy-ori 3-1和BCPAP细胞活力 克隆形成实验结果显示,Ori能降低Nthy-ori 3-1和BCPAP细胞存活分数,抑制细胞增殖,呈浓度依赖性,对比Nthy-ori 3-1细胞,Ori对BCPAP细胞活力的抑制作用更明显(P<0.05),见表1。MTT法检测不同浓度Ori干预后细胞活力,发现2.5、5.0、10.0、20.0、50.0 μmol/L Ori能明显抑制BCPAP细胞活力(P<0.05),见表2。10.0、20.0、50.0 μmol/L Ori处理36 h、48 h显著抑制Nthy-ori 3-1细胞活力(P<0.05),见表3。
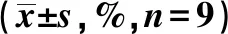
表1 不同浓度Ori抑制Nthy-ori 3-1组 和BCPAP组细胞存活率比较
与对照组比较:1)P<0.05;与Nthy-ori 3-1组比较:2)P<0.05

表2 不同浓度Ori对BCPAP细胞吸光度值的影响
与对照组比较:1)P<0.05;表3、7、8、11同
2.2Ori对BCPAP细胞的放射增敏作用 不同剂量X射线照射后对比对照组,Ori 2.5、5.0和10.0 μmol/L组BCPAP细胞存活分数明显减小(P<0.05);X射线照射剂量为2、4、6、8 Gy时,Ori 2.5、5.0和10.0 μmol/L组细胞存活分数较0 Gy显著减小(P<0.05),见表4。不同浓度Ori处理的Nthy-ori 3-1细胞存活分数各照射剂量无明显变化(P>0.05),见表5。Ori 5.0 μmol/L+IR组BCPAP细胞活力明显低于Ori 5.0 μmol/L组和IR组(P<0.05),而IR组细胞活力低于Ori 5.0 μmol/L组(P<0.05),表明5.0 μmol/L Ori对BCPAP细胞具有放射增敏作用,见表6。

表3 不同浓度Ori处理不同时间点对Nthy-ori -3-1细胞吸光度值的影响

表4 不同照射剂量对BCPAP细胞存活率比较
与对照组比较:1)P<0.05;与0 Gy比较:2)P<0.05

表5 不同照射剂量对Nthy-ori 3-1 细胞存活率影响

表6 处理不同时间点Ori抑制各组BCPAP细胞存活率比较
与Ori 5.0 μmol/L组比较:1)P<0.05;与IR组比较:2)P<0.05
2.3Ori联合X射线照射对BCPAP细胞周期的影响 与对照组相比,Ori 5.0 μmol/L组细胞周期无明显变化(P>0.05),IR组和Ori 5.0 μmol/L+IR组细胞S期、G0/G1期比例明显下降(P<0.05);Ori 5.0 μmol/L+IR组细胞S期、G0/G1期比例下降幅度最大,见表7。
2.4Ori对BCPAP细胞p53、p21、CDKI蛋白表达的影响 对比对照组,Ori 5.0 μmol/L组、IR组、Ori 5.0 μmol/L+IR组细胞p53、p21蛋白表达显著上调(P<0.05),CDK1蛋白表达显著下调(P<0.05),Ori 5.0 μmol/L+IR组细胞p53、p21、CDK1蛋白表达上调或下调幅度最大。见图1、表8。
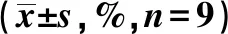
表7 Ori 联合 X 射线照射对 BCPAP 细胞周期值的影响

图1 各组细胞p53、p21、CDK1蛋白表达
2.5Ori增加辐射照射对BCPAP细胞凋亡的诱导作用 对比对照组,Ori 5.0 μmol/L组、IR组、Ori 5.0 μmol/L+IR组BCPAP细胞凋亡率明显增加(P<0.05),Ori 5.0 μmol/L+IR组细胞凋亡率显著高于IR组和Ori 5.0 μmol/L组(P<0.05),见图2、表9。进一步检测凋亡相关蛋白表达发现,与对照组相比,Ori 5.0 μmol/L组、IR组、Ori 5.0 μmol/L+IR组细胞Bcl-2蛋白表达显著下调(P<0.05),Bax、caspase-3、caspase-9蛋白表达显著上调(P<0.05);与IR组和Ori 5.0 μmol/L组比较,Ori 5.0 μmol/L+IR组Bcl-2、Bax、caspase-3、caspase-9蛋白表达改变最明显(P<0.05),见图3、表10。

表8 Ori 对BCPAP细胞p53、p21、CDKI蛋白表达的影响

图2 流式细胞仪检测各组细胞凋亡
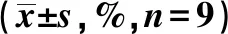
表9 不同照射时间点各组BCPAP细胞凋亡率比较
与对照组比较:1)P<0.05;与Ori 5.0 μmol/L、IR组比较:2)P<0.05;表10同
2.6Ori调控ERK-p53通路对BCPAP细胞的放射增敏作用 Ori 5.0 μmol/L+IR组BCPAP细胞活力较对照组明显下降(P<0.05),p-ERK蛋白表达显著下调(P<0.05);Ori 5.0 μmol/L+IR+PMA组细胞活力显著回升(P<0.05),p-ERK蛋白表达显著回升(P<0.05);各组细胞中ERK蛋白表达无明显变化(P>0.05),见图4、表11。

表10 各组BCPAP凋亡细胞蛋白表达比较

图4 各组细胞中ERK、p-ERK蛋白表达

表11 各组BCPAP细胞中ERK、P-ERK蛋白表达及细胞活力对比
3 讨 论
Ori是从植物中提取出的二萜类化合物,能够抑制细胞周期蛋白D1表达,阻滞细胞周期;通过调节细胞内磷酯酰肌醇3激酶(PI3K)/丝氨酸激酶(Akt)信号通路和ERK通路诱导细胞自噬、凋亡;从而对肿瘤发挥抑制作用〔6,11〕。其抗肿瘤活性引起癌症生物学家的广泛关注,Li等〔12〕研究发现,Ori能够调节自噬相关蛋白beclin-1、LC3-Ⅱ和凋亡相关蛋白Bax、Bcl-2表达,诱导人乳腺癌细胞凋亡。在非小细胞肺癌细胞中,Ori可抑制表皮生长因子受体(EGFR)/ERK/基质金属蛋白酶(MMP)-12和蛋白磷酸酶(PP)2A的癌性抑制因子(CIP2A)/PP2A/Akt信号通路,增强非小细胞肺癌细胞对吉非替尼的耐药性;并且对食管癌细胞具有明显的放射增敏作用〔13,14〕。在甲状腺癌的研究中,10 μmol/L Ori干预可促进BCPAP细胞中DNA修复酶(PARP)及p-ERK蛋白表达,抑制细胞增殖并诱导凋亡〔15〕。细胞周期调控与细胞凋亡是研究癌症发生发展机制的重要内容,其中,p53介导的细胞信号转导途径起重要作用。p53是一种人体肿瘤抑制基因,可与其下游细胞周期素依赖性激酶抑制因子p21共同组成细胞周期检查站,DNA损伤则细胞周期停滞〔16,17〕。CDK1是周期蛋白依赖性激酶家族的一员,p53激活p21基因转录后,p21与CDK1结合成复合物或干扰细胞周期蛋白依赖性激酶(CAK)磷酸化,抑制CDK1活性,抑制周期蛋白表达,使细胞停滞在G2期〔18,19〕。bcl-2基因家族与细胞凋亡的调节密切相关,其中Bcl-2和Bax分别在抑制凋亡和促进凋亡起关键作用,Bcl-2/Bax比值直接决定细胞是否发生凋亡〔20〕。
ERK激活后磷酸化成为p-ERK,可将细胞信号从表面受体传导至细胞核,参与细胞生长、分化、分裂等多种生物过程〔21〕。ERK存在于细胞质中,被激活后移位于细胞核,调节细胞代谢和功能,参与肿瘤的发生发展〔22〕。研究表明〔23,24〕,调节ERK可增强鼻咽癌、非小细胞肺癌细胞放射敏感性。
综上,Ori可通过阻滞BCPAP细胞周期,调节凋亡相关蛋白表达诱导细胞凋亡,调控ERK通路增强细胞放射敏感性。这一研究有助于进一步了解甲状腺癌发病机制,为甲状腺癌的临床治疗提供新靶点。

