内镜下减压融合经皮椎弓根钉内固定治疗退变性腰椎Ⅰ、Ⅱ度滑脱
王向前,李军,郭广铭,郭洋洋,宋中学,刁文博,刁文杰
(河南省周口协和骨科医院 骨科,河南 周口 466000)
腰椎滑脱病因复杂,Wiltse 和Rothman 把长期存在的节段间失稳导致的滑脱称之为退变性腰椎滑脱,最常发生于腰5 椎体,其次是腰4 椎体[1]。按Meyerding 分度法共分为4 度,后来国际上把完全滑脱定为Ⅴ度。随着我国医疗条件的改善,Ⅲ度以上的退变性滑脱已经明显减少,而Ⅰ、Ⅱ度退变性滑脱仍较为常见。对伴有进行性神经症状加重或腰部疼痛影响行走的患者,腰椎后路椎间融合(posterior lumbar interbody fusion,PLIF)椎弓根螺钉内固定仍然是最常用的手术方式[2]。然而随着脊柱开放手术内镜化为代表的微创理念的推广和手术工具的改进,Ⅰ、Ⅱ度腰椎滑脱内镜下减压、复位、椎间融合、椎弓根螺钉内固定已初步可行,该术式不剥离后侧肌肉,对软组织损伤小、出血少,目前国内外尚无对腰椎滑脱实行该手术方式的文献报道,本院率先实行该手术方式,就初期临床效果进行回顾性总结,现报道如下。
1 资料与方法
1.1 一般资料
回顾性分析 2018 年1 月至2018 年6 月本院收治的16 例腰椎Ⅰ度滑脱、7 例腰椎Ⅱ度滑脱患者的临床资料为微创组。通过严格检查和筛选,术前腰椎过伸过屈位X 线光片、腰椎CT、磁共振成像常规检查;在无手术禁忌和手术指征明确的情况下实行内镜下减压、复位、椎间融合、椎弓根螺钉内固定手术。另回顾性分析同期行PLIF 椎弓根螺钉内固定术治疗的18 例腰椎Ⅰ度滑脱、12 例腰椎Ⅱ度滑脱患者的临床资料为对照组,术前检查和手术指征同微创组。两组患者均为单节段并伴有不同程度的腰椎退变,所有手术均经患者及家属知情同意。术后对两组患者随访3~9 个月,平均随访4.8 个月和5.1 个月。对两组患者的手术时间,术中出血量,术前、术后1 个月、术后3个月视觉模拟评分 (Visual Analogue Scale,VAS)及 Oswestry 功能障碍指数(Oswestry disability index,ODI)进行统计分析。
1.2 手术方法
微创组:常规采用俯卧位、全身麻醉(全麻),透视定位了解椎体滑脱复位情况,经皮植入追弓根螺钉,内镜下进行常规减压,必要时行双侧减压,减压完成后内镜下处理椎间盘,追弓根螺钉单侧上棒,透视了解复位情况,确认复位满意后继续内镜直视下处理终板到可看到松质骨,融合器试模,植入自体骨和融合器,透视确认融合器位置及大小,查看融合器及神经,退出内镜,同侧追弓根上棒,缝合伤口术毕。对照组:常规全麻俯卧位,后正中切口暴露椎板和关节突关节,打入追弓根螺钉,去除椎板进行减压并处理椎间盘,复位椎体固定钉棒,植入融合器和自体骨,再次探查神经,冲洗留置负压引流,术毕。
1.3 统计学方法
采用SPSS 13.0 统计软件对数据进行处理。计量资料以均数±标准差()表示,行t检验;计数资料以构成比或率(%)表示,行χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较
两组患者一般资料比较差异无统计学意义(P>0.05),见表1。
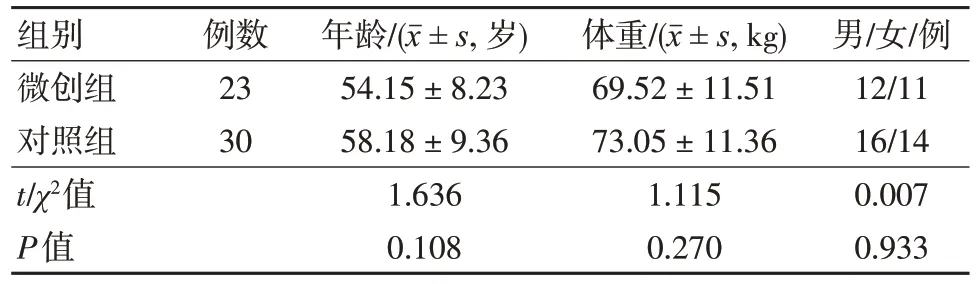
表1 两组患者一般资料比较
2.2 两组术前、术中、术后相关指标比较
微创组平均手术时间长于对照组,差异有统计学意义(P<0.05);微创组术中出血量少于对照组,差异有统计学意义(P<0.05);两组患者术后1 个月、术后3 个月的VAS 评分、ODI 与术前相比均有明显改善,差异有统计学意义(P<0.05);两组间术前、术后1 个月及术后3 个月VAS 评分、ODI 比较差异均无统计学意义 (P>0.05)。见表2。
表2 两组术前、术中、术后相关指标比较 ()
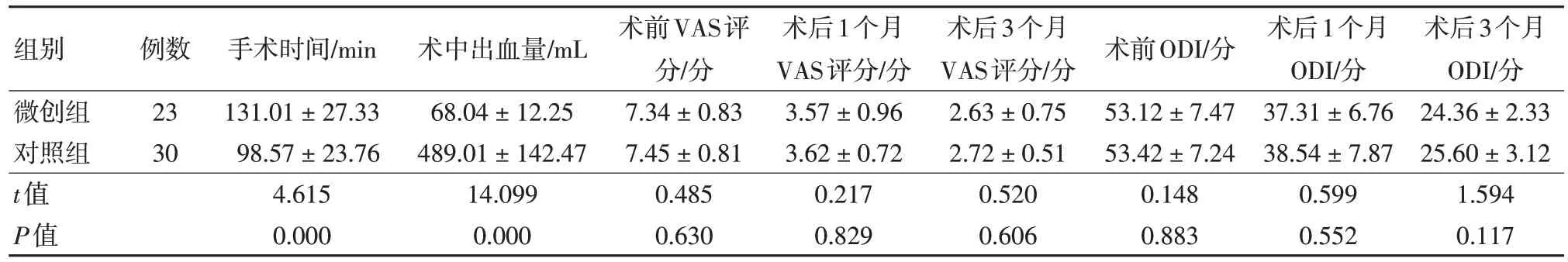
表2 两组术前、术中、术后相关指标比较 ()
组别微创组对照组t值P值例数23 30手术时间/min 131.01±27.33 98.57±23.76 4.615 0.000术中出血量/mL 68.04±12.25 489.01±142.47 14.099 0.000术前VAS评分/分7.34±0.83 7.45±0.81 0.485 0.630术后1个月VAS评分/分3.57±0.96 3.62±0.72 0.217 0.829术后3个月VAS评分/分2.63±0.75 2.72±0.51 0.520 0.606术前ODI/分53.12±7.47 53.42±7.24 0.148 0.883术后1个月ODI/分37.31±6.76 38.54±7.87 0.599 0.552术后3个月ODI/分24.36±2.33 25.60±3.12 1.594 0.117
3 讨论
腰椎滑脱病因复杂,根据病因学分为发育性和获得性两大类[3]。本文根据Wiltse 和Rothman分类法把腰椎滑脱分为5 个类型,其中Ⅲ型为退变性,是由于长期存在的节段间失稳所导致。伴有进展性神经障碍和步态异常的严重腰骶后凸为绝对适应证,相对适应证则包括轻微的非进展性神经障碍,神经根性和跛行症状,非手术治疗无效的机械性腰痛。治疗该病的目的主要有:①防止滑脱的进一步进展[4];②稳定病变节段;③矫正腰骶部后凸;④缓解腰腿疼痛;⑤逆转神经障碍[5]。
PLIF 椎弓根螺钉内固定是目前临床最常用的手术方式,该术式存在暴露清晰、减压充分、易于复位等优点,但PLIF 后侧肌肉剥离较多、出血量大、创伤较大,容易造成肌肉失神经支配、肌肉萎缩甚至是长期慢性腰痛。近年来以脊柱内镜为代表的微创技术得到迅猛发展,包括后路椎间盘镜技术和经皮椎间孔镜技术,两种术式在手术入路和手术适应证方面有所不同。经皮椎间孔镜技术以杨氏脊柱内镜技术(Yeung endoscopic spine system,YESS)和经椎间孔脊柱内镜技术(transforaminal endoscopic spine system,TESSYS) 应用最为广泛[6-7],但都需要在非可视下进行精准穿刺,存在穿刺技术要求高,盲视操作多,减压范围有限等缺点。开放手术思路下的脊柱内镜操作则有着对穿刺定位精准度要求低,操作范围广、减压充分,操作过程接近全程可视等优点[8-9]。对于习惯直视下完成开放手术的脊柱外科医生来说更容易接受和学习。目前非融合下的椎间盘突出症和椎管狭窄手术已经实现完全可视化操作;而镜下腰椎融合技术也仅剩下通道下铰刀处理椎间盘、融合器试模、融合器植入还不能完全可视。
本文中微创组患者椎体复位主要靠患者体位和追弓根螺钉的提拉,对于个别复位困难的患者可通过松解后使用铰刀插入椎间隙进行撬拨以达到复位目的[10-11]。微创组患者手术时间相对对照组较长,这与工具效率受限,手术程序繁琐及熟练程度不够等因素密切相关,椎间隙终板的处理尤其费时。在手术并发症方面,微创组1 例患者术后出现下肢麻木疼痛加重,术后6 周完全恢复,初步认为是由术中套筒压迫出口神经根所致;对照组1 例出现脑脊液漏,术后采用头高脚低位后伤口顺利闭合。而微创组因术后均未放置引流,所以未观察到硬膜破裂或脑脊液渗漏。
脊柱内镜下实现退变性腰椎Ⅰ、Ⅱ度滑脱的减压、固定与融合代表着脊柱内镜的较高水平和未来趋势。该微创手术与传统开放后路手术相比早期疗效显著,虽然手术时间较长,但出血少、创伤小,患者恢复快且更容易被患者所接受。另外本研究仍存在病例有限、缺乏多中心性等不足,且由于随访时间较短,缺乏融合情况的相关评估,有必要进一步研究。

