急性白血病患者合并血流感染的临床特点分析*
谭家乐,杨华强,李红,覃骏,郑雪娜
(1.锦州医科大学湖北医药学院 研究生培养基地,湖北 十堰 442000;2.湖北医药学院附属人民医院 血液科,湖北 十堰 442000)
急性白血病(acute leukemia,AL)是血液系统常见的恶性肿瘤,由于疾病本身的特点及化学治疗后严重和持续粒细胞缺乏、免疫抑制剂和糖皮质激素的使用、中心静脉置管和皮肤及黏膜屏障的破坏等使AL 患者容易合并血流感染(blood stream infection,BSI)[1]。研究表明不同时段、不同地区和不同医院BSI 病原体分布差异较大,其耐药性也在不断变化[2]。在获得可靠的血培养结果之前,绝大多数初始治疗仍是经验性抗感染治疗,这为如何合理使用抗生素有效降低AL 患者合并BSI 的死亡率提出了挑战。因此,关注本地区BSI的临床特点、病原学分布和耐药情况,以便及时干预和控制BSI 具有重要意义,本研究对110 例AL 合并BSI 患者的临床资料进行回顾性分析,现报道如下。
1 资料与方法
1.1 研究对象
选择 2016 年 1 月 1 日至 2018 年 12 月 30 日在湖北医药学院附属人民医院血液科住院并合并BSI 的110 例AL 患者为研究对象,其中男65 例,女45 例,男女比例1.44∶1,中位年龄42(14~70)岁。AL 患者的诊断和治疗参照成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017年版)、中国急性早幼粒细胞白血病诊疗指南(2018 年版)和中国成人急性淋巴细胞白血病诊断与治疗指南(2016 年版)。110 例AL 患者中急性非淋巴细胞白血病(acute non-lymphocytic leukemia,ANLL) 55 例,急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL) 50 例,急性混合细胞白血病(hybrid acute leukemia,HAL)5 例。110 例AL 患者中25 例为原发病未缓解(non-remission,NR),75 例为完全缓解(complete remission,CR)。BSI 诊断标准参照国家卫计委2001 年颁布的《医院感染诊断标准》[3]。本研究经湖北医药学院附属人民医院伦理委员会批准,所有患者均知情同意。
1.2 培养标本的收集
AL 患者住院期间出现发热(T>38.5°C)的患者,采用双侧外周静脉抽取血培养,同时测定其对抗菌药物的敏感性。如果患者有中心静脉置管,则同时从中心静脉导管抽取血液标本行血液培养。如果患者有多个感染部位,则从所有感染部位提取分泌物样本并进行培养。患者体温恢复正常后1 周再次进行血液培养以明确病原菌是否完全清除。在感染期间常规检测血常规和C-反应蛋白(C-reactive protein,CRP)来评估病情。
1.3 细菌鉴定方法和药敏试验
采用传统鉴定方法,包括菌落形态、生化反应,以及法国生物-梅里埃公司生产的API(Analytic Products INC,API)手工鉴定系统进行细菌鉴定。临床分离菌采用纸片扩散法或自动化仪器法按统一方案进行抗菌药物敏感性试验,参照常见细菌药物敏感性试验报告规范中国专家共识[4]和临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI) 药敏试验执行标准2017 版[5]判断结果。药敏纸片(英国Oxoid公司)药敏质控菌株为:金黄色葡萄球菌ATCC 25923、大肠埃希菌ATCC 25922、铜绿假单胞菌ATCC 27853、粪肠球菌ATCC 29212,由卫生部临检中心提供。
1.4 统计学方法
应用SPSS 19.0 软件进行统计分析,对符合正态分布的计量资料以均数±标准差()表示,组内比较采用配对t检验,否则使用Wilcoxon 秩和检验,双侧P<0.05 为差异有统计学意义。
2 结果
2.1 AL患者合并BSI的一般临床特点
110 例AL 患者合并血流感染均有发热,其中15 例患者持续发热,发热时间 5~23 d,平均(8.6±4.6)d。30 例血流感染合并有其他部位感染,其中肺部感染11 例、胃肠道感染5 例、肛周感染5 例,口腔感染4 例,皮肤软组织感染3 例,泌尿系统感染2 例。110 例AL 患者中原发病NR 25 例,与CR 患者相比发热持续时间差异有统计学 意 义 [ (9.7±7.8) d vs.(5.2±3.7) d,P=0.015]。110 例AL 患者中,90 例出现粒细胞缺乏症[中性粒细胞绝对值(absolute neutrophil count,ANC)<0.5×109/L],其中18 例出现严重粒细胞缺乏症(ANC<0.1×109/L)。粒细胞缺乏患者发热时间 7~23 d,平均(13.5±10.2)d。20 例患者没有粒细胞缺乏症,其发热时间平均(6.1±5.0)d,两者相比发热持续时间差异有统计学意义[(13.5±10.2)d vs.(6.1±5.0)d,P=0.001]。粒细胞缺乏持续时间≥7 d,发热持续时间8~22 d,平均(6.7±4.9)d,中性粒细胞减少持续时间<7 d,发热时间5~11 d,平均(4.9±2.8)d,两组相比差异有统计学意义[(6.7±4.9)d vs.(4.9±2.8)d,P=0.030]。所有患者CRP 水平均升高,CRP 水平最高为56~186 mg/L,中位数为97 mg/L。
2.2 病原菌检出情况
110 例AL 患者共送检标本390 份,共培养到阳性菌株119 株,阳性率为30.5%。分离病原菌以革兰氏阴性杆菌为主,阳性率61.3%,主要细菌为大肠埃希氏菌、铜绿假单胞菌和肺炎克雷伯菌;革兰氏阳性球菌占30.3%,主要为金黄色葡萄球菌、凝固酶阴性葡萄球菌和表皮葡萄球菌;真菌占8.4%,主要为白色念珠菌,见表1。
2.3 病原菌药敏和耐药性分析
对革兰阴性杆菌较敏感的药物有亚胺培南、美罗培南、头孢吡肟、头孢哌酮舒巴坦、哌拉西林他唑巴坦、头孢他啶、阿米卡星、庆大霉素、左氧氟沙星、环丙沙星、氨曲南,耐药率分别为4.1%(3/73)、5.5%(4/73)、9.6%(7/73)、11.0%(8/73)、12.3% (9/73)、17.8% (13/73)、17.8%(13/73)、24.7%(18/73)、27.4%(20/73)、31.5%(23/73)、31.5%(23/73),其他抗菌药物如头孢噻肟、头孢曲松、复方新诺明、阿莫西林克拉维酸钾耐药率均≥50.0%。对革兰阳性球菌敏感的药物有万古霉素、利奈唑胺,其他依次为头孢噻肟、头孢曲松、头孢呋辛、氨苄西林-舒巴坦、左氧氟沙星、阿莫西林克拉维酸钾、环丙沙星,耐药率分别为0%、0%、22.2%、25.0%、27.8%、27.8%、30.6%、33.3%、36.1%,氨苄西林、复方新诺明耐药率均≥50.0%,见表2。本组医院感染病例分离出多重耐药 (multidrug resistant,MDR) 菌 33 株,分别来自于31 例患者,MDR 的医院感染发生率为27.7%(33/119)。耐药菌株主要为产超广谱β-内酰胺酶 (extended-spectrum beta-lactamases,ESBL)的革兰氏阴性杆菌23 株,其中ESBL 阳性的大肠埃希菌共16 株,占比48.5%(16/33)、ESBL 阳性的铜绿假单胞菌4 株、ESBL 阳性的肺炎克雷伯菌3 株;耐甲氧西林的凝固酶阴性的葡萄球菌(methicillin resistant staphulococcus coagulase negative,MRSCN) 4 株,耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,MRSA)6 株,未发现耐碳青霉烯类的肠杆菌和耐万古霉素的肠球菌。从分离菌株情况看,ESBL 阳性的大肠埃希氏菌在培养出的耐药菌株中占比最高,其次是MRSA。
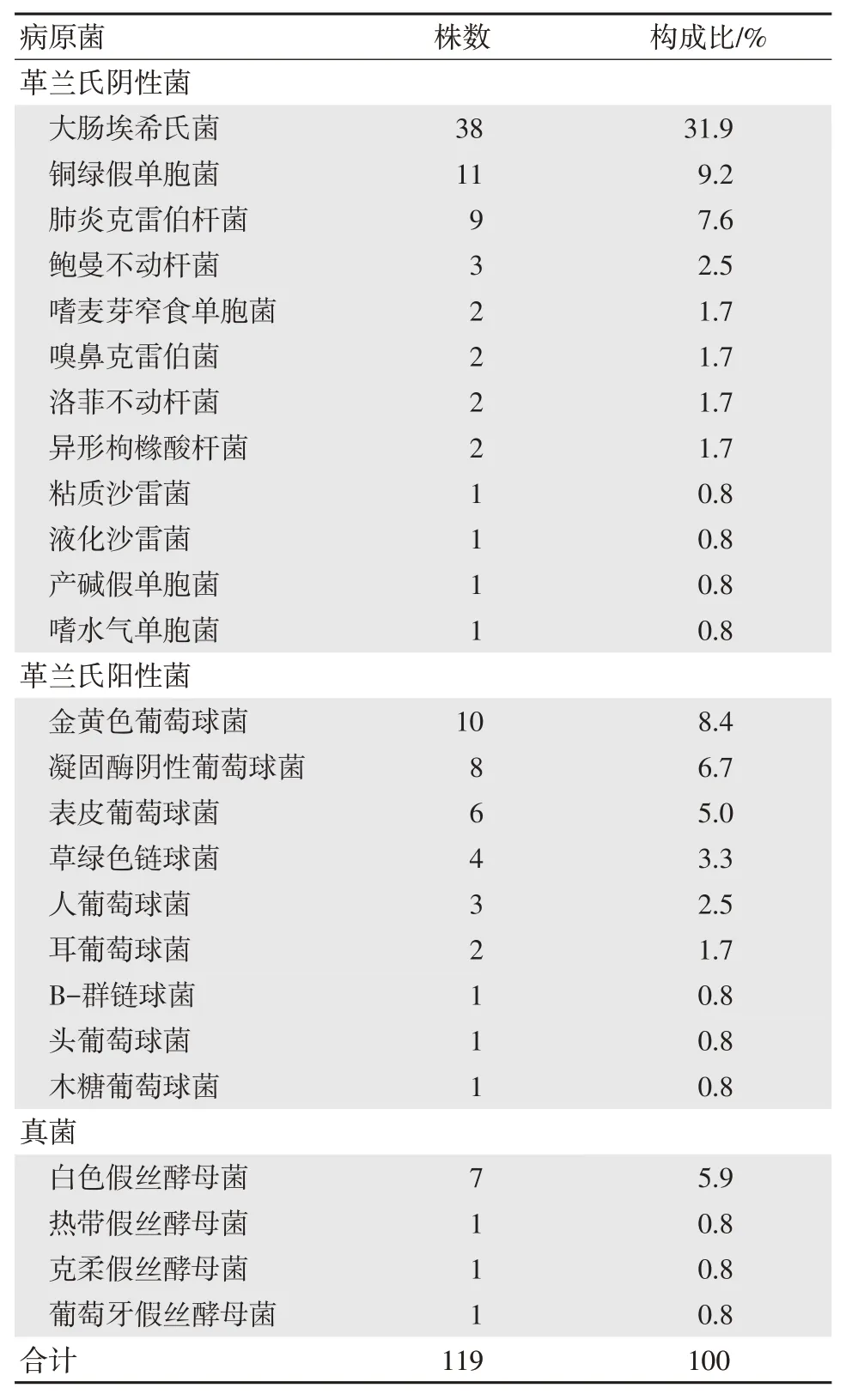
表1 110 例AL 患者病原菌构成
2.4 治疗与转归情况
110 例AL 合并BSI 患者治愈101 例,有效率91.8%。4 例死亡,5 例感染控制无效,这9 例患者中有7 例病原菌培养为ESBL 阳性的大肠埃希氏菌,存在多药耐药,抗感染治疗无效,另2 例病原菌为MRSA,其中1 例为MRSA 同时合并真菌感染,经抗感染治疗后患者出现感染性休克、颅内出血而死亡。
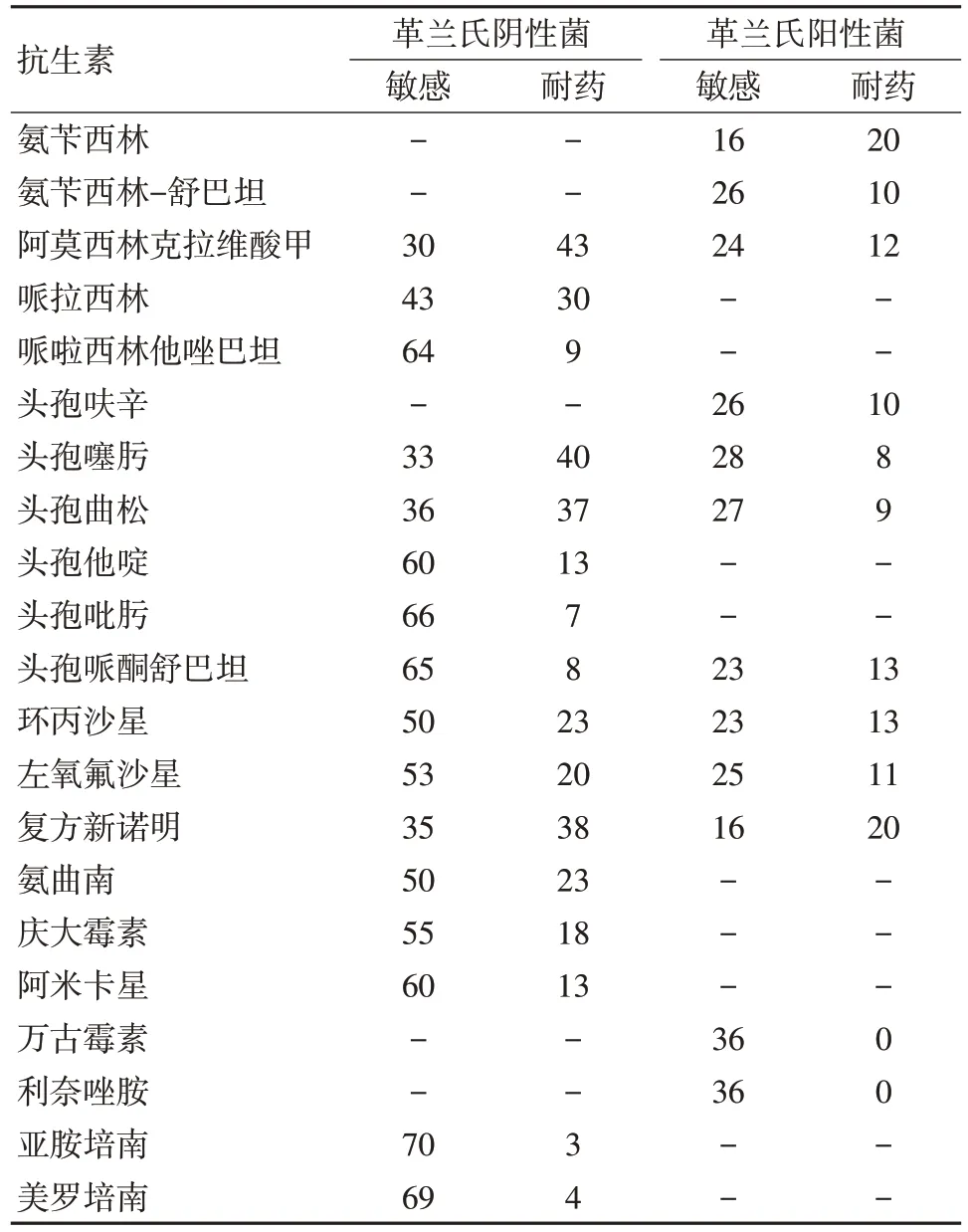
表2 AL 患者合并BSI 病原菌耐药性分析 例
3 讨论
AL 患者由于疾病本身的免疫缺陷和化疗等因素的影响易合并BSI,如处理不及时致死率高。同时化疗后中性粒细胞长期缺乏、黏膜屏障损害、免疫抑制剂、糖皮质激素和广谱抗菌药物的长期使用等危险因素增加了BSI 的发生率。笔者总结了110 例AL 合并BSI 患者的临床特点,结果发现本研究病原菌培养阳性率为30.5%,从病原菌的总体检出率和构成比来看仍以革兰氏阴性杆菌为主,阳性率61.3%,主要为大肠埃希氏菌、铜绿假单胞菌和肺炎克雷伯菌;革兰氏阳性球菌占30.3%,主要为金黄色葡萄球菌、凝固酶阴性葡萄球菌和表皮葡萄球菌;真菌占8.4%,主要为白色念珠菌,其结果与 YAO 等[6]和 ZHENG 等[7]的结果基本一致,但阴性菌低于2017 年中国CHINET 耐药细菌监测的同期结果(70.8%)[8]。从本研究看革兰氏阴性杆菌对头孢噻肟、头孢曲松、复方新诺明、阿莫西林克拉维酸钾均有不同程度的耐药,对亚胺培南、美罗培南、头孢吡肟、头孢哌酮舒巴坦、哌拉西林他唑巴坦、头孢他啶等药物的敏感率较高,革兰阳性球菌对万古霉素、利奈唑胺敏感率较高。本研究多重耐药菌的发生率为27.7%,其结果低于2017 年中国CHINET 耐药细菌监测的数据,这可能与近几年本科医务人员在加强医院感染防控措施和抗菌药物临床应用管理方面的意识加强,从而防止了多药耐药菌株交叉感染及克隆流行,进一步预防和降低了多重耐药菌的用药选择性压力有关。从分离菌株情况看,ESBL 阳性的大肠埃希氏菌占比最高,占48.5%,其次是MRSA,提示笔者在做好细菌耐药监测工作的同时应加强实验室与临床的沟通,从而发挥耐药监测工作的最大价值。
由于白血病患者白细胞异常,其中性粒细胞趋化性和吞噬杀伤功能下降,同时严重中性粒细胞减少是急性白血病化疗后发生感染的危险因素,也是影响感染预后的重要因素[9]。在本研究中,110 例AL 患者合并有BSI,其中90 例有中性粒细胞缺乏症,统计分析表明,粒细胞缺乏组与非粒细胞缺乏组和粒细胞缺乏持续时间≥7 d 组和<7 d组发热持续时间差异有统计学意义[(13.5±10.2) d vs.(6.1±5.0) d,P=0.001;(6.7±4.9) d vs.(4.9±2.8)d,P=0.030],因此粒细胞缺乏的程度越重,持续时间越长,发热持续时间越长,这与闫晨华等[10]和 ZHAI 等[11]的研究一致。因此缩短化疗后骨髓抑制的时间、促进白细胞的恢复、加强中性粒细胞的免疫保护是重要的治疗措施。然而,也有研究表明,粒细胞集落刺激因子(G-CSF)可以加重感染所分泌的细胞因子风暴[12-13]。此外,本研究也显示了原发病的缓解状态和感染严重程度之间的相关性,在110 例患者中,25 例NR 患者感染期间发热持续天数多于CR 患者,两组比较差异有统计学意义[(9.7±7.8)d vs.(5.2±3.7)d,P=0.015]。粒细胞缺乏和AL 患者病情未缓解极易合并感染,因此有效控制感染直接关系到白血病患者的生存。在本研究中,所有感染患者均根据流行病学调查结果和感染情况,采用降阶梯的方法进行不同程度的经验性抗感染治疗,110 例患者抗感染治疗有效率为91.8%。
总之,AL 患者原发病未缓解或化疗后出现骨髓抑制期,如出现发热、寒战及其他感染症状,则BSI 发生的可能性很大,应及时收集血液、分泌物培养和药敏试验,以便及时诊断,并在不同的部位和不同的时间,以及重复检查以提高诊断准确性。此外,在病原学的培养结果出来之前,根据医院流行病学数据和耐药情况,及时给予经验性抗生素治疗,以避免严重并发症的发生[14-15]。本研究由于是回顾性研究,临床表现、体格检查和实验室数据都是从病历中获得,因此一些临床数据资料可能会不完整。其次,病例数较少,应进一步扩大样本量进行随机对照研究。

