微囊藻毒素-LR对鸡肝脏的氧化损伤影响
张大文,袁丽娟,张莉,向建军,廖且根,罗林广,邱素艳
江西省农业科学院农产品质量安全与标准研究所,南昌 330200
蓝藻是地球上最早出现的光合自养原核生物,是所有藻类中最原始、最简单的一类。由水体富营养化引起的蓝藻“水华”对环境和人类健康的危害已成为全球关注的重大环境问题,是一种全球性的生态灾害[1-2]。但是,蓝藻中富含蛋白质,是巨大的蛋白质资源库,是优质的饲料蛋白源和饲料添加剂。天然蓝藻中有机质达65%以上,藻泥的蛋白质含量达40%,与大豆的蛋白质含量相当,同时具有丰富的氨基酸和维生素,营养价值极高[3-5]。但是,蓝藻中的部分种类(主要的水华蓝藻)能产生一系列毒性很强的天然毒素(称为蓝藻毒素)危及人类的健康[6]。自然环境中最常见、关注度最高的蓝藻毒素是微囊藻毒素,迄今为止已发现了100多种同分异构体[7],其中,毒性较大、研究较为深入的是微囊藻毒素-LR(MC-LR)[1]。MC-LR腹腔注射小白鼠的LD50值一般在50~60 μg·kg-1(体重),其毒性与化学类有机磷神经毒剂相当[8]。
目前,国内外对蓝藻饲料化利用进行了初步探讨[9],但是未考虑其中的蓝藻毒素对动物的毒性效应。关于蓝藻毒素(微囊藻毒素)对动物毒性的研究主要集中在水产品和哺乳动物[6,10-11],而对家禽毒性效应的研究鲜有报道。王春雨[12]在其硕士论文中初步开展了微囊藻毒素对鸭的急性和亚慢性毒性研究,张晓波等[13]研究了微囊藻毒素对鸭胚的毒性和半致死剂量,探讨了微囊藻毒素对鸭各组织和胚胎的损伤。
本文采用腹腔注射的方式研究了MC-LR对崇仁麻鸡肝脏氧化损伤的影响,为蓝藻饲料化利用提供理论依据。
1 材料与方法(Materials and methods)
1.1 试剂与仪器
试剂:MC-LR(纯度≥95%,HPLC)购自ZEN-U Biotechnology公司(台湾),超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPX)、谷胱甘肽S-转移酶(GST)、谷胱甘肽(GSH)、考马斯亮兰总蛋白和标准蛋白试剂盒均由南京建成生物工程研究所提供。
仪器:U-3900紫外-可见分光光度计(HITACHI公司,日本);SH-1000酶标仪(CORONA公司,日本),F6/10组织匀浆机(上海净信实业发展有限公司,中国);HH-4恒温水浴锅(江苏省金坛市宏华仪器厂,中国);CR22N低温冷冻高速离心机(HITACHI公司,日本);-86 ℃ DW-HL218超低温冰箱(中科美菱,中国)。
1.2 实验动物
健康成年崇仁麻鸡,由江西省农业科学院畜牧兽医研究所提供,平均体重1.16 kg。
1.3 半致死剂量实验
选取118日龄的健康崇仁麻鸡(母鸡),随机分成5组,每组6只。实验前1天鸡禁水禁食,实验鸡经腹腔注射给予MC-LR,注射剂量最高为LD100,最低剂量为LD0,中间从高到低设计3个剂量,使这5组相邻2组剂量成等比。注射后观察24 h内的死亡情况,并做实验记录。采用孙瑞元改进的蔻式法[14]计算微囊藻毒素对崇仁麻鸡的LD50值。该方法要使每个剂量组的组间距成等比或剂量对数等差,每个剂量组动物数相等,中间剂量接近LD50剂量。计算公式如下:
LgLD50=Xm-i(∑p-0.5)
(1)
(2)
式中:Xm为最大剂量的对数值;i为相邻两剂量对数剂量之差;p为各剂量组死亡率;q为各剂量存活率,q=1-p;∑p为各剂量组死亡率之和;n为各组动物数;Sx50为lgLD50的标准误。
1.4 腹腔注射毒性实验
将124日龄的健康崇仁麻鸡60只,平均体重为1.15 kg,平均分为4组,每组15只鸡。实验设置3个MC-LR染毒剂量组以及1个对照组,染毒剂量组分别为高剂量组、中计量组和低剂量组,每组一次性注射不同计量的MC-LR,注射剂量分别为5、10和20 μg·kg-1bw,注射体积为1 mL左右,对照组每只鸡注射1 mL生理盐水。注射剂量的选择根据本实验获得的LD50值进行设定。实验期间未发现鸡的死亡。
1.5 鸡组织取样
鸡经腹腔注射后,分别于1、3、12、24和48 h进行取样。每个时间点从对照组和3个染毒组各取出3只鸡,处死解剖取出肝脏,生理盐水漂洗,除去血液,用滤纸擦干后,用锡箔纸包裹,再用纱布包裹后现场放入液氮中保存,24 h后放入-80 ℃的超低温冰箱中冷冻保存。
1.6 肝脏系数的测定
鸡处死之后,将肝脏完整取出,生理盐水漂洗,除去血液,用滤纸擦干后,立即于分析天平上称量质量,计算脏器系数。

1.7 分析方法
按照不同酶试剂盒上的方法对肝脏组织进行匀浆以及处理,CAT、GST和GPX采用紫外-可见分光光度计进行测定,SOD和GSH采用酶标仪进行测定,并用考马斯亮兰总蛋白试剂盒和标准蛋白测定组织的蛋白质含量,测试方法为比色法。CAT、SOD、GPX和GST酶活性单位为U·mg-1prot,GSH的酶活性单位为μmol·g-1prot。
1.8 数据处理
使用SPSS13.0软件对数据进行统计处理,采用LSD法对数据进行多重比较,并用字母标记法对各实验组之间的显著差异性进行标记。标记原则为:将要标记的全部数值按从大到小顺序排列,然后在最大的数值上标上字母a,将该数值依次和其以下各数值相比,凡差异不显著的都标字母a,直至某一个与之相差显著的数值则标以字母b;再以该标有b的数值为标准,与上方各个比它大的数值相比,凡不显著的也一律标以字母b;再以标有b的最大值为标准,与以下各未标记的数值相比,凡不显著的继续标以字母b,直至某一个与之相差显著的数值则标以字母c;如此重复下去,直至最小的一个数值都标记字母为止。
2 结果(Results)
2.1 MC-LR对崇仁麻鸡的半致死剂量(LD50)
对崇仁麻鸡腹腔注射MC-LR 24 h内的观察结果如表1所示。在腹腔注射剂量分别为13.33、20、30、45和67.5 μg·kg-1bw时,分别有0、1、2、4和6只鸡死亡,死亡率分别为0.00%、0.17%、0.33%、0.67%和1.00%,按照式(1)和(2)计算得出MC-LR对崇仁麻鸡的LD50及其95%置信限为34.67(33.51~35.83) μg·kg-1bw。
2.2 MC-LR对肝脏系数的影响
鸡腹腔注射MC-LR之后,鸡肝脏系数从12 h开始呈现一定程度的上升趋势,但无统计学差异(P>0.05)(图1)。

图1 MC-LR对鸡肝脏系数的影响注:低、中和高剂量组中MC-LR剂量分别为5、10和20 μg·kg-1。下同。Fig. 1 Effect of MC-LR on liver weight index in chickenNote: The low, medium and high doses are 5, 10, and 20 μg·kg-1, respectively. The same below.
2.3 MC-LR对GSH含量的影响
不同注射剂量下鸡肝中GSH的含量随时间变化如图2所示。3个染毒组鸡肝中GSH含量呈现出先下降又恢复为正常值的趋势。MC-LR注射后的前24 h内,3个染毒组鸡肝中GSH含量显著低于对照组(P<0.05),在48 h时恢复到对照组水平(P>0.05)。3个染毒组鸡肝中GSH含量呈现注射剂量越高,其含量越低的趋势,但差异未达到统计学显著水平(P>0.05)。

表1 对崇仁麻鸡腹腔注射微囊藻毒素-LR(MC-LR)24 h内的观察结果Table 1 Acute toxicity results of microcystin-LR (MC-LR) to Chongren Chicken (intraperitoneal 24 h)
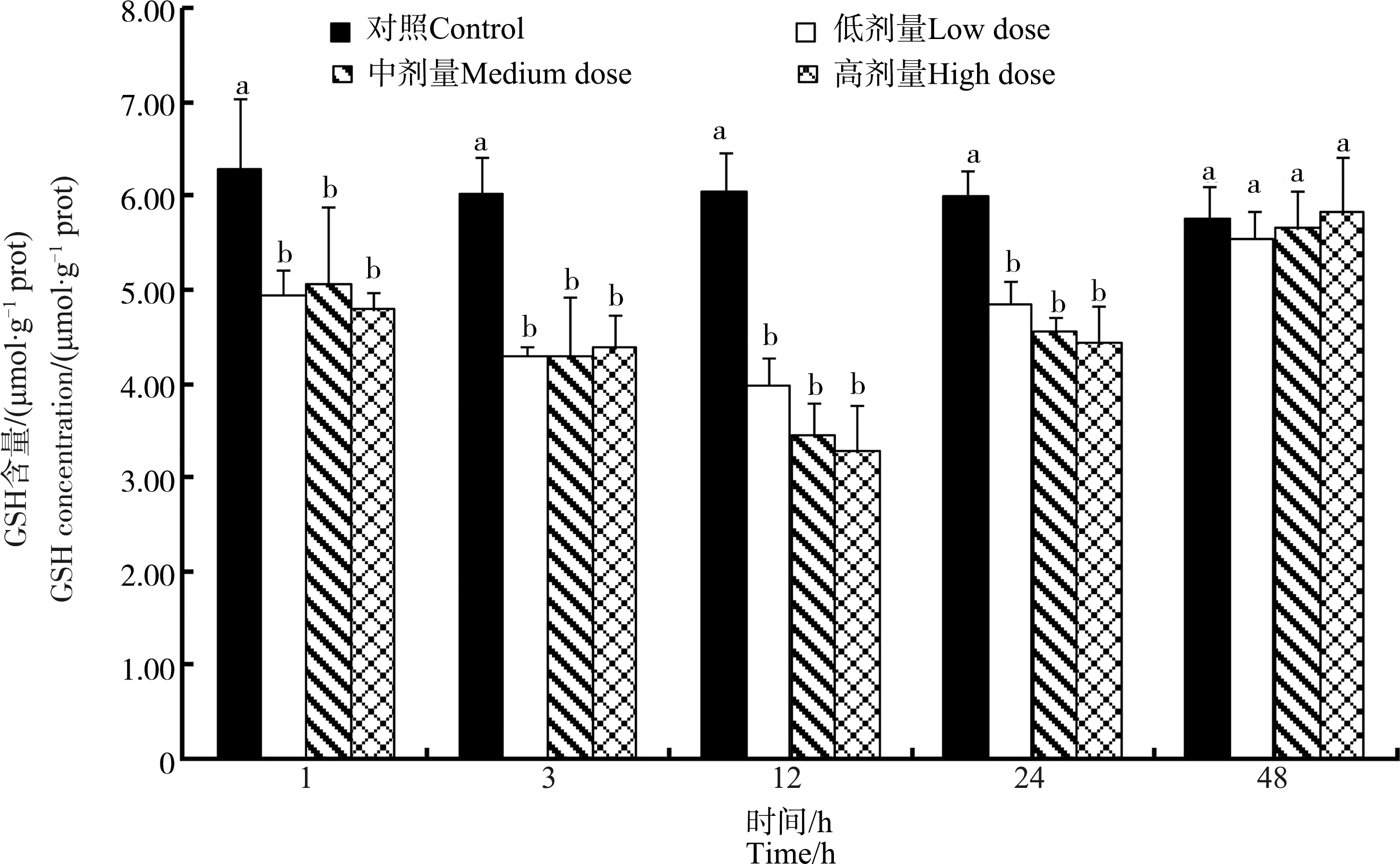
图2 不同MC-LR注射剂量下鸡肝脏中谷胱甘肽(GSH)含量随时间的变化Fig. 2 Dose- and time-dependent variation of glutathione (GSH) contents in liver of chicken after exposure to different doses of MC-LR
2.4 MC-LR对GST活性的影响
鸡注射MC-LR后,鸡肝中GST酶活性呈现先上升后又恢复至正常值的趋势(图3)。鸡注射MC-LR后1 h时,与对照组相比,3个染毒组GST酶活性没有显著变化(P>0.05);染毒后3~12 h,鸡肝中GST酶活性逐步升高,3个剂量组GST酶活性显著高于对照组,并呈现一定的剂量效应,即染毒剂量越高,GST酶活性越高的趋势,但是仅12 h时,高剂量组的GST酶活性显著高于其他染毒剂量组,至48 h时,3个染毒组的GST酶活性恢复至正常水平(图3)。
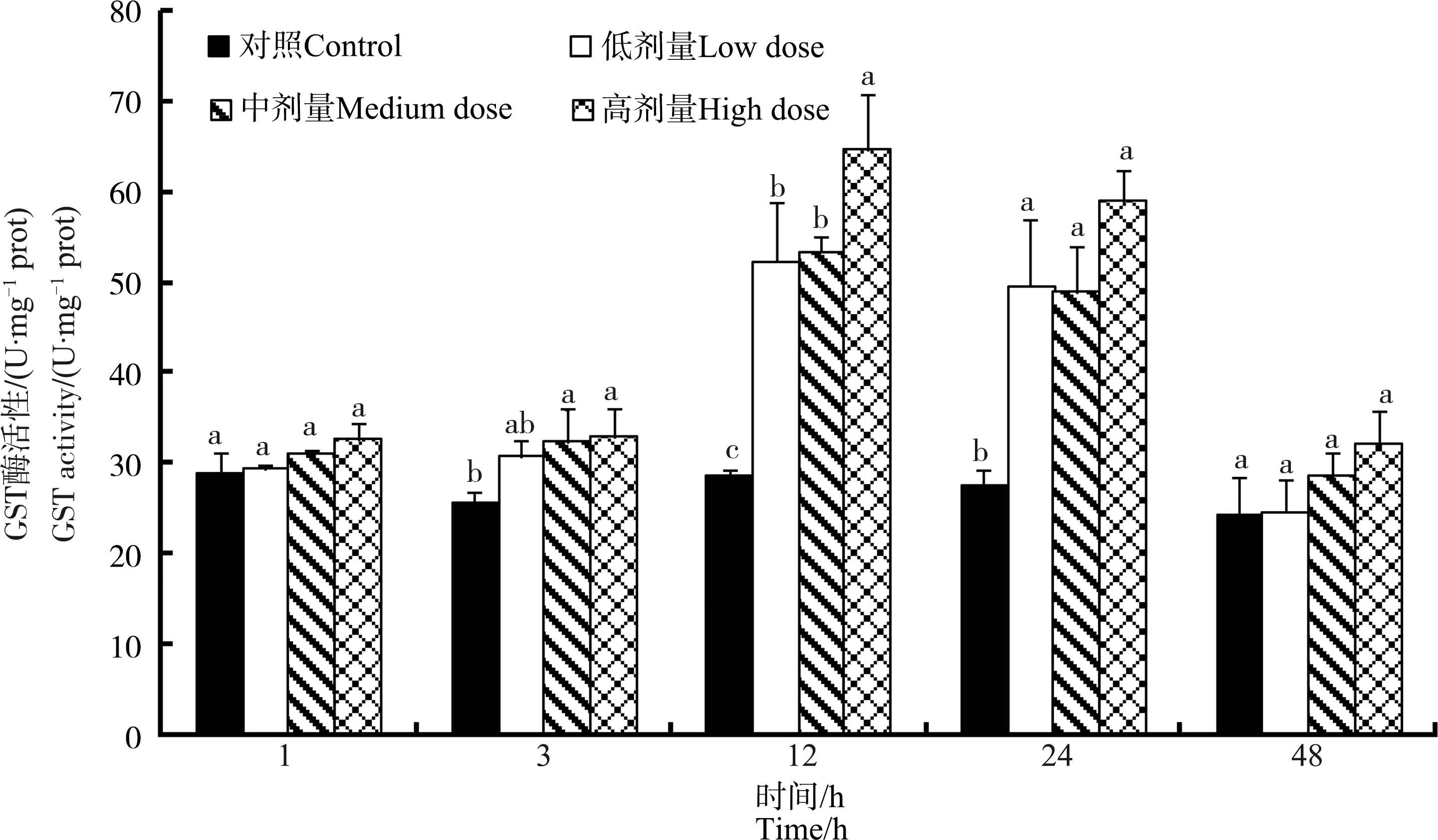
图3 不同MC-LR注射剂量下鸡肝脏中谷胱甘肽S-转移酶(GST)酶活性随时间的变化Fig. 3 Dose- and time-dependent variation of glutathione S-transferase (GST) activities in liver of chicken after exposure to different doses of MC-LR
2.5 MC-LR对GPX活性的影响
不同注射剂量下鸡肝中GPX酶的活性随时间变化如图4所示。鸡肝中GPX酶活性整体呈现先保持不变、后显著上升的趋势。MC-LR注射后1 h时,高剂量组鸡肝中GPX酶活性显著高于对照组(P<0.05),其他2个剂量组GPX酶活性与对照组之间没有显著差异(P>0.05),3 h时3个染毒组与对照组之间没有显著性差异(P>0.05);12~48 h时,3个染毒剂量组(除12 h低剂量组和24 h的高剂量组外)GPX酶活性均显著高于对照组(P<0.05);在12 h和48 h时,呈现低剂量组GPX酶活性显著低于中剂量和高剂量的趋势(P<0.05)。

图4 不同MC-LR注射剂量下鸡肝脏中谷胱甘肽过氧化物酶(GPX)酶活性随时间的变化Fig. 4 Dose- and time-dependent variation of glutathione peroxide (GPX) activities in liver of chicken after exposure to different doses of MC-LR
2.6 MC-LR对SOD活性的影响
鸡注射MC-LR后,SOD酶在整个实验期间几乎保持稳定,各染毒组与对照组之间没有明显差异(P>0.05)(图5)。
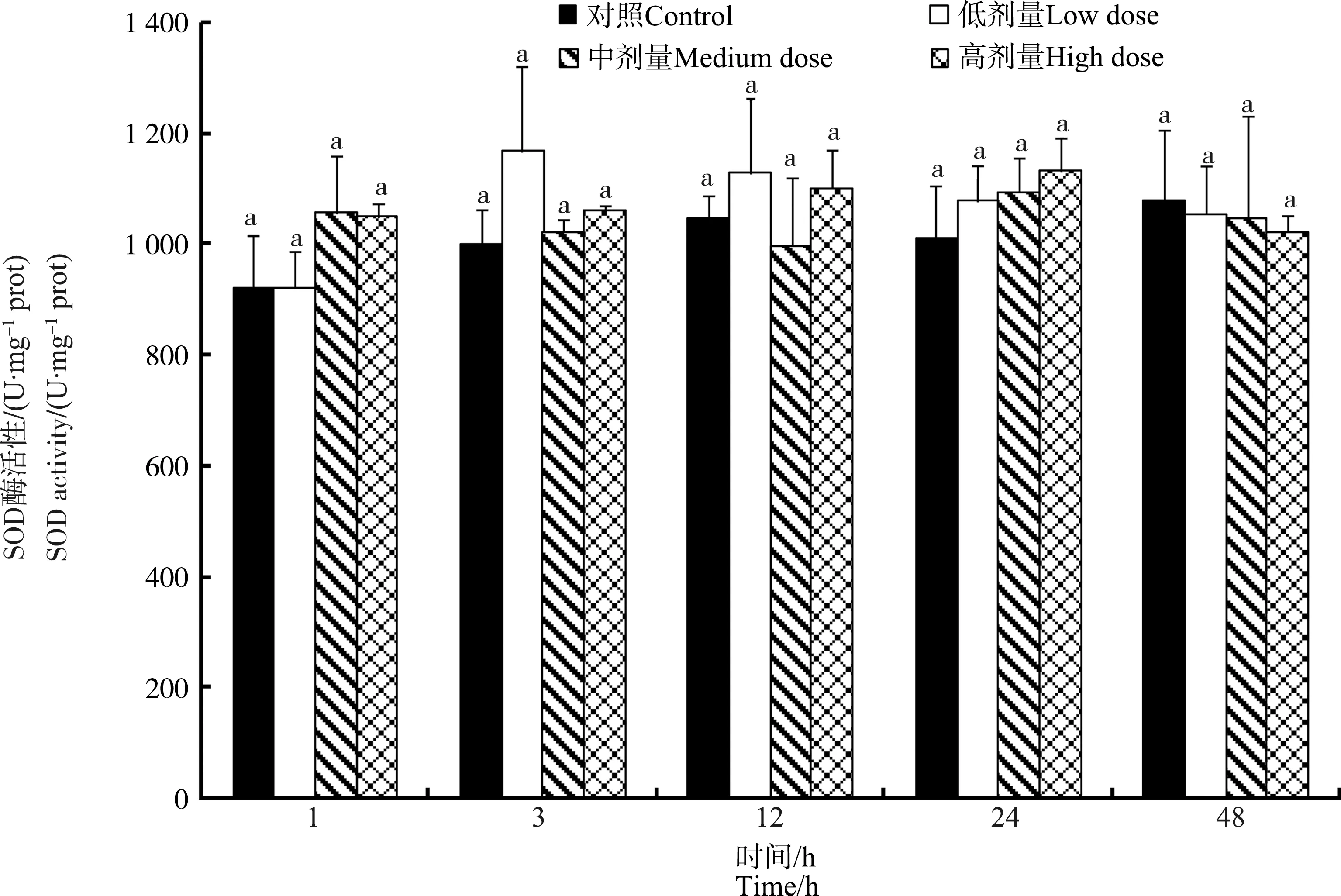
图5 不同MC-LR注射剂量下鸡肝脏中超氧化物歧化酶(SOD)酶活性随时间的变化Fig. 5 Dose- and time-dependent variation of superoxide dismutase (SOD) activities in liver of chicken after exposure to different doses of MC-LR
2.7 MC-LR对CAT活性的影响
不同注射剂量下鸡肝中CAT酶活性随时间变化如图6所示。鸡注射MC-LR 1 h时,与对照组相比,3个染毒组鸡肝中CAT酶活性呈现显著下降趋势(P<0.05),且酶的活性降低具有剂量效应,高剂量组显著高于中剂量组和低剂量组(P<0.05);在3~24 h时,3个染毒组鸡肝中CAT酶活性有较小的上升趋势,但是与对照组之间无显著性差异,48 h时基本上恢复至正常值水平。
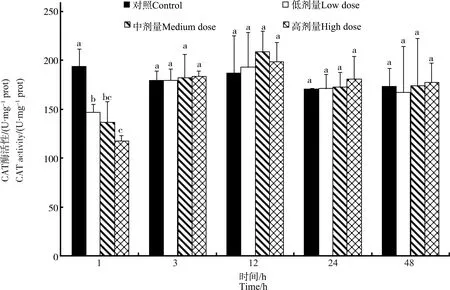
图6 不同MC-LR注射剂量下鸡肝脏中过氧化氢酶(CAT)酶活性随时间的变化Fig. 6 Dose- and time-dependent variation of catalase (CAT) activities in liver of chicken after exposure to different doses of MC-LR
3 讨论(Discussion)
3.1 MC-LR对鸡肝脏系数的影响
脏器系数变化是毒理学实验中较为敏感的指标[15],可较好地反映毒物对脏器的毒性综合情况,可旁证病理组织学改变的可能性,也是探索毒物作用靶器官的重要线索。在本研究中,染毒组的鸡肝脏系数从12 h后呈现不同程度的上升趋势;实验过程中对鸡肝进行表观观察,结果发现,鸡肝在1 h时,仅有少量血点出现,从3 h开始,高剂量组肝脏出现局部充血现象,12 h和24 h时,3个染毒组鸡肝具有局部充血现象,48 h时充血范围有减少的趋势。这说明,MC-LR注射后导致了鸡肝充血,从而使肝脏重量增加。这一结果与李哲等[16]及杨黎江等[17]对大鼠和王春雨[12]对鸭的研究结果一致。
3.2 MC-LR对鸡肝抗氧化酶系统的影响
已有的研究证实,微囊藻毒素能诱导细胞或组织产生氧化胁迫,并进一步造成各种损伤和危害,氧化胁迫可能是微囊藻毒素的一个毒性作用机制[17-19]。为抵抗氧化损伤,机体内有一个抗氧化系统,这个系统会利用酶或非酶机制来对抗氧化压力。这个抗氧化系统的酶主要有SOD酶、CAT酶、GPX酶和谷胱甘肽还原酶(GR)等,而非酶物质主要包括维生素E、维生素A和GSH等[19-22]。
抗氧化酶系统发生作用首先是引起谷胱甘肽系统的反应,GSH在氧自由基(ROS)的清除以及微囊藻毒素的解毒过程中均起着非常重要的作用[23],MC在GST酶的催化下,与GSH的结合形成极性较强的结合产物(MC-GSH)而被排出,从而达到解毒的目的,这被认为是微囊藻毒素在动物体内解毒的第一步[24-26]。在本研究中,鸡肝中GSH含量呈现先下降而后上升恢复至正常水平的趋势,GST酶活力表现为先上升而后下降至正常值的趋势。这说明GSH和GST参与鸡肝中MC-LR的解毒。在小龙虾[19]和鱼类[27-28]肝脏的研究中也得出了类似的结论。在本研究中,鸡肝中GSH在前24小时的下降可能是由于其在与MC的结合或清除ROS过程中被消耗掉了,其合成速度难以满足消耗速度,在48 h时恢复至正常水平可能是由于MC和ROS已基本被清除而不再消耗GSH;同样地,GST酶活力从3 h开始显著升高可能主要是为了应对GSH参与解毒的需求所致。
大量的研究已经证实,SOD、CAT和GPX等酶在机体清除过量ROS过程中起着非常重要的作用[21-22],但是,由于不同生物体、不同MC种类、不同剂量以及不同的处理时间,抗氧化酶活性的变化可能存在差异,其变化曲线可能是多阶段的[29-35]。譬如,李效宇等[32]的研究结果显示,MC-LR处理培养的鲤鱼肝细胞后,CAT和SOD酶的活性随着处理时间的延长而逐渐升高;环纹蚬(Corbiculaleana)暴露于有毒蓝藻中,其腮和外套膜中SOD和CAT酶活性显著上升[20];罗非鱼腹腔注射MC-LR后,肝脏中SOD酶表现为在36 h突然上升后恢复的趋势,而CAT酶活性在24 h和84 h有2个高峰[33];鳙鱼腹腔注射蓝藻粗提物后,其肝脏中SOD和CAT酶均呈现先上升后下降的趋势[34];淡水河蚌(Dreissenapolymorpha)经MC-LR染毒后,大部分组织中SOD酶活力在24 h时呈现上升趋势,而CAT酶活性基本没变化[35]。在本研究中,经MC-LR染毒的鸡肝中CAT酶活力表现为先显著下降而后快速上升至正常值的趋势,3 h后,毒素处理组中CAT酶活力略微高于对照组,但无统计学差异;SOD酶在整个实验期间几乎保持稳定。CAT酶活力的下降可能是其酶活力受到抑制所致,而SOD酶活力未出现显著改变可能是与其酶活性较高所致。本研究中,对照组鸡肝中SOD酶活力为(1 011.1±83.25) U·mg-1prot,均高于已有的研究报道中的水平。譬如,对照组罗非鱼和小龙虾肝脏中SOD酶活力水平不到100 U·mg-1prot[19,33],淡水螺(Radixswinhoei)肝脏中SOD酶活力在450 U·mg-1prot左右[36],表明鸡肝中SOD酶参与ROS的清除并不会引起SOD酶活力的大幅波动。
GPX酶是抗氧化酶系统的重要组成,其在GSH的参与下消除机体内过量的ROS[37]。在本研究中,GPX在1 h时,只有高剂量组鸡肝中GPX酶活力显著高于对照组,3 h时,3个染毒组GPX酶活力出现较小的下降、而后显著上升的趋势。这说明鸡肝出现了氧化应激现象,GPX和GSH共同参与了鸡肝中过量ROS的清除,可以作为监测MC-LR引起鸡毒性作用的生物标志物。

