有机磷酸酯对斑马鱼的早期神经毒性作用研究
顾杰,吴江,王宏烨,石利利,吉贵祥,*
1. 生态环境部南京环境科学研究所,南京 210042 2. 教育部现代毒理学重点实验室,南京医科大学公共卫生学院,南京 211166
有机磷酸酯(organophosphate esters, OPEs)是一类重要的阻燃剂和塑化剂,广泛应用于化工、电子、建材以及纺织等行业。近年来,由于多溴联苯醚类阻燃剂在全球范围内的逐步禁用,作为替代品的有机磷酸酯阻燃剂生产量大幅增加,使用范围日趋广泛[1-2]。2011年,有机磷阻燃剂在欧洲的销售量已经远远超过了溴代阻燃剂。全球OPEs产量从1992年的约10万t增加到2007年的34.1万t[3]。北美的磷酸三(2-氯异丙基)酯(TCPP)和已被列入欧盟高关注度物质的磷酸三(2-氯乙基)酯(TCEP)的产量从1986年不足1.4万t,于2012年增至超过3.8万t[4],此外,我国在2007年有机磷酸类物质年均生产量接近7万t,且每年增长速度达到15%[5]。
由于OPEs在使用中主要以简单的物理添加而非化学键合方式加入到材料中,使其极易在材料使用过程中释放到周围环境中,造成环境污染[6-7],且在环境中具有持久性[8]。自然环境中的OPEs含量的高值已达到μg·L-1或μg·kg-1级别[8-11]。刘静等[12]研究珠江主干和东江河流沉积物发现,珠江主干主要污染物为磷酸三(丁氧基乙基)酯(TBEP),其次为磷酸三丁酯(TBP)和磷酸三(2-氯)乙酯(TCEP),均值分别为84.6、55.6和27.8 ng·g-1;东江河段沉积物中以磷酸三甲苯酯(TTP)、磷酸三苯酯(TPhP)和TBEP为主要污染物,平均浓度分别为55.6、32.7和17.5 ng·g-1。高小中等[13]研究发现,中国几条较大河流,长江、东江和珠江中OPEs的浓度分别为4.2~86.6、5.5~76.4和11.6~178.5 ng·L-1。研究显示,TCEP在我国松花江和太湖水体中的浓度分别达到3 700和688 ng·L-1,远超过德国莱茵河和英国亚耳河中的浓度[14];我国珠江三角洲鱼体内检出了高浓度磷酸三(2-丁氧基乙基)酯(TBOEP)(1 647~8 840 ng·g-1脂重)、TCEP(82.7~4 690 ng·g-1脂重)和磷酸三丁酯(TnBP)(43.9~2 950 ng·g-1脂重),与在珠江三角洲附近水域中检出高浓度OPEs的情况相符[14]。上述研究结果表明,目前我国OPEs的污染情况日益严重。
大量毒性实验结果表明,多种OPEs具有明显的毒性效应。例如,Liu等[15]发现磷酸三(1,3-二氯-2-丙基)酯(TDCIPP)对于斑马鱼具有肝脏毒性,会显著提高多种肝脏毒性生物标记基因的转录,并且可以通过改变类固醇生成或雌激素代谢等多种方式对人体细胞和斑马鱼产生内分泌干扰效应等[16]。也有研究发现,室内环境中的OPEs会影响人体激素水平和男性精液质量[17]。高丹等[18]研究发现,4种有机磷阻燃剂浓度与斑马鱼胚胎的孵化率、存活率、心率和体长呈负相关关系,与异常率呈正相关关系。
OPEs在结构上与有机磷农药相类似,而有机磷农药具有神经毒性,但是有机磷酸酯的神经毒性研究甚少,因此,有机磷酸酯是否具有神经毒性也值得关注。本文以斑马鱼作为模式动物,通过对斑马鱼幼鱼运动行为轨迹、氧化应激相关酶活力和神经发育关键基因的研究,来探讨3种有机磷酸酯阻燃剂,即磷酸三苯酯(TPP)、2-乙基己基二苯基磷酸酯(EHDPP)和TCEP,对斑马鱼幼鱼的早期神经毒性,从而为有机磷酸酯类阻燃剂及其替代产品的生产、使用和危险度评估提供直接依据。
1 材料与方法(Materials and methods)
1.1 实验材料
试剂:磷酸三苯酯(triphenylphosphate, TPP)纯度为99%,CAS为115-86-6;2-乙基己基二苯基磷酸酯(2-ethylhexyl diphenyl phosphate, EHDPP)纯度为99%,CAS为1241-94-7;磷酸三(2-氯乙基)酯(tris(2-chloroethyl)phosphate, TCEP),纯度为97%,CAS为115-96-8;阳性对照毒死蜱(chlorpyrifos, CPF),纯度为99%,CAS为2921-88-2;以上试剂购自百灵威公司。过氧化氢酶(CAT)检测试剂盒、总超氧化物歧化酶(SOD)活性检测试剂盒和BCA蛋白浓度测定试剂盒购自碧云天公司。
仪器:Infinite M200型酶标仪(TECAN,瑞士);水质参数仪(HQ40d,美国哈希公司);荧光定量PCR仪(ABI-7300,美国);斑马鱼行为轨迹分析仪(Noldus,荷兰)。
1.2 鱼卵收集
本研究中使用的斑马鱼品系均为AB野生型,亲鱼购自中国科学院武汉水生生物研究所,饲养于实验室内循环养殖系统中,养殖用水为曝气自来水,水温控制在25~29 ℃,溶解氧大于6 mg·L-1,光周期为14 h∶10 h(昼:夜)。斑马鱼亲鱼用刚孵化的丰年虫每天投喂2次,及时清除多余的饲料和排泄物。在繁殖的前一天,雄鱼和雌鱼以2∶1的比例放入繁殖盒中,用隔板将繁殖盒中的亲鱼雌雄分开。次日清晨,将繁殖盒中的隔板拆掉,在光照的刺激下,雄鱼开始追逐雌鱼,雌鱼开始产卵,收集所产受精卵。在显微镜下挑选正常发育的受精卵用磷酸缓冲盐溶液(phosphate buffer saline, PBS)冲洗3次,用于暴露实验。
1.3 胚胎和幼鱼毒性试验
以阳性参照CPF(0.3 mg·L-1)、TPP(0.1和1 mg·L-1)、EHDPP(0.2和2 mg·L-1)和TCEP(0.5和5 mg·L-1)进行暴露,浓度选择参考Jin等[19]、Liu等[20]和Jarema等[21]的研究。CPF、TPP、EHDPP和TCEP用二甲基亚砜(DMSO)配制成母液,-20 ℃保存。
每个浓度组设3个平行。各浓度组及空白对照组均放斑马鱼胚胎90枚,以6孔板为实验容器,实验液体积为6 mL。为减少试验容器对药物的吸附,实验前用相应的试验药物浓度的溶液浸泡试验容器12 h。胚胎收取后培养至受精后4 h(hour post fertilization, 4 hpf),挑选发育正常的斑马鱼胚胎进行染毒,随机分组暴露于对照组、DMSO溶剂组(体积比为0.01%的DMSO)、CPF(0.3 mg·L-1)、TPP、EHDPP和TCEP的处理组,各处理组DMSO的体积比均小于0.01%,连续暴露至第6天。间隔24 h更换新配制的暴露溶液,定时观察受试对象的活动状况,及时取出死亡个体。斑马鱼不同生命阶段的死亡标准如下,卵:特别是在早期阶段,蛋白质凝固和(或)沉降导致透明度下降,兼有颜色上的变化(白色不透明);仔鱼:静止不动,无呼吸运动,心跳停止,中枢神经系统呈白色不透明颜色,对机械刺激无反应等。
1.4 斑马鱼运动行为测试
根据Nery等[22]的实验方法,每个浓度组随机选择24条受精后6 d (days post fertilization, 6 dpf)的斑马鱼幼鱼放入24孔板置于斑马鱼行为分析仪中进行运动行为学测试,24孔板每孔加2 mL暴露液,主要测试幼鱼在固定时间内(50 min)自由游泳行为。受试鱼在实验之前进行10 min的适应,实验后剔除不正常数据。使用EthoVision软件分别采集50 min内各组幼鱼的运动轨迹,利用软件导出运动行为距离和游泳时间,然后计算每组鱼游泳的总距离,各数值分别计入统计。
1.5 氧化应激酶活力的检测
每个浓度组收集6 dpf期的幼鱼各20条,加裂解液(RIPA Lysis Buffer)500 μL,冰上超声破碎组织(时间3 s,间隔6 s,振幅50%)重复2次,共持续6 s,4 ℃、15 000 r·min-1离心10 min取上清,供CAT和SOD测量使用。匀浆液中蛋白含量用BCA蛋白测定试剂盒测定。取50 μL适量匀浆液,采用碧云天试剂盒检测SOD和CAT活力。CAT活性单位定义:每毫克组织蛋白中过氧化氢酶每秒分解吸光度为0.50~0.55的底物中的过氧化氢相对量为一个过氧化氢酶的活力单位(U·mg protein-1)。SOD酶活力单位的定义:在黄嘌呤氧化酶耦联反应体系中抑制率为50%时,反应体系中的SOD酶活力定义为一个酶活力单位(U·mg protein-1)。
1.6 神经发育关键基因转录的检测
采用荧光定量PCR测定方法,利用Primer Premier软件设计并合成神经发育关键基因包括髓磷脂碱性蛋白基因(mbp)和突触蛋白基因(syn2a)以及内参照基因(β-actin)的Real-time PCR引物。每个浓度组收集6 dpf期的幼鱼各20条,提取幼鱼总RNA,逆转录得到cDNA,进行Real-time PCR实验,检测有机磷酸酯暴露对斑马鱼神经发育关键基因转录的影响,基因的引物序列如表1所示。

表1 基因引物序列Table 1 Gene primer sequence
1.7 数据处理
先采用单因素方差分析(One-Way ANOVA)发现各组均数不全相等,再用dunnett检验法比较分析有机磷酸酯对斑马鱼运动行为距离、SOD、CAT活性和神经发育关键基因转录的数据。所有统计分析,使用SAS统计分析系统(version 9.13, SAS Institute, Cary, NC)进行,设P<0.05时有统计学差异。
2 结果(Results)
2.1 有机磷酸酯对斑马鱼幼鱼运动行为的影响
受精卵连续暴露至第6天。如图1所示,与对照组相比,6 dpf斑马鱼幼鱼运动行为除了0.1 mg·L-1TPP组,其余暴露组均抑制了斑马鱼幼鱼行为运动的总距离,具有统计学差异(P<0.05)。
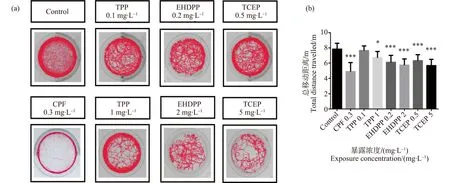
图1 有机磷酸酯(OPEs)暴露对斑马鱼幼鱼(6 dpf)运动行为的影响注:(a). 不同暴露组斑马鱼幼鱼行为轨迹;(b). 不同暴露组斑马鱼幼鱼运动总距离;CPF表示毒死蜱,TPP表示磷酸三苯酯,EHDPP表示2-乙基己基二苯基磷酸酯,TCEP表示磷酸三(2-氯)乙酯;* P<0.05、** P< 0.01、***P<0.001。Fig. 1 The organophosphate esters (OPEs) exposure affected the locomotion behavior of 6 dpf zebrafish larvaeNote: (a). Behavior track of zebrafish larvae in different exposure groups; (b). Total movement distance of zebrafish larvae in different exposure groups; CFP stands for chlorpyrifos; TPP stands for triphenylphosphate; EHDPP stands for 2-ethylhexyl diphenyl phosphate; TCEP stands for tris(2-chloroethyl)phosphate; *P<0.05, **P<0.01, ***P<0.001.
2.2 有机磷酸酯对斑马鱼幼鱼氧化应激的影响
如图2(a)所示,与对照组相比,TPP(1 mg·L-1)、EHDPP(0.2和2 mg·L-1)和TCEP(0.5和5 mg·L-1)显著抑制SOD的活性,具有统计学差异(P<0.05)。如图2(b)所示,与对照组相比,TPP(1 mg·L-1)、EHDPP(0.2和2 mg·L-1)和TCEP(5 mg·L-1)可抑制CAT的活性,具有统计学差异(P<0.05)。与对照组比较,阳性对照组CPF(0.3 mg·L-1)的CAT和SOD的活性略有下降,但没有统计学差异。
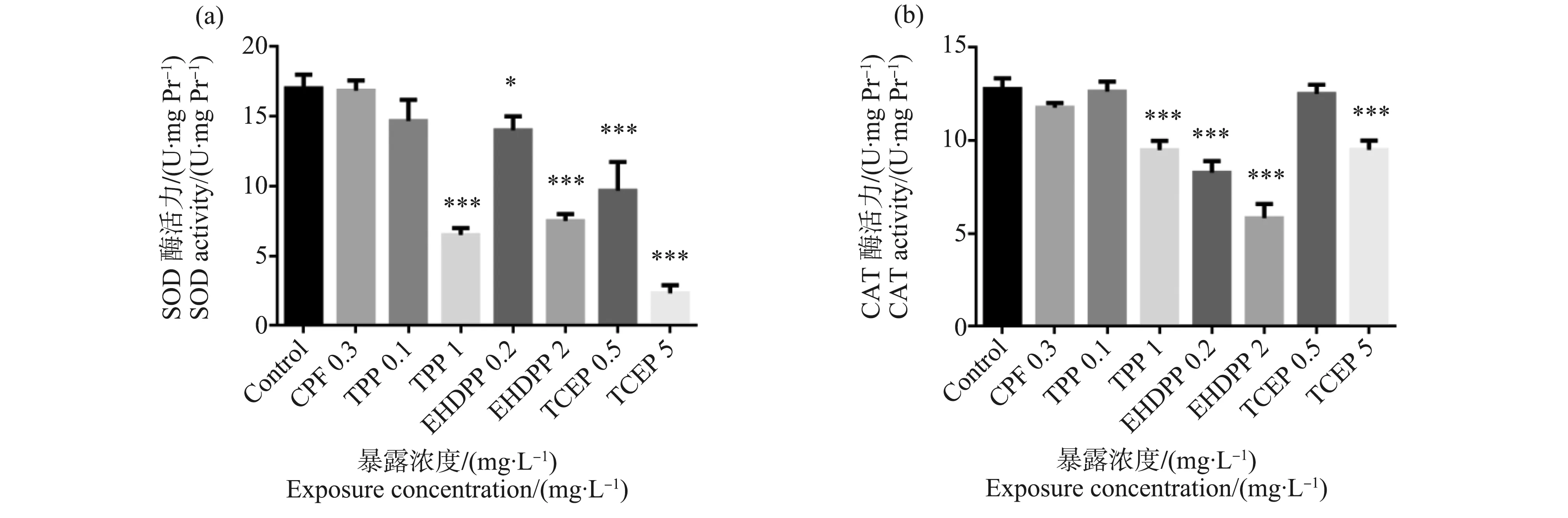
图2 有机磷酸酯暴露对斑马鱼幼鱼超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活力的影响注:*P<0.05、** P<0.01、***P<0.001。Fig. 2 OPEs expsoure altered the levels of superoxide dismutase (SOD) and catalase (CAT) activity in zebrafish larvaeNote: *P<0.05, ** P<0.01, ***P<0.001.
2.3 有机磷酸酯对斑马鱼幼鱼神经发育关键基因的影响
在少突胶质细胞中表达的mbp通常作为斑马鱼和人类的神经系统发育中枢轴突髓鞘化的生物标志物[23-24]。syn2a是哺乳动物中形成突触的生物标志物,在突触发生和神经递质释放中起重要作用[25]。如图3(a)所示,与对照组相比,TPP(1 mg·L-1)、EHDPP(0.2和2 mg·L-1)和TCEP(5 mg·L-1)可抑制mbp基因的转录,具有统计学差异(P<0.05)。如图3(b)所示,与对照组相比,TPP(0.1和1 mg·L-1)、EHDPP(0.2和2 mg·L-1)和TCEP(0.5和5 mg·L-1)可以抑制syn2a基因的转录,具有统计学差异(P<0.05)。
3 讨论(Discussion)
随着欧盟对溴代阻燃剂的禁用,有机磷酸酯阻燃剂作为新型阻燃剂产量持续快速增长,应用领域不断扩大。作为一类新型污染物,OPEs已广泛分布于各种环境介质中,对生态系统和人体健康造成潜在威胁。OPEs与有机磷农药具有相似的分子结构,提示其可能具有神经毒性。然而,OPEs的神经毒性的研究工作仍处于起步阶段,对于OPEs如何引起神经毒性的作用机制较少涉及。因此,针对OPEs的神经毒性作用机制研究将有利于寻找OPEs神经毒性作用的靶点,为OPEs的神经毒性作用的预防和控制提供理论依据。
本研究发现,TPP、EHDPP和TCEP暴露对斑马鱼幼鱼的运动行为具有抑制作用,其可能与氧化应激和神经发育关键基因的转录下调有关。运动行为代表神经控制的活动系统,已被广泛用于测试环境化学品的神经毒性[26]。研究发现,TPP、EHDPP和TCEP暴露显著抑制了斑马鱼幼鱼的运动距离,提示TPP、EHDPP和TCEP可能介导了斑马鱼幼鱼早期阶段的神经毒性。
氧化应激是活性氧(ROS)的过量产生与机体抗氧化能力的失衡引起的。在正常生理状态下,ROS可被抗氧化防御系统有效清除,保障各种生理功能正常有序进行;若两者失衡,就会导致机体损伤。许多外源化学物质进入机体后可产生氧自由基,引起氧化损伤,这是引起细胞死亡的重要诱因。SOD将超氧自由基转化为过氧化氢,是抗氧化系统中的第一道防御屏障,而CAT催化过氧化氢转化成水。本研究发现,SOD和CAT的活性在TPP、EHDPP和TCEP暴露后显著降低,这与彭涛等[27]、龙鼎新等[28]和刘晓晖等[29]的研究结果相类似。因此,TPP、EHDPP和TCEP可能通过产生氧化损伤产生了神经毒性。
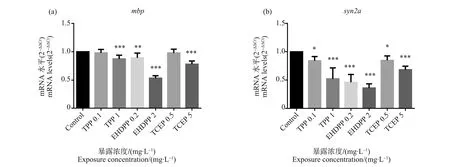
图3 有机磷酸酯对斑马鱼幼鱼神经发育相关基因的影响注:*P<0.05、**P<0.01、***P<0.001。Fig. 3 OPEs affected the expression of key genes for neurodevelopment in the zebrafish larvaeNote: *P<0.05, **P<0.01, ***P<0.001.
此外,本研究还探讨了OPEs暴露对神经发育关键基因的影响。在髓鞘少突胶质细胞中发现的mbp基因也被认为是神经发育的生物标志物[23-24],syn2a基因作为神经递质释放的关键调节剂并涉及突触发生[25]。Sun等[30]研究发现,3种有机磷酸酯(TNBP、TBOEP和TCEP)都会对抑制斑马鱼幼鱼运动行为,产生神经毒性,同时均抑制了mbp和syn2a基因。He等[31]研究发现,甲胺磷抑制斑马鱼幼鱼的运动行为,产生神经毒性,也显著下调了mbp和syn2a基因。本研究发现,TPP、EHDPP和TCEP显著抑制mbp和syn2a基因的转录,下调mbp基因可能抑制少突胶质细胞,进一步影响髓鞘的形成;下调syn2a可能会影响神经分化和突触形成,并最终导致神经行为障碍。
综上所述,斑马鱼幼鱼在早期神经发育阶段暴露于TPP、EHDPP和TCEP可能会通过诱导氧化应激和抑制神经发育关键基因的转录从而导致神经毒性。

