咖啡酸自微乳给药系统的处方设计研究
王丽娜,王树鹏,王冬梅,李校娜,郭云峰
(1.吉林医药学院,吉林 吉林 132013;2.吉林康乃尔药业有限公司,吉林 吉林 132013)
咖啡酸在多种中草药(蒲公英、山里红、杜仲、小蓟、金银花、茵陈等)中存在,具有抗氧化、升白细胞、升血小板、抗血小板凝集、抗氧化、抗肿瘤和脑保护等多种药理作用,且具有低毒、多效的特性,不会对人体造成损害[1]。在防治氧化应激和炎症反应相关疾病中有广阔的应用前景[2]。咖啡酸毒性较低,但口服吸收不好,生物利用度较低,其制剂产品常不能充分发挥药效。此外,咖啡酸的稳定性较差,在体内易迅速转化降解而影响疗效。自微乳给药系统作为一种新型的药物传递系统,可以提高难溶性药物的溶解度,加强药物溶出度,并且可以避免水对不稳定药物的水解及药物对胃肠道的不良刺激,减少胃肠黏膜的清除和首过效应等多方面的优势,可作为难吸收、疏水性或易水解药物的载体。如果将咖啡酸制成自微乳,则可以达到增加药物溶解度,改善药物在胃肠道的吸收,进而提高生物利用度。
1 材料与方法
1.1 材料与仪器
咖啡酸标准品(北京盛世康普化工技术研究院,批号331- 39- 5);咖啡酸(湖北鑫鸣泰化学有限公司);1,2- 丙二醇、盐酸、甲醇、乙醇(均为上海凌峰化学试剂有限公司);薄荷油(黄山天目薄荷药业有限公司);吐温60、吐温40、吐温80、油酸乙酯、聚乙二醇400(PEG- 400)(国药集团化学试剂有限公司);其他试剂为分析纯。
日本岛津LC- 20AT高效液相色谱仪;LC- 20AT泵;LC- solution色谱工作站。ZRS- 8G型溶出度测试仪:上海书培试验设备有限公司;KQ- 250DE型数控超声波清洗器:昆山市超声仪器有限公司;TG16MW型台式高速离心机:湖南赫西仪器装备有限公司;ZS90型粒度分析仪、恒温磁力加热搅拌器、0.45 μm微孔滤膜:津腾。
1.2 咖啡酸溶解度的测定
分别精密量取油相油酸乙酯、薄荷油、油酸和乳化剂吐温80、吐温60、吐温40及助乳化剂乙醇、PEG400、1,2- 丙二醇各2 mL,加入过量咖啡酸,超声至不再溶解,在(37.0±1.0)℃水浴恒温振荡48 h,得咖啡酸饱和溶液15 000 r/min离心20 min,取上清液,经0.45 μg滤膜过滤,取甲醇适当稀释后,定容至10 mL容量瓶中。计算咖啡酸在各组分中溶解度。
1.3 油相与表面活性剂的配伍筛选
将油相和表面活性剂的质量比分别为1∶9、2∶8、3∶7、4∶6、5∶5、4∶6、7∶3、8∶2、9∶1,在室温下以100 r/min转速磁力搅拌下混合均匀,加入50倍量的水,恒定转速下磁力搅拌使之乳化,观察乳液外观情况,并将乳液放置过夜在观察及记录。按五个等级标准[3]来评价自微乳乳化效果:A.溶液呈澄清或微泛蓝色乳光的微乳,乳化时间小于1 min;B.溶液略浊,呈蓝白色乳光的微乳,乳化时间小于1 min;C.呈亮白色不透明液体的微乳,乳化时间1~2 min;D.色泽暗,呈灰白色,略带油状,时间大于2 min;E.很难乳化且一直有油滴存在,乳化时间小于2 min。
1.4 助表面活性剂的筛选
选择乳化性能较好的薄荷油和吐温80进行组合,分别以乙醇和PEG400为助乳化剂。在油相中分别加入助乳化剂混合均匀,再加入配伍中的乳化剂(Km值为1∶1,总质量为0.5 g)混匀观察是否有分层现象,在磁力搅拌下滴加50倍量水,使其在蒸馏水中乳化,以体系状态和五个等级标准为评价指标[3- 4]。
1.5 伪三元相图的绘制
根据试验选用薄荷油为油相,吐温80为表面活性剂,PEG400为助表面活性剂。将表面活性剂与助表面活性剂按质量比(Km)1∶1、1∶2、2∶3、2∶1、3∶2、3∶1混合,磁力搅拌均匀,再与薄荷油按Km 1∶9、2∶8、3∶7、4∶6、5∶5、6∶4、7∶3、8∶2、9∶1混匀,在磁力搅拌器上搅拌(100 r/min),并进一步缓慢加入蒸馏水,考察成乳状况,并记录系统临界点时油、水以及混合表面活性剂质量百分数,绘制伪三元相图。
1.6 星点设计- 效应面法优化自微乳处方
1.6.1自微乳成乳粒径大小
将按比例制备的不同处方的自微乳,取自制的咖啡酸自微乳,磁力搅拌,加入50倍体积的(37±0.5)℃温度的蒸馏水,磁力搅拌均匀,0.45 μm微孔滤膜过滤后,选择激光粒度测定仪,测定微乳的平均粒径[5]。
1.6.2载药量的测定
将按不同比例制备的空白自微乳,加入过量的咖啡酸,磁力搅拌均匀,加入50倍体积的(37±0.5)℃温度的蒸馏水,磁力搅拌20 min后,15 000 r/min离心20 min,吸取上清液,用甲醇稀释定容,45 μm微孔滤膜过滤后,紫外分光光度法测定,平行3次实验,取其平均值[6]。
1.6.3优化自微乳处方
在伪三元相图筛选处方的基础上,选取对自微乳性质影响较显著的两个因素油相质量分数(X1)及乳化剂与助乳化剂的比值Km(X2)为考察因素,运用伪三元对Km值进行试验,将Km的范围定为1~3。实验中发现油相的比例越低自微乳体系的稳定性及安全性越高,油相过高难以形成自微乳,因此将油相质量分数的范围定10%~40%。以载药量、粒径为考察指标,采用星点设计- 效应面法,建立数学模型,对处方进行优化。试验中每个因素的5水平分别记作-α、-1、0、+1、+α,其中X1、X2对应各水平的取值范围(见表1)。

表 1 星点设计的因素水平及代码
1.7 咖啡酸自微乳的体外评价
1.7.1外观形态
肉眼观察咖啡酸自微乳在25、37 ℃时,以及加入20、50、100倍量水的外观变化。
1.7.2粒径及分布
咖啡酸自微乳稀释100倍后,激光粒度测定仪测定微乳的平均粒径。
1.7.3长期稳定性考察
观察自微乳溶液在30 d内的变化。
1.7.4体外释放度测定
取咖啡酸自微乳,按照《中国药典》2015年版释放量测定法规定,采用溶出度测定法第二法(浆法)的装置,以0.1 mol/mL、1 L为溶出介质[7],温度为(37±0.5)℃,转速定为100 r/min,分别于5、10、20、30、45、60 min取样5 mL,同时补充同体积同温度的溶出介质。用紫外分光光度法测定不同时间点咖啡酸的含量,计算累积释放量。
2 结 果
2.1 咖啡酸溶解度的测定
计算咖啡酸在各组分中溶解度。结果可以看出在不同乳化剂中,咖啡酸在吐温80中的溶解度最大。在不同的油相中,咖啡酸在薄荷油中的溶解度最大。在不同的助乳化剂中的溶解度大小依次为PEG400>乙醇>1,2- 丙二醇。因此,选择以薄荷油为油相,吐温80为乳化剂来进行下面的处方优化实验。
2.2 油相与表面活性剂的配伍筛选
不同油相与乳化剂的配伍,结果显示,随着表面活性剂与油相比例的增加,乳化效果越来越好,当比例为9∶1时,效果最好,等级为A。
2.3 助表面活性剂的筛选
结果表明以PEG400为助乳化剂时,油相与乳剂的比例为1∶9、2∶8、3∶7都能形成自微乳状态。乙醇的乳化能力没有PEG400的好,并且在实验过程中发现无水乙醇太容易挥发而影响处方的稳定性。所以,本实验确定选用PEG400为助乳化剂。
2.4 伪三元相图的绘制
结果表明油相质量所占比例为10%~40%,Km值1~3范围内能形成自微乳,结果见图1。
2.5 星点设计- 效应面法优化自微乳处方
星点设计- 效应面法优化自微乳处方试验设计及结果见表2。
采用Design- Expert 8.0.6软件,对各个因素水平进行非线性回归处理,得拟合方程。载药量=33.98-1.99A-1.10B-1.27A2-1.85B2(R=0.909 7)。粒径=16.46+3.87A+0.32B+1.82AB+5.01A2-3.72B2(R=0.891 8)。由上述方程可知,载药量与粒径的非线性拟合效果较好,相关系数R值都较高,说明结果具有一定的统计学意义,表明此设计模型的拟合程度较好。因此可以用此模型对咖啡酸自微乳处方进行预测、筛选和分析。

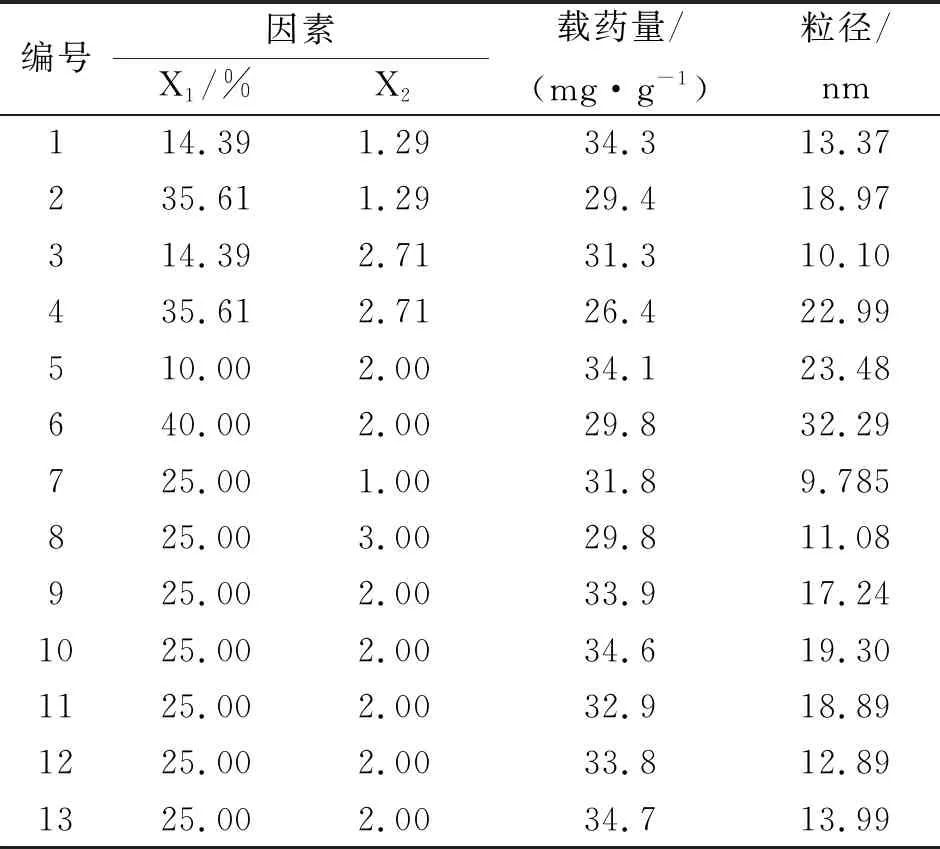
表 2 星点设计及结果
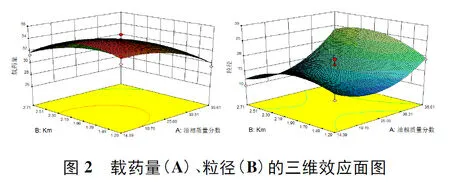
运用Design- Experts 8.0.6软件进行拟合作图可得效应面曲线(见图2)。可直观反映各因素和响应值及各考察因素之间的相互作用。根据此模型拟合得出的方程和响应面图,可以运用Design- Experts 8.0.6的预测功能,确定咖啡酸自微乳的最优处方为:油相比例为20.37%,Km值为1.27,载药量理论值为33.86 mg/g,粒径理论值为12.49 nm。
2.6 咖啡酸自微乳的体外评价
2.6.1外观形态
结果表明在25、37 ℃时均为澄清或微泛蓝色乳光的微乳溶液。加入20、50、100倍量水后,形成的微乳体系颜色均为澄清透明,流动性良好。
2.6.2粒径及分布
乳滴平均粒径为13 nm,呈正态分布,与形态考察结果基本一致。
2.6.3长期稳定性考察
经观察,自微乳溶液在30 d内没有药物析出和分层现象发生,溶液由澄清透明渐变成乳白色,咖啡酸含量无明显变化,表明咖啡酸自微乳在30 d内稳定性良好。
2.6.4体外释放度测定
溶出度结果表明自微乳给药传递系统能提高咖啡酸的溶出度。这是因为将咖啡酸制成自微乳后,进入胃肠道的咖啡酸自微乳遇水能自发形成细小的水包油型微乳,该微乳能快速分布于胃肠道中。由于微乳粒径较小产生巨大的比表面积,使药物很容易透过胃肠壁的水化层,促进药物在胃肠道的吸收。
3 讨 论
自微乳给药系统是在37 ℃轻微搅拌的条件下由油相、表面活性剂和助表面活性剂形成外观均一透明并含有药物的液体制剂,由于乳化剂的存在,它自发形成水包油型、粒径小于100 nm的微乳[8]。作为一种新型的药物传递系统,可以提高难溶性药物的溶解度,加强药物溶出度,并且可以避免水对不稳定药物的水解及药物对胃肠道的不良刺激,减少胃肠黏膜的清除和首过效应等多方面的优势,可作为难吸收、疏水性或易水解药物的载体[9]。
在自微乳处方筛选中,应尽量选择对药物溶解度大的油相、乳化剂和助乳化剂,以提高自微乳的载药量。但是在实际应用中需要考虑各成分的刺激性以及之间的相互作用。因此本研究在测出溶解度的基础上进行了配伍实验,这可以直观地反映各成分的相互影响结果。本研究也考察了常见的助乳化剂如无水乙醇,但在实验操作过程中发现无水乙醇容易挥发影响处方的稳定性,所以最终选择稳定的、乳化能力较好且无毒的PEG400为助乳化剂的用量。加入助乳化剂可以减少乳化剂的用量,达到减少对胃肠道刺激的目的,增大咖啡酸药物在油相中的溶解度,提高自微乳给药系统的载药量。本研究得到的咖啡酸最佳处方,咖啡酸自微乳体外溶出较高,有利于药物的吸收。本研究结果为进一步探索咖啡酸自微乳的体内吸收情况奠定了基础,也为咖啡酸及以咖啡酸为主要有效成分的中药材制剂开发提供了有利依据。

