miR-152调控糖尿病心肌病心肌成纤维细胞增殖的作用
王鑫洋,陶 辉,丁季飞,徐盛松,石开虎
(安徽医科大学第二附属医院 1.心胸外科,2. 心血管病研究中心,安徽 合肥 230601)
糖尿病(diabetes mellitus,DM)是一种以血糖升高为特征的代谢性疾病,它最终能导致各种组织,包括肾、眼、心脏等一系列血管并发症的发生[1]。心肌纤维化是一种常见的纤维化过程,其参与了心衰、房颤等多种心脏器质性病理损伤过程[2-3]。糖尿病致心肌纤维化是导致糖尿病心肌病的重要病理过程之一[4],在心肌纤维化过程中,心肌成纤维细胞和胶原蛋白等细胞外基质起到了重要作用[5]。MicroRNA是一类长为22~23个核苷酸的内源性非编码小RNA,通过对mRNA 3′-端非编码区的不完全互补结合,对其蛋白表达水平进行调节,从而参与许多重要的生理病理过程的调控[6]。其中miR-200b[7]、miR-29[8]、miR-21[9]在心肌纤维化的胶原沉积中有重要作用。有报道称,miR-152能减弱DNMT1介导的甲基化,从而抑制肝纤维化[10],但其在心脏疾病中尚未见报道。本研究通过动物实验和细胞实验,旨在探究miR-152对糖尿病心肌病的影响,为治疗和干预糖尿病心肌病,延缓心肌纤维化过程,提供新的靶点。
1 材料与方法
1.1 材料
1.1.1实验动物 40只健康成年SD ♂大鼠,体质量(160~200) g;出生1~3 d的60只健康SD乳鼠,体质量(15~25) g,均购于安徽医科大学动物实验中心,动物许可证号:SYXK(皖)2017-006。
1.1.2试剂 链尿佐菌素(streptozotocin,STZ)、MTT试剂盒,均购自美国Sigma公司;DMEM培养基(美国Thermo Fisher Scientific公司);TRIzol试剂、LipofectamineTM2000(美国Invitrogen公司);U6 qPCR试剂盒、miR-152模拟物(上海吉玛公司);逆转录引物(上海生工生物工程公司);胰蛋白酶(美国WISENT公司);β-actin多克隆抗体、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)多克隆抗体、Ⅰ型胶原蛋白(collagen typeⅠ,Collagen Ⅰ)多克隆抗体(武汉博士德生物公司)。
1.1.3仪器 EPS 300电泳仪、转膜仪(Tanon);显影仪、实时定量PCR仪(美国Bio-Rad公司);细胞培养箱(美国Thermo Fisher Scientific公司);varioskan LUX酶标仪(Thermo Scientific);ZHJH-C1112C超净工作台(智城);生物安全柜(海尔)。
1.2 方法
1.2.1建立SD大鼠糖尿病模型 将40只大鼠随机分为对照组和糖尿病组,每组各20只。糖尿病组1次性腹腔注射STZ,分别在注射后的d 3与d 7,通过大鼠尾静脉取血测血糖,如果两次血糖均高于11.1 mmol·L-1,则认为大鼠造模成功。对照组注射等量生理盐水。常规饲养12周后,麻醉后处死大鼠,解剖出大鼠心脏,取部分心肌组织,多聚甲醛固定后石蜡切片,分组行HE和Masson染色,观察心肌组织和心肌纤维化程度。剩余部分心肌组织提取蛋白和RNA,分别行Western blot检测各组α-SMA和Collagen Ⅰ的表达,qPCR检测各组miR-152的表达。
1.2.2乳鼠原代心肌成纤维细胞的提取和培养 将出生1~3 d健康乳鼠浸泡在75%酒精消毒后处死,在无菌操作台用眼科剪、镊子解剖出完整的小鼠心脏,去除心脏表面脂肪组织、结缔组织后,用无菌预冷的PBS漂洗3遍,洗净表面血液,转移至新的EP管中,小心剪成1 mm3大小组织块,加入胰蛋白酶和胶原酶(比例为2 ∶1)的混合液,在37 ℃水浴锅中充分震荡消化15 min,用细胞筛过滤后取上层清液,加入等量的DMEM培养基终止消化后,900 r·min-1离心10 min,小心弃去上清液,用含血清的DMEM培养基吹散细胞沉淀,转移至细胞培养瓶中,置于5% CO2、37 ℃的细胞培养箱中孵育90 min后换液,显微镜下观察细胞形态,此时贴壁的即为心肌成纤维细胞。而后继续培养至3~4代细胞用于后续实验。
1.2.3miR-152的转染 用细胞计数板计数心肌成纤维细胞,计数后等量接种于6孔板,次日待各孔中细胞密度达到70%~80%后进行转染。按照说明书配成miR-152模拟物原液,吸取10 μL,加入500 μL Opti-MEM无血清培养基混匀后备用;吸取LipofectamineTM2000 10 μL,加入500 μL Opti-MEM混匀后备用;将上述两种混合液混匀后,配成miR/LipofectamineTM2000复合物,静置30 min后加入6孔板中,在细胞培养箱中孵育6 h后换成正常培养基,再培养48~72 h后提取RNA和蛋白质,进行下一步实验。
1.2.4细胞分组及处理 将正常细胞及转染后的细胞分别行高糖(葡萄糖浓度33.3 mmol·L-1)和低糖(葡萄糖浓度5.5 mmol·L-1)培养,在培养24、48 h后提取蛋白质和总RNA,分别行Western blot和qPCR。
1.2.5Western blot检测组织和细胞中的目的蛋白 分别取心肌组织和细胞,置于冰上,加入RIPA裂解液和PMSF,离心后,取上清液测量蛋白浓度,而后加入蛋白上样缓冲液100 ℃加热5 min。冷却后SDS-PAGE凝胶电泳,转膜,8%脱脂奶粉封闭1 h,4 ℃摇床孵育α-SMA、Collagen Ⅰ一抗过夜,次日分别加二抗室温孵育1 h后,采用ECL法,以β-actin为内参,检测目的蛋白的表达。
1.2.6qPCR检测miR-152的表达 待转染24 h后,使用TRIzol法提取总RNA,按如下步骤:25 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min进行逆转录,得到cDNA。按如下步骤行qPCR检测miR-152的表达:预变性95 ℃ 10 min;变性:95 ℃ 20 s,退火:62 ℃ 30 s,延伸:72 ℃ 30 s,共进行40个循环的扩增;熔解曲线阶段:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。最后用U6作为内参,根据2-ΔΔCT法计算各组mRNA的相对表达水平。按如下步骤行qPCR检测α-SMA和Collagen Ⅰ的表达:预变性阶段50 ℃ 2 min,95 ℃ 10 min;扩增阶段95 ℃ 20 s,60 ℃ 30 s,72 ℃ 30 s,共进行40个循环;熔解曲线阶段95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s 。以β-actin为内参,根据2-ΔΔCT法计算mRNA的相对表达量。引物序列见Tab 1。

Tab 1 Primer sequences for qPCR
1.2.7MTT检测心肌成纤维细胞增殖 取转染后的细胞,调整细胞浓度至1×108·L-1,而后按每孔100 μL接种于96孔板中。在培养24、48 h后,加入10 μL 5 g·L-1的MTT溶液,继续培养4 h后吸弃液体,加入150 μL DMSO,摇床孵育10 min后,测量490 nm处吸光度值。

2 结果
2.1 大鼠心脏标本病理学变化心肌细胞在HE染色中为紫红色,而细胞核为紫蓝色。如Fig 1所示,对照组心肌细胞排列规则,大小形态正常;糖尿病组心肌细胞排列杂乱,胶原明显增多,细胞体积增大。Masson染色显示心肌细胞为紫红色,蓝黑色部分为细胞核,心肌间质胶原纤维为紫蓝色。对照组心肌细胞排列整齐,大小正常;糖尿病组中胶原纤维增多,细胞大小不一,结构消失。
2.2 大鼠糖尿病组和对照组心肌标本α-SMA和Collagen Ⅰ蛋白的表达变化如Fig 2所示,糖尿病组大鼠心肌标本中α-SMA和Collagen Ⅰ蛋白的表达量较对照组明显增高(P<0.05)。

Fig 1 HE and Masson staining(×200)

Fig 2 Expression of α-SMA and collagen Ⅰ in heart tissue of STZ
2.3 大鼠糖尿病心肌标本中miR-152的表达变化qPCR检测结果如Fig 3所示,糖尿病组大鼠心肌组织中miR-152的表达明显低于对照组(P<0.05)。
2.4 高糖处理乳鼠原代心肌成纤维细胞中miR-152的表达变化应用高糖处理乳鼠原代心肌成纤维细胞,如Fig 4所示,经过高糖刺激24 h后,miR-152的表达明显降低(P<0.05)。

Fig 3 Expression of miR-152 in heart

Fig 4 Expression of miR-152 in SD
2.5 乳鼠原代心肌成纤维细胞转染结果转染miR-152模拟物后培养24 h,检测miR-152的表达。如Fig 5所示,与对照组相比,miR-152模拟物组的miR-152含量明显增多(P<0.01)。
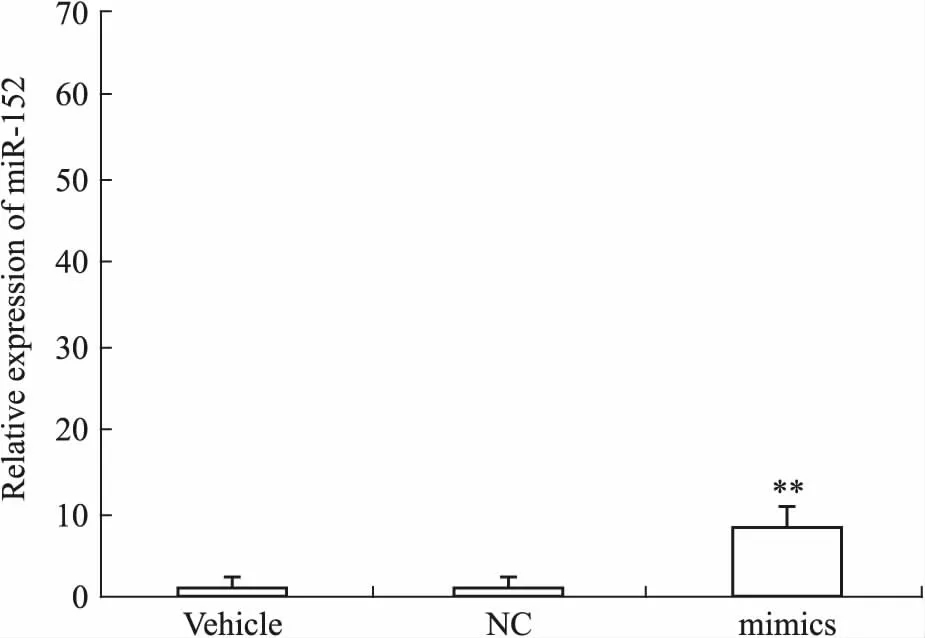
Fig 5 Expression of miR-152 after transfect
2.6 miR-152模拟物对乳鼠心肌成纤维细胞中α-SMA和Collagen Ⅰ蛋白表达的影响如Fig 6所示,转染miR-152模拟物后,α-SMA和Collagen Ⅰ蛋白的表达量较空白组和阴性对照组明显降低(P<0.05)。

Fig 6 Protein expression of collagenⅠand
2.7 miR-152对细胞增殖的影响如Fig 7所示,在转染后24、48 h行MTT检测,结果显示,miR-152模拟物组的心肌成纤维细胞增殖水平较空白对照组和阴性对照组明显降低(P<0.05)。

Fig 7 Level of proliferation of CFs after
3 讨论
糖尿病是临床上常见的代谢性疾病,由于其并发症众多,常常可以引起诸如心脑血管、眼底、神经等多器官的损伤。其中,糖尿病心肌病是糖尿病的重要并发症,而糖尿病心肌病的特征性病理变化是心肌纤维化,可导致心功能不全,甚至心衰[11-12]。心脏的细胞主要由心肌细胞和其周围的心肌成纤维细胞构成[13]。心肌纤维化的发生、发展过程中,心肌成纤维细胞和胶原分泌增多发挥着重要作用。高血糖的糖基化终末产物可诱导心肌成纤维细胞增殖,从而导致心肌重构[14]。
微小RNA(microRNA,miR)是一类由内源基因编码的,高度保守的非编码单链RNA小分子,由18~25个核苷酸构成。通过对功能蛋白的信使RNA(message RNA,mRNA)进行降解或翻译抑制,对其蛋白表达水平进行调节,从而参与许多重要的生理病理过程的调控。研究表明,miR-152参与纤维化疾病发生、发展,然而,miR-152在糖尿病心肌病中起何作用仍未明确。本课题通过建立糖尿病动物模型以及高糖细胞模型,探究miR-152在糖尿病心肌病中的调节作用及可能机制。动物实验表明,糖尿病组心肌组织相较于对照组胶原明显增加,细胞排列紊乱。Western blot结果表明,糖尿病组α-SMA和Collagen Ⅰ蛋白的表达量较对照组明显增高。qPCR结果表明,糖尿病组miR-152表达明显低于对照组。细胞实验表明,经过高糖刺激后,qPCR结果表明miR-152的表达较低糖组明显降低;心肌成纤维细胞转染miR-152模拟物后,α-SMA和CollagenⅠ蛋白的表达量较空白组和阴性对照组相比明显降低;同时,MTT结果显示,CFs转染miR-152模拟物后,心肌成纤维细胞的增殖活性明显降低。
综上所述,miR-152的高表达可降低α-SMA和Collagen Ⅰ等相关心肌纤维化蛋白的表达,从而抑制心肌纤维化的发生。可以为预防心肌纤维化和延缓其相关疾病,如糖尿病心肌病的进展,甚至逆转其病理改变提供新的思路。
(致谢:本实验在安徽医科大学第二附属医院中心实验室完成,感谢各位老师和同学的帮助和耐心指导。)

