缺氧条件下骨髓间充质干细胞对血管内皮细胞迁移和管腔形成的影响
王雅芬,苏静波,王雨生,惠延年,郭长梅
0 引言
早产儿视网膜病变(retinopathy of prematurity,ROP)是新生儿失明的主要原因之一,其发病过程包括两个阶段,首先是出生后视网膜血管生长延迟与现有血管部分消退,其次是缺氧诱导的病理性视网膜新生血管(retinal neovascularization,RNV)生成[1]。损伤的视网膜血管会使血管闭塞、视网膜缺血,破坏视网膜血管内皮细胞的屏障,导致血管渗漏、新生血管进入玻璃体腔,引起视网膜脱离而失明[2]。尽管可以通过限制组织局部缺血(视网膜激光光凝术)和/或血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)的过度分泌(玻璃体腔注射抗VEGF药物)的治疗来预防RNV形成,但以上治疗均有不同程度的限制性。视网膜激光光凝术存在多种并发症如视网膜出血、视功能不良等,抗VEGF药物治疗长期疗效和安全性也尚不确定,因此仍需深入了解ROP所涉及的机制,并开发新的治疗方案[3-4]。
RNV的形成涉及两种不同的机制,即血管发生和血管生成。前者是指由血管内皮祖细胞发育成血管内皮细胞并最终形成血管的过程;后者是指在原有的毛细血管或者微静脉基础上,通过血管内皮细胞的增殖、分化和迁移,以芽生或非芽生的形式生成新生的血管,大量研究证实眼部新生血管的形成具备上述两种方式[5-6]。在血管发生的机制中,骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)发挥着重要的作用,本课题组前期研究表明BMSCs可被募集到缺氧的视网膜中并分化为如血管内皮细胞、平滑肌细胞等多种细胞类型促进眼部新生血管的形成[7-8]。然而缺氧条件下BMSCs是否也可通过血管生成的方式促进RNV的形成及其潜在的机制尚不清楚。因此,本研究拟采用体外细胞共培养模型,利用BMSCs、猴脉络膜-视网膜血管内皮细胞(RF/6A)和人脐静脉血管内皮细胞(human umbilical vein endothelial cells,HUVECs),观察缺氧条件下BMSCs对血管内皮细胞迁移和血管形成能力的影响,丰富RNV的分子机制,为临床诊治提供新的靶点。
1 材料和方法
1.1材料
1.1.1实验动物和细胞SPF级C57BL/6J小鼠(雄性、4~6周龄),购自于空军军医大学实验动物中心。实验动物的使用和处死根据中国科学技术委员会颁布的实验动物管理条例和ARVO规范进行。RF/6A购自于中国科学院细胞库,HUVECs为自主培养。
1.1.2主要试剂DMEM培养基、胎牛血清(fetal bovine serum,FBS,Gibco),DME/F12培养基(HyClone),内皮细胞专用培养基(endothelial cell medium,ECM,ScienCell),孔径8μm的Transwell小室(Millipore),Matrigel基质胶(BD)。
1.2方法
1.2.1 BMSCs的培养与鉴定BMSCs采用全骨髓贴壁法培养。取4~6周龄C57BL/6J雄性小鼠,脱颈处死,75%乙醇浸泡消毒,于超净台中取其股骨和胫骨,将骨髓冲洗到含有10% FBS和1%青霉素/链霉素的DME/F12培养基中,过滤并铺在培养皿中。将细胞在37℃下于5% CO2的细胞培养箱中培养,每3d更换1次培养基,直至达到80%~90%融合度后传代。将生长状态良好的第3代BMSCs悬浮于PBS中,并将密度调节至每45μL PBS含细胞1×106个。细胞分为五管,其中一管用作阴性对照,其他管中分别加入PE-CD90、PE-CD44、FITC-CD34和FITC-CD45抗体,室温孵育1h后将细胞重悬于PBS中并通过流式细胞仪测定。
1.2.2 HUVECs和RF/6A的培养HUVECs取材于空军军医大学第一附属医院妇产科,从新鲜脐带中分离。将细胞在含有5% FBS、1%青霉素/链霉素和1%内皮细胞生长补充剂的ECM专用培养基中进行培养,第3~6代用于研究。RF/6A在含有10% FBS和1%青霉素/链霉素的DMEM培养基中培养,第3~8代用于实验。
1.2.3 BMSCs缺氧模型的建立和条件培养基的制备采用三气培养箱模拟物理缺氧条件。BMSCs换液后置于37℃体积分数为1% O2、5% CO2、94% N2的三气培养箱内缺氧培养24h。取缺氧条件下培养的BMSCs培养基作为缺氧组的条件培养基(conditional medium,CM)、同时取常氧条件下培养的BMSCs培养基作为常氧组的CM、血管内皮细胞的正常培养基作为对照组的CM。
1.2.4 Transwell实验采用24孔Transwell小室(8μm)进行迁移测定。将RF/6A(2×104/孔)和HUVECs(1×105/孔)的细胞悬浮液分别接种到Transwell上室中,并将500μL不同组的CM添加到下室,继续在培养箱中常规培养24h。然后将小室置于4%多聚甲醛中20min,小心擦拭小室上腔未迁移的细胞,继续将小室用结晶紫染色15min。PBS洗3次后在显微镜下随机取6个视野拍照并计数。
1.2.5管腔形成实验Matrigel基质胶于4℃冰箱中过夜消融,1∶1稀释后加入96孔板(50μL/孔),37℃静置30min使胶凝固。将RF/6A和HUVECs消化成悬液,每孔加入5×104个细胞,再用超滤后的对照组CM、常氧条件下BMSCs的CM和缺氧条件下BMSCs的CM补足至200μL,混匀后常规培养6h。显微镜下随机选取3个视野拍照,Image J软件分析。

2 结果
2.1 BMSCs的培养和鉴定结果如上提取BMSCs,第3d首次换液后有少许短棒状的细胞贴壁,第6d可见紧密排列、长梭状的细胞(图1A,B)。首次传代后,细胞状态良好,呈多触角状生长,第3代细胞大部分大小相似、呈成纤维状、多触角贴壁(图1C,D)。取生长状态良好的细胞进行流式,鉴定其特异性表面抗原标志物。结果显示CD90和CD44呈阳性(图1E,F),CD34和CD45呈阴性(图1G,H),证明成功培养了BMSCs,可用于后续实验。
2.2缺氧条件下BMSCs的CM对血管内皮细胞迁移的影响采用Transwell方法检测常氧和缺氧条件下的BMSCs对RF/6A迁移的影响。结果显示,对照组、常氧组和缺氧组的血管内皮迁移数量分别为19.00±3.61、32.33±3.06、114.00±11.53个,差异有统计学意义(F=153.3,P<0.001)。相对于对照组,常氧组和缺氧组的血管内皮细胞迁移数量在24h后均有增加,缺氧组的迁移数量最多(均P<0.01,图2)。同样分组和方法检测常氧和缺氧条件下的BMSCs对HUVECs迁移的影响,结果与RF/6A相似,对照组、常氧组和缺氧组的HUVECs迁移数量分别为76.00±9.54、122.00±18.68、307.70±25.97个,差异有统计学意义(F=121.5,P<0.001),缺氧组处理的HUVECs迁移数量大于对照组和常氧组(均P<0.05,图3)。
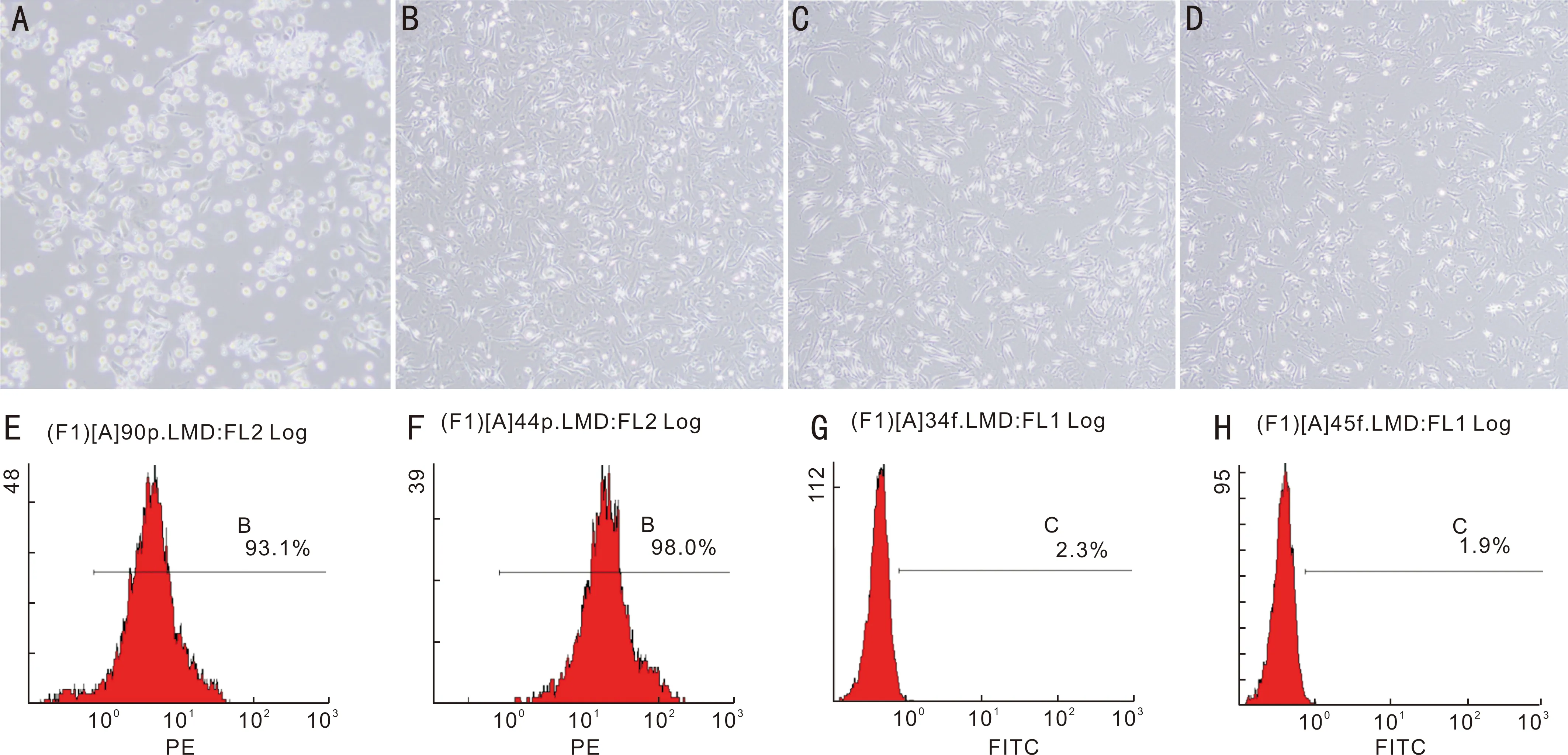
图1 BMSCs的形态观察和鉴定(×200)A:第3d少许细胞贴壁;B:第6d细胞呈紧密排列、长梭状;C:第1代细胞呈多触角状生长;D:第3代细胞呈成纤维状、多触角贴壁生长;E~H:流式鉴定BMSCs表面标记物CD90、CD44阳性,CD34和CD45阴性(E:CD90;F:CD40;G:CD34;H:CD45)。
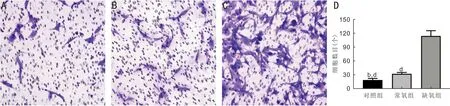
图2 Transwell检测不同组细胞条件培养基作用24h对RF/6A的迁移能力(×200)A:对照组;B:常氧组;C:缺氧组;D:迁移数量统计图;bP<0.01 vs常氧组;dP<0.001 vs缺氧组。
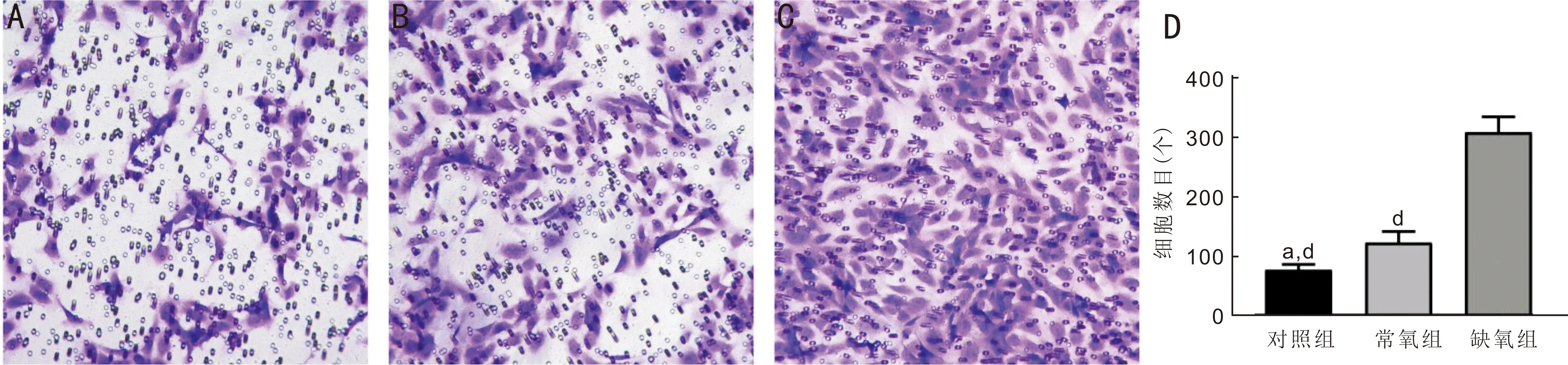
图3 Transwell检测不同组细胞条件培养基作用24h对HUVECs的迁移能力(×200)A:对照组;B:常氧组;C:缺氧组;D:迁移数量统计图;aP<0.05 vs 常氧组;dP<0.001 vs缺氧组。
2.3缺氧条件下BMSCs对血管内皮细胞管腔形成能力的影响RF/6A经各组CM孵育6h后,对照组、常氧组和缺氧组的血管内皮细胞的成管数目、成管总长度和分支数如下:(1)成管数目:12.00±3.00、37.00±4.58、51.00±3.61个,差异有统计学意义(F=81.7,P<0.001);(2)成管总长度:17.41×103±1.45×103、21.48×103±1.20×103、33.68×103±2.08×103μm,差异有统计学意义(F=62.1,P<0.001);(3)分支数:120.70±6.02、165.70±10.69、214.30±14.57个,差异有统计学意义(F=54.41,P<0.001)。结果显示缺氧组的管腔形成能力明显上升,其成管数目、成管总长度和分支数均大于对照组和常氧组,差异有统计学意义(均P<0.05,图4)。用相同刺激和方法处理HUVECs,各组成管数目、成管总长度及分支数如下:(1)成管数目:2.00±1.00、6.67±1.53、30.0±03.61个,差异有统计学意义(F=124.0,P<0.001);(2)成管总长度:8.55×103±1.58×103、13.15×103±0.66×103、18.64×103±1.63×103μm,差异有统计学意义(F=41.12,P=0.0003);(3)分支数:83.00±7.21、120.70±4.04、147.70±12.86个,差异有统计学意义(F=40.63,P=0.0003)。结果也显示相对于对照组和常氧组,缺氧组的管腔形成能力显著增加(均P<0.05,图5),同RF/6A类似。

图4 管腔形成实验检测不同组细胞条件培养基作用6h对RF/6A的成管能力(×200)A:对照组;B:常氧组;C:缺氧组;D:成管数目统计图(bP<0.01,dP<0.001 vs 缺氧组);E:成管总长度统计图(aP<0.05,bP<0.001 vs 对照组;dP<0.01 vs 常氧组);F:分支数统计图(bP<0.01 vs 常氧组;dP<0.001 vs 缺氧组)。

图5 管腔形成实验检测不同组细胞条件培养基作用6h对HUVECs的成管能力(×200)A:对照组;B:常氧组;C:缺氧组;D:成管数目统计图(aP<0.05 vs 对照组;dP<0.001 vs 缺氧组);E:成管总长度统计图(bP<0.01 vs 缺氧组;dP<0.01 vs 常氧组);F:分支数统计图(aP<0.05 vs 缺氧组;dP<0.01 vs 对照组)。
3 讨论
ROP患者出生后暴露于高氧环境时,由于缺乏健康血管发育所必需的因素,发生氧化应激、氧调节的促血管生成因子的下调和促炎因子的上调,导致视网膜和脉络膜血管闭塞,当返回常氧条件时,形成由缺氧代偿的病理性新生血管[9]。BMSCs是骨髓来源细胞的一种重要类型,本组前期研究和文献表明,BMSCs可以被募集到缺氧的视网膜和脉络膜中,通过与新生的血管芽结合或者向血管内皮细胞和平滑肌细胞等多种细胞类型的分化促进眼部新生血管的形成[7,10-11]。Hou等[7]将BMSCs移植到激光诱导的脉络膜新生血管(choroidal neovascularization,CNV)小鼠模型中,发现BMSCs可分化为上述多种细胞类型促进新生血管的形成。Cai等[11]也发现,在糖尿病小鼠CNV中,BMSCs可被募集到CNV中且VEGF和基质细胞衍生因子(stromal cell derived factor-1,SDF-1)等表达上调。而缺氧条件下的BMSCs对RNV的研究较少,因此需要深入探讨。
本研究采用常氧和缺氧条件下BMSCs的CM处理两种血管内皮细胞RF/6A和HUVECs,观察其对RNV的影响。RF/6A是视网膜和脉络膜的组合细胞,为视网膜的特异性细胞系;HUVECs是从人脐带静脉血管内皮细胞中分离的原代细胞,为研究新生血管的进展提供了重要的体外血管内皮细胞模型,在视网膜新生血管的研究中也广泛应用[12-13]。本研究结果表明,在两种血管内皮细胞中,相对于对照组和常氧组,缺氧组的CM能明显提高血管内皮细胞的迁移和管腔形成能力,表现为血管内皮细胞的迁移数量增多;成管数目、成管总长度和分支数目增多。查阅文献可发现,也有报道将缺氧条件下的BMSCs与HUVECs共培养可促进血管内皮细胞的增殖、迁移和血管生成情况,而除了骨髓来源的MSCs外,胎盘来源的MSCs与HUVECs共培养后,随着缺氧水平的增加,HUVECs管状结构的稳定性和促血管生成因子的表达水平也相应增加,这与我们的研究相似[14-15]。而本研究结果不仅证实在来源于脐带较大血管的血管内皮细胞HUVECs中,在代表RNV病理生理学部位的毛细血管脉管系统的血管内皮细胞RF/6A中,缺氧条件下的BMSCs也具有提高血管内皮细胞迁移和血管生成的能力。
综上所述,本研究证明,缺氧条件下的BMSCs可以促进血管内皮细胞HUVECs和RF/6A的迁移和血管形成能力,为BMSCs参与RNV性疾病的发生发展提供了体外理论支持。但缺氧条件下的BMSCs是如何调控血管内皮细胞血管生成的呢,其涉及的分子机制是什么呢?近期有研究证实,缺氧条件下BMSCs来源的外泌体及其含有的遗传物质,如信使RNA(mRNA)和micro-RNA(miRNA),可促进HUVECs的增殖、迁移和血管生成情况,外泌体中的遗传物质在细胞通讯中起重要作用,其可在生理和病理情况下由细胞分泌到细胞外,参与病理性血管生成、氧化应激反应、免疫应答、炎症和肿瘤的过程[16-17]。而缺氧条件下的BMSCs 是否也可以通过外泌体及其含有的miRNA调控RNV呢,这有待于我们进一步去研究,通过体外到体内研究及潜在的分子机制,再回到临床层面的研究,有助于全面、深入地了解RNV性疾病的发生机制,为相关靶点应用于临床转化医学和可能的新药开发提供重要的依据。
- 国际眼科杂志的其它文章
- Effect of GSH and niacin combination on protein oxidation,ER stress,glycation and aggregation in HLE cells under high glucose condition
- Evaluation of cerebral visual functions in low myopic adolescents
- 模拟失重对成年小鼠闪光视网膜电图和视网膜微循环的影响
- LV-EGFP标记兔角膜基质细胞体外基质层移植的实验观察
- 沉默SIAH1基因对H2O2诱导的人晶状体上皮细胞凋亡的影响
- 杞菊地黄丸治疗干眼症有效性及安全性的Meta分析

