模拟失重对成年小鼠闪光视网膜电图和视网膜微循环的影响
戴旭锋,保金华,陈晓萍,李文炯,黄海笑,陈 浩
0 引言
失重状态下液体悬浮无沉降,航天员体内的流体静压消失,血液和其他体液不像重力条件下那样惯常地流向下身。相反,约有2000mL血液由下身转移到胸腔和头部,其中20%左右重分布到头面部,可引起宇航员面部浮肿、头胀、颈部静脉曲张和鼻咽部堵塞等改变[1-3]。血液重新分布后,头部灌流压增高20~30mmHg[4-6]。近年来国外航天医学研究发现,航天员在太空失重环境下,出现了不同程度的视觉功能和解剖学的改变,包括视盘水肿、眼球变扁、视网膜皱褶、远视以及眼内压升高等;这些改变有的人是短暂的,有些人要持续较长的时间。初步研究结果提示,可能与航天员头部(尤其是眼球)血液重新分布有关[2-3,7]。至于失重对眼球尤其是视网膜的影响有多大,能否恢复,是否会造成视网膜永久性损害等,这些问题目前尚不清楚。文献报道一些啮齿类动物在地面,通过改变体位的方式,可以模拟失重状态下体液重分布[8-9],本研究选择小鼠进行实验。在观察指标方面,闪光视网膜电图(electroretinogram,ERG)能客观反映视网膜整体功能,其中振荡电位(oscillatory potentials,OPs)还能敏感地反映视网膜中内层的血液循环状态[10-11]。本研究通过以上功能学检测,并结合一些相关的形态学研究,来初步探讨模拟失重对小鼠视网膜的影响。
1 材料和方法
1.1材料健康雄性2月龄清洁级C57BL/6J小鼠36只,体质量23±3g,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(苏)2016-0003。小鼠饲养于12h明/12h暗交替环境中,实验动物饲养及操作,均在温州医科大学眼视光学院动物实验中心进行。小鼠的喂养和使用,符合浙江省实验动物管理的有关规定和条例。10%荧光素钠注射液购自美国爱尔康公司;小鼠源抗Rhodopsin抗体(一抗)购自美国Millipore公司,兔源抗红/绿视锥细胞视蛋白(Opsin)抗体(一抗)、兔源抗蓝视锥细胞Opsin抗体(一抗)和Cy3标记的山羊抗兔IgG(二抗)均购自德国Merck Millipore公司,Alexa Fluor 488标记的山羊抗小鼠IgG(二抗)购自美国Thermo Fisher Scientific公司;TUNEL细胞凋亡检测试剂盒购自美国Roche公司。
1.2方法
1.2.1动物模型的制备和分组按随机原则,将动物分为3个实验组和3个相应的对照组,最终每组6只小鼠。实验组参照Morey-Holton大鼠尾部悬吊法[8],稍加改进,使之更适合建立小鼠模拟失重模型。实验动物单笼饲养,尾部悬吊于笼顶,后肢自然悬空不受力,躯干长轴与笼底水平约呈30°角。前肢可正常抓地,小鼠能在笼底一定范围自由活动,但始终保持头低位,造成腹部和后肢的体液头向重分布。期间,动物能顺利进食和饮水。对照组小鼠也单笼饲养,尾部装置同实验组,但躯干长轴与笼底水平可呈0°角。对照组小鼠的摄食量,与相应的实验组前1d的摄入量相同。具体分组如下:实验1组(尾悬15d),实验2组(尾悬30d),实验3组(悬吊30d后恢复体位30d);对照1组(正常饲养15d),对照2组(正常饲养30d),对照3组(正常饲养60d)。作为对照的3组小鼠不改变正常体位,分别饲养15、30和60d,然后同样进行视网膜检测。
1.2.2 ERG小鼠暗适应过夜后,用复方托吡卡胺眼药水充分散瞳。氯胺酮(72mg/kg)和赛拉嗪(4mg/kg)混合液腹腔注射,动物全身麻醉后在角膜缘放置环状细金丝电极,作为记录电极;双耳正中头皮下插入的针状电极作为参考电极,尾根部皮下插入的针状电极作为地电极。全视野球形刺激器(Ganzfeld Q450),标准白色闪光强度为3.0(cd·s)/m2,诱导暗适应ERG。记录混合反应时,通频带设为0.2~500Hz;记录OPs时,通频带设为65~300Hz[12],单次闪光刺激持续时间为2ms,对相关反应波的幅值进行测量并分析。
1.2.3荧光素眼底血管造影应用小动物视网膜影像系统(Micron IV),对小鼠行荧光素眼底血管造影(fluorescein fundus angiography,FFA)检查。小鼠全身麻醉后置于专用的小动物台上,使用人工泪液防止角膜干燥及屈光间质混浊,被检眼充分散瞳。调整小鼠眼位,镜头向角膜缓慢推进,不断调焦直至眼底清晰可见,且视乳头基本居中。然后,动物腹腔注射荧光素钠(0.001mL/g)。蓝光照射下,循环至眼底血管的荧光素被激发出黄绿色荧光,对视网膜微血管的循环情况进行拍照[13]。
1.2.4免疫组化检测感光细胞视色素或视蛋白的表达取材、固定和脱水:小鼠处死后马上取眼球,在1×PBS中快速剪除角膜,将眼球即刻浸泡在4%多聚甲醛溶液中固定过夜(pH=7.4,4℃),固定好的眼球在30%蔗糖中脱水4h。冰冻切片制备:眼球标本在包埋剂中浸2h,-80℃包埋然后冰冻切片,片厚12μm,切片方向与视轴平行。贴片于载玻片,在室温下干燥30min。免疫荧光染色:冰冻切片置于穿透液(0.3% Triton X-100)中30min,增强细胞膜的通透性。常温下,在5%牛血清白蛋白(工作液)中封闭1h。滴加一抗孵育过夜(4℃),常温下二抗孵育2h(避光)。用到的一抗有小鼠源抗Rhodopsin抗体(1∶300)、兔源抗两种视锥细胞Opsin抗体(1∶400),合适的二抗有山羊抗小鼠IgG(1∶400)和山羊抗兔IgG-Cy3(1∶1000)。1×PBS清洗,滴加DAPI染细胞核,免疫荧光显微镜(Zeiss)检查。
1.2.5视网膜组织细胞凋亡检测TUNEL(TdT-mediated dUTP nick end labeling)细胞凋亡试剂盒是用来检测组织细胞在凋亡早期过程中细胞核DNA的断裂情况[14]。小鼠视网膜冰冻切片在0.2%的Triton X-100中处理,然后浸洗干净。将50μL的TdT和450μL荧光素标记的dUTP液混匀,制备成TUNEL反应混合液。TUNEL技术常常造成假阴性或假阳性,因此有阳性对照和阴性对照可更准确地对结果进行分析。阳性对照先加100μL的DNaseⅠ液,反应控制在15℃~25℃,持续时间为10min,然后再加50μL的反应混合液;阴性对照仅加50μL荧光素标记的dUTP液。本实验悬吊组和相应的对照组视网膜标本,直接加50μL的反应混合液;切片在暗湿盒中反应1h(37℃),漂洗干净后盖上盖玻片,在荧光显微镜(激发光的波长为488nm)下观察。
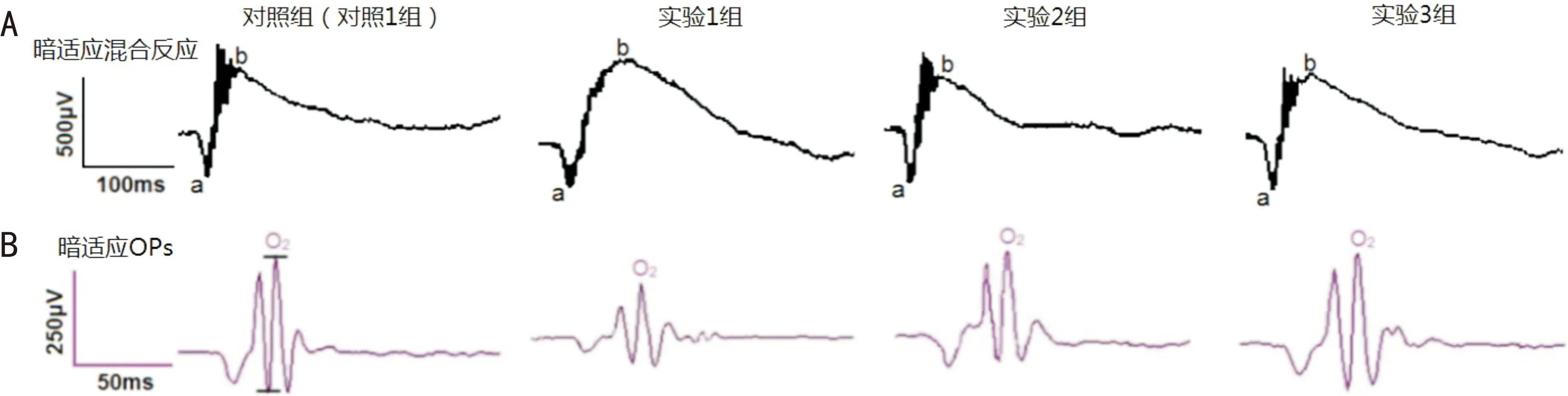
图1 模拟失重组和对照组小鼠暗适应闪光ERG A:混合反应;B:OPs。

图2 模拟失重组和对照组小鼠FFA图 荧光素注射后5min进行拍照,在距离视乳头3PD的区域,比较各组视网膜的微循环状态。实验1组视网膜微血管网,较其他组更加密集,呈迂曲、扩张的表现。A:对照1组;B:实验1组;C:实验2组;D:实验3组。

表1 模拟失重组和对照组小鼠暗适应闪光ERG的b波和O2波幅值比较
统计学分析:采用统计学软件SPSS17.0分析数据,所有定量资料均满足正态分布,以均数±标准差表示。悬吊组与相应天数的对照组之间,数据比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1模拟失重对小鼠ERG的影响闪光ERG的混合反应和OPs,都是在3.0(cd·s)/m2的强光刺激下,由视网膜产生的生物电信号。混合反应b波幅值,实验1组较对照1组升高,且差异有统计学意义(t=2.860,P<0.05,图1A,表1)。实验2、3组的b波幅值,与对照2、3组相比,差异均无统计学意义(t=1.350、-0.487,均P>0.05,表1)。同混合反应不同,OPs是在较窄通频带(本实验设为65~300Hz)条件下记录到的一组节律性小波,后者不受b波影响。小鼠OPs一般含有3~6个子波,各子波间隔时间约为10ms,其中第二子波(O2)相对比较稳定。实验1组O2幅值为197±33μV,对照1组O2的幅值为336±47μV,两者差异有统计学意义(t=-5.938,P<0.001,图1B,表1)。实验2、3组的O2幅值,与对照2、3组比较,差异均无统计学意义(t=-1.887、1.023,均P>0.05,表1)。
2.2模拟失重对小鼠视网膜血液循环的影响10%荧光素钠在1s内被快速注射完毕,然后开始计时。注射后3~5s,视乳头及视网膜动脉开始显影,然后各级血管相继快速充盈;至5min时,视网膜毛细血管已充盈;5min后脉络膜的背景荧光开始逐渐变亮。在荧光素注射后5min时,对距离视乳头相同距离的后极部视网膜,进行观察并比较微循环状态。结果显示,实验1组视网膜微血管网较其他组更加密集,呈迂曲扩张的表现,而视网膜大血管管径、走行未见明显异常(图2B)。实验2、3组,微循环均未显示明显异常,与相应的对照组没有区别(图2C、D)。
2.3各组感光细胞视色素或视蛋白的表达以及TUNEL染色情况模拟失重的实验组中,感光细胞视色素或视蛋白的表达未见明显异常(图3)。在此基础上,我们还进行TUNEL细胞凋亡检测,观察模拟失重是否造成视网膜中内层神经细胞的损伤。根据特殊的荧光素标记,TUNEL试剂盒能准确地定位正在凋亡的组织细胞。本实验结果显示,模拟失重的3个悬吊组小鼠,视网膜各层组织细胞均未见明显的凋亡(图4),与相应的对照组没有区别。
3 讨论
太空失重状态与人类生存的地球环境完全不同,失重对已适应地球重力作用的哺乳动物的影响,已成为空间生命科学研究的热点之一。国际公认的在地面模拟失重效应(体液头向重分布)的方法,包括适用于人[15]和猕猴的头低位卧床实验[16],以及适用于小型啮齿类动物的尾悬吊实验[9]。以小鼠为例,体位改变后身体躯干与水平面的夹角越大,腹部和后肢体液发生头向转移的量越多。但夹角过大时,正常的进食进水会受到严重影响,将导致动物体质量锐减,存活期普遍很短(≤1wk),造模反而不能成功。

图3 模拟失重组和对照组小鼠视网膜感光细胞视色素或视蛋白的表达(免疫荧光染色×200)视杆细胞感光色素(Rhodopsin)染成绿色,视锥细胞视蛋白(Opsin)染成红色,细胞核染成蓝色。A:对照1组;B:实验1组;C:实验2组;D:实验3组。

图4 模拟失重组和对照组小鼠视网膜组织细胞凋亡检测(TUNEL染色×200)凋亡细胞中断裂DNA会结合特异性的基团,并产生显色反应。A:阳性对照;B:对照1组;C:实验1组;D:实验2组;E:实验3组。ONL:外核层;INL:内核层;GCL:神经节细胞层。
当身体躯干与水平面的夹角减至30°时[9],动物正常的进食和饮水量基本不受影响,除造模容易成功外,实验的干扰因素也最少。
哺乳动物的外层视网膜组织,基本上都含有两种感光细胞,分别为视杆和视锥细胞。视杆细胞感光色素(Rhodopsin)和视锥细胞特异性Opsin的表达情况,与视网膜的生理功能和ERG结果密切相关。闪光ERG能够客观、敏感地反映全视网膜的整体功能。ERG混合反应的b波上升支,通常有一组规律的振荡小波(OPs),后者被认为起源于视网膜中内层神经网络的抑制性反馈回路[10-11]。我们以小鼠作为研究对象,动物改变体位后短期内OPs幅值下降。OPs幅值的变化同b波不一致,提示前者可能是模拟失重状态下,体液重新分布所导致的特异性改变。从ERG混合反应以及感光细胞视色素或视蛋白的表达情况来分析,视网膜外层的神经细胞(光感受器)并未受到较大的影响。模拟失重状态下体液重新分布,可能主要影响视网膜中内层的功能。本研究发现,视网膜OPs的变化规律,可以用来验证动物造模是否成功。
根据本研究中几个时间点的ERG数据,我们发现视网膜功能变化呈如下趋势:(1)模拟失重短期内(尾悬15d),视网膜中内层呈现功能下降,小鼠OPs幅值约为正常水平的60%。(2)模拟失重时间延长(尾悬30d),可能随着动物自身调节机制的启动,视网膜相关功能又出现回升,此时OPs幅值达到正常水平的85%左右。(3)尾悬30d小鼠恢复正常体位1mo后,视网膜中内层功能基本上能完全恢复至正常水平。除了小鼠之外,人体在地面模拟失重的实验,也发现OPs在一定范围内发生波动[17]。
临床上发现,OPs对视网膜中内层的血液循环状态比较敏感。比如糖尿病视网膜病变和视网膜静脉阻塞的早期,由于视网膜循环发生阻滞和静脉淤血,OPs幅值可显著降低[10-11]。本研究中小鼠尾悬15d发生OPs异常,进一步行FFA检测,也发现该时间点视网膜微血管网呈迂曲、扩张的特点。以上可能与小鼠腹部及后肢的血液大量回流到头部,导致暂时的视网膜微循环异常有关。人体头低足高位卧床,模拟失重状态下血液重新分配,短期内也会造成头面部供血增加,同时引起眼部血液循环改变,这种改变对视功能可能造成影响[7]。
小鼠尾悬30d组,动物机体可能已经对模拟失重(体液头向重分布)状态产生适应,此时视网膜微循环和神经生物电反应出现恢复。人体模拟失重早期,视网膜在表现为功能的下降后;随着自身调节机制的启动,视网膜功能也会出现反应性升高,甚至超出正常水平;随着不断地自身调节,最终也能恢复到正常水平[17]。小鼠模拟失重短期内,形态学上除了视网膜微循环发生暂时性改变外,TUNEL染色未见视网膜组织细胞的结构性损伤。
从航天员经历过的短、中期在轨飞行情况来看[7],失重对眼球的影响并不大且基本上能完全恢复。这与本研究中,动物实验的一些形态和功能检查结果基本一致。随着悬吊时间延长,视网膜微循环的异常状态发生改善,提示动物机体可能存在某种神经血管的调节机制。然而航天员长期在太空工作和生活后,视网膜及其功能出现紊乱,除了失重状态下全身体液重分布外,可能也和其他因素有关,如宇宙辐射,航天器内空气组成和湿度异常,特殊航空食谱,以及航天员生物节律异常等[18-19]。
小鼠尾悬短期内ERG-OPs异常,可能与视网膜中内层的微循环状态改变有关。相关的视觉电生理检测,不仅可以用来验证动物体液头向重分布的造模是否成功外;将来还可能适用于失重状态下,对宇航员的视网膜功能进行无创性监测。
- 国际眼科杂志的其它文章
- Effect of GSH and niacin combination on protein oxidation,ER stress,glycation and aggregation in HLE cells under high glucose condition
- Evaluation of cerebral visual functions in low myopic adolescents
- LV-EGFP标记兔角膜基质细胞体外基质层移植的实验观察
- 沉默SIAH1基因对H2O2诱导的人晶状体上皮细胞凋亡的影响
- 杞菊地黄丸治疗干眼症有效性及安全性的Meta分析
- OCTA在不同中医证型POAG患者视觉损害评价中的应用

