LV-EGFP标记兔角膜基质细胞体外基质层移植的实验观察
张 璐,李 妍,李梦怡,王爔烔,李楠钰,孙子雯,胡竹林
0 引言
角膜基质细胞(corneal stromal cells,CSCs)是来源于神经脊的一种纤维细胞[1],在不同的外界刺激下能转换为成纤维细胞或肌成纤维细胞。研究表明角膜基质细胞还有干细胞特性[2],能向脂肪细胞及成骨细胞转换[3]。且CSCs在正常静止状态下,对角膜基质纤维层的排列及角膜透明的维持有十分重要的作用[4-6];在病理及应激状态下,参与角膜的损伤修复、瘢痕形成及多种角膜疾病[7-8]。因此CSCs作为三大种子细胞之一,是未来角膜组织工程的研究热点之一。本实验通过慢病毒载体(lentivirus,LV)携带标记基因增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)标记CSCs,观察不同时间点EGFP的表达及周围组织的炎症反应,判断CSCs的存活时间,为后期相关人工角膜的动物实验奠定基础。
1 材料和方法
1.1材料
1.1.1主要试剂和设备DMEM/F12(1∶1)培养基(美国Hyclone公司);胎牛血清(FBS,美国GIBCO公司);胶原酶Ⅱ(美国Sigma);0.25%胰蛋白酶—EDTA(美国Millipore公司);抗荧光衰减封片剂(含DAPI)(北京索莱宝生物科技有限公司);eGFPLentifectTM慢病毒颗粒(杭州复能生物科技有限公司);聚凝胺DNA转染增强剂(polybrene)(北京索莱宝生物科技有限公司);波形蛋白单克隆抗体(美国Invitrogen公司);DAB免疫组化试剂盒(北京中杉金桥生物公司);通用二步法检测试剂盒(北京中杉金桥生物公司);曲拉通X-100(北京索莱宝生物科技有限公司);SMZ1500体视显微镜及光学照相系统(日本Nikon公司);CO2恒温培养箱(美国Fisher Scientific公司);TC处理6孔细胞圆形爬片(上海晶安);T25细胞培养瓶、12孔培养板(无锡耐思生物科技有限公司)。
1.1.2试剂配制兔CSCs细胞培养液:10%FBS+1%双抗+DMEM/F12;Polybrene的配置:用兔CSCs细胞培养液以1∶1000稀释。
1.1.3实验动物及分组健康、成年新西兰大白兔16只,均为雌性,由昆明医科大实验动物中心提供。新西兰大白兔随机分为2组。实验组:经LV-EGFP转染后的兔CSCs细胞悬液,100μL角膜基质注射;对照组:0.9%的生理盐水100μL角膜基质注射。实验方案获得伦理委员会通过(2014-Y02)。
1.2方法
1.2.1兔CSCs的原代分离培养、传代无菌条件下摘除兔眼角膜,获取全程角膜片,在显微镜下,刮除角膜上皮,完整撕下角膜后弹力层及内皮层,得到角膜基质片。经含双抗的PBS漂洗3次后,角膜剪剪碎,1%的2型胶原酶37℃中震荡消化70min,含血清的培养基终止消化,1000r/min、5min、离心2次。弃上清,收集细胞悬液,接种于T25培养瓶中,置37℃、体积分数5% CO2饱和湿度培养箱中培养,3d后第1次半量换液,以后每2~3d换液1次。细胞铺满培养瓶80%~90%后,以1∶2~1∶3传代,传至第2代,备用。
1.2.2兔CSCs的鉴定取第3代CSCs,消化后接种于盖玻片,进行细胞爬片,倒置显微镜下观察细胞铺满玻片70%~80%时的细胞爬片最佳。用4%的多聚甲醛常温固定20min后,PBS清洗3次,每次5min;0.3%的Triton X-100透膜10min后,PBS清洗3次,每次3min;滴加3%过氧化氢去离子水,室温孵育10min,PBS漂洗3次,每次3min;10%山羊血清封闭20min,勿洗;加一抗(波形蛋白单克隆抗体1∶200稀释),4℃过夜;其余步骤按照免疫组化试剂盒说明书操作。同时设立阴性对照组,以PBS缓冲液代替一抗。
1.2.3兔CSCs的LV-EGFP转染兔CSCs取第2代细胞,复苏,铺满培养瓶80%~90%后,0.25%胰蛋白酶-EDTA消化,细胞计数仪计数,以0.5×105个/mL的细胞密度接种在12孔板中,每孔500μL;24h后吸出细胞培养液,PBS清洗2次,加入病毒(LV-EGFP的MOI值为400)及稀释的Polybrene;12孔板以划8字的方式混匀,混匀后,置于37℃、5%CO2培养箱中培养;12~16h后吸出病毒培养液,换用含5%FBS的培养液,观察吸出病毒液后24、48、72、96、110h的荧光强度及细胞形态。
1.2.4兔CSCs的体外移植新西兰大白兔经耳缘静脉麻醉后(3%戊巴比妥钠、1mL/kg),置于手术显微镜下,盐酸奥布卡因点右眼,开睑器开睑;提前制备LV-EGFP转染后的兔CSCs细胞悬液(本次实验中使用的细胞为转染LV-EGFP后96h),密度为5×105个/mL,抽取100μL于1mL注射器中备用;左手持显微镊夹住兔右眼眼结膜,起到固定作用,右手持1mL注射器(将针头换为30G),缓慢进入角膜基质层,切勿进入前房;对照组同上,将注射器中细胞悬液换为0.9%生理盐水。实验中实验组及对照组兔均对右眼进行操作,左眼不做处理。
1.2.5术后眼前段照相术后数小时及术后第1d将新西兰大白兔送至科室行裂隙灯下眼前段照相。
1.2.6冰冻切片制作及石蜡HE染色冰冻切片观察细胞存活,转染后1wk,1mo分别处死新西兰大白兔,无菌条件下摘除眼球,眼球不经任何处理(切勿固定或冲洗),立即送往病理科,取下眼角膜,用刀片切成小块,1/2做冰冻切片,切片厚度为6μm,切好的冰冻切片不染色,滴含DAPI抗荧光的封片剂封片,置于黑盒内自然风干后,荧光显微镜下观察。石蜡切片HE染色,普通显微镜下观察角膜形态及炎症反应,剩下1/2固定、包埋做成石蜡切片,常规脱蜡,依次放入二甲苯Ⅰ、二甲苯Ⅱ各10min;100%乙醇Ⅰ、100%乙醇Ⅱ、95%乙醇Ⅰ、95%乙醇Ⅱ、85%乙醇各5min,水洗;放入苏木素染色5min,水洗;1%盐酸-乙醇分化数秒,自来水冲洗返蓝;伊红染色数秒;常规不同浓度的酒精梯度脱水;二甲苯透明;中性树胶封片,显微镜下观察。
2 结果
2.1兔CSCs细胞培养、鉴定及LV-EGFP转染兔CSCs后生长形态观察原代分离兔CSCs,部分细胞24h即可贴壁,7d后即可见细胞散落在培养瓶中,细胞呈梭形,胞核居中,胞浆清亮,10d后细胞铺满培养瓶80%左右,未见上皮或其它杂质细胞,兔CSCs以1∶2~1∶3传代,3d即可传1代(图1)。波形蛋白免疫组化结果:在培养出的细胞中阳性表达,胞浆为棕色,阴性对照组未见表达(图2)。

图1 兔CSCs原代培养(×100)A:PO第8d;B:PO第10d;C:P2第3d。
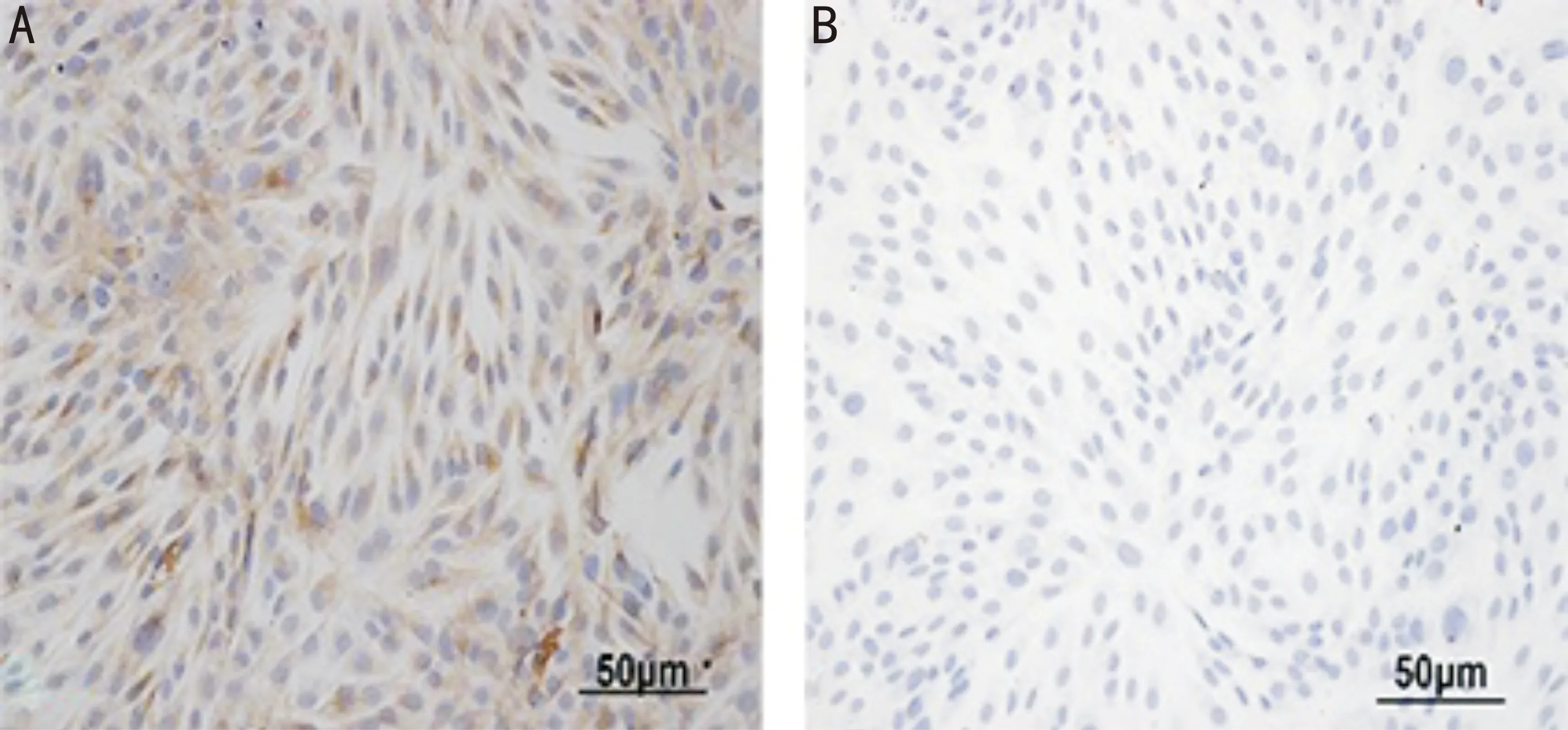
图2 兔CSCs波形蛋白免疫组化(×200)A:波形蛋白免疫组化见细胞质棕色着色,细胞核淡蓝色着色;B:阴性对照组见细胞核及细胞浆均为淡蓝色。
荧光倒置显微镜下观察兔CSCs,吸出病毒液后24h后可见少量绿色荧光,随着时间的延长,荧光强度逐渐增强,连续观察48、72、96、110h时间点,发现96h和110h时荧光强度在倒置显微镜下较前增强,但两者无明显差异,考虑96h时间短,故选96h为转染的时间;在不同的显微镜下观察,LV-EGFP转染兔CSCs后,细胞贴壁生长良好,呈现梭形,细胞形态清楚(图3)。

图3 不同时间点经慢病毒转染的兔CSCs(×100)A:病毒吸出后24h;B:病毒吸出后48h;C:病毒吸出后72h;D:病毒吸出后96h;E:病毒吸出后110h;F:转染LV-EGFP的CSCs。
2.2 LV-EGFP标记兔CSCs后细胞移植的观察实验中进行角膜基质的细胞移植时,在手术显微镜下观察到:30G针头进入角膜基质层,推入细胞悬液或生理盐水后出现明显的灰白色混浊。灰白色混浊数小时即可消失,转染后1d行裂隙灯下眼前段照相未见角膜水肿、未见白色混浊(图4)。

图4 兔角膜基质注射图(均为右眼)A:正常角膜图片;B:实验组角膜基质注射;C:对照组角膜基质注射;D:实验组转染后1d;E:对照组转染后1d。
2.3冰冻切片及HE染色结果荧光显微镜下,1wk,1mo后实验组中角膜基质层中均可见绿色荧光,DAPI染色可见细胞核为蓝色,发出绿色荧光的细胞即实验中LV-EGFP标记的细胞;对照组中未见绿色荧光细胞,DAPI染色可见细胞核为蓝色(图5)。石蜡切片HE染色,转染后1wk实验组见明显上皮细胞增生及角膜水肿,炎症细胞浸润,转染后1mo实验组上皮细胞增生减弱,未见角膜水肿;对照组1wk,1mo角膜HE染色均未见明显异常(图6)。
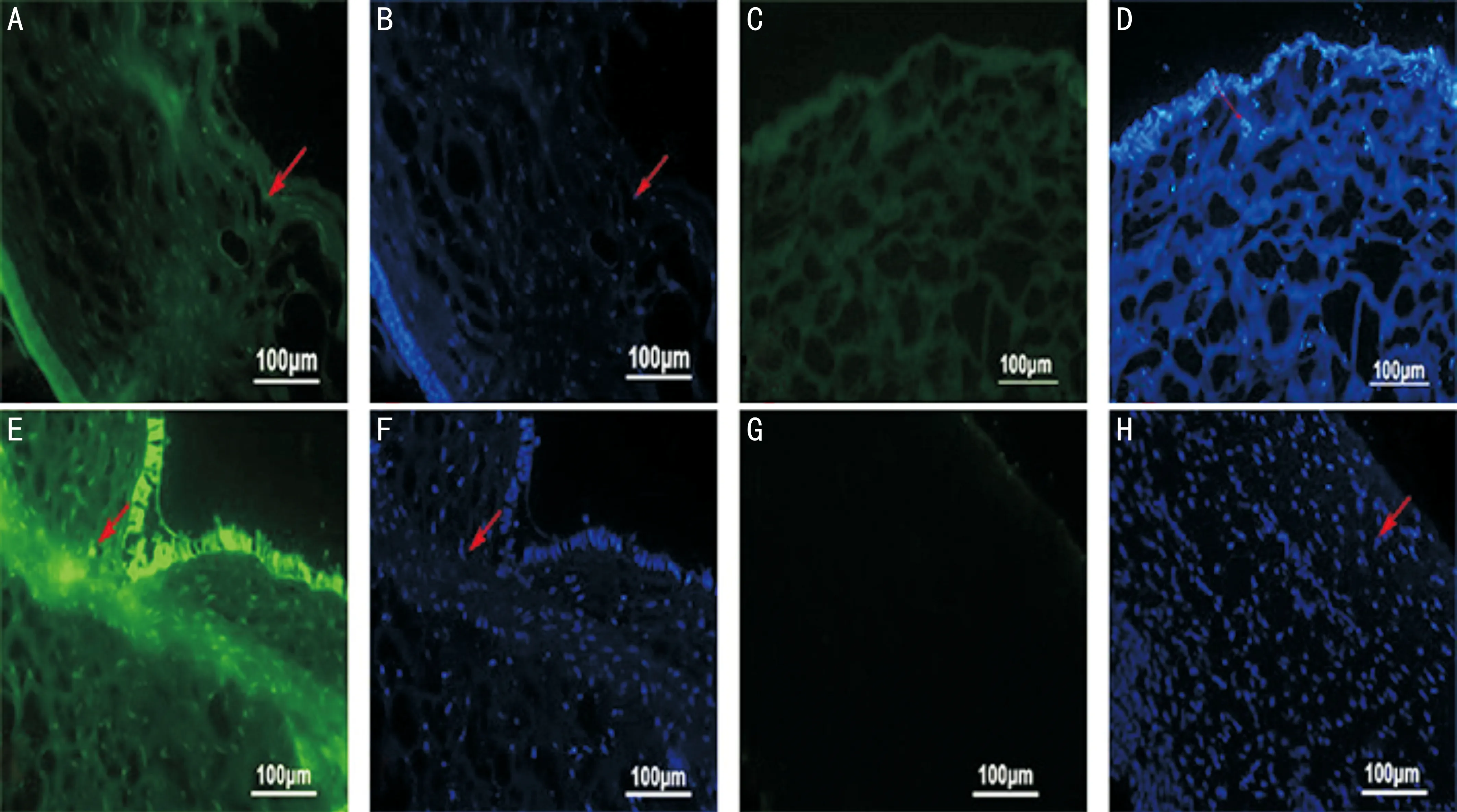
图5 冰冻切片(×100)A:实验组转染后1wk,荧光显微镜下见角膜组织中有绿色荧光(箭头示);B:DAPI染细胞核(箭头示);C:对照组转染后1wk,荧光显微镜下角膜组织中未见绿色荧光;D:DAPI染细胞核(箭头示);E:实验组转染后1mo,荧光显微镜下见角膜组织中有绿色荧光(箭头示);F:DAPI染细胞核(箭头示);G:对照组转染后1mo,荧光显微镜下角膜组织中未见绿色荧光;H:DAPI染细胞核(箭头示)。

图6 角膜HE染色 A:实验组转染后1wk HE染色,图中箭头所示角膜上皮细胞增生、水肿,炎性细胞浸润(×100);B:实验组转染后1wk HE染色,图中箭头所示角膜上皮细胞增生、水肿,炎性细胞浸润(×200);C:实验组转染后1mo HE染色,图中箭头所示角膜上皮增生减弱,炎性细胞减少(×100);D:实验组转染后1mo HE染色,图中箭头所示角膜上皮增生减弱,炎性细胞减少(×200);E:对照组转染后1wk HE染色,图中箭头所示未见角膜明显变化(×100);F:对照组转染后1wk HE染色,图中箭头所示未见角膜明显变化(×200);G:对照组转染后1mo HE染色,图中箭头所示未见角膜明显变化(×100);H:对照组转染后1mo HE染色,图中箭头所示未见角膜明显变化(×200)。
3 讨论
角膜疾病是继白内障后第二大严重影响人类生活质量的疾病,而目前唯一有效方法是角膜移植,但角膜植片匮乏,因此角膜组织工程日益发展。角膜移植主要分为穿透性角膜移植、板层角膜移植等,板层角膜移植术的成功率较穿透性角膜移植术高,主要是因为在3层含细胞的角膜组织中角膜基质的免疫原性最低[9];王智崇等[10]通过体液免疫、细胞免疫对角膜3层含细胞的组织进行免疫原性的相对量化分析,认为角膜基质有进行异种移植的免疫基础。CSCs是角膜基质层中的主要细胞,也是角膜组织工程三大种子细胞之一,能分泌合成多种细胞外基质(extracellular matrix,ECM)及蛋白,与角膜基质层纤维的排列、角膜透明度及瘢痕的形成密切相关[4-6],但CSCs体外培养,如:高浓度血清、生长因子及外伤等条件下易转为成纤维细胞及肌成纤维细胞[11-13],如何维持CSCs的表型也是目前研究的难点。本次实验中体外行CSCs的移植,为判断移植进入角膜内的细胞是否存活及存活的时间,需要对移植进去的CSCs进行标记,以方便与新西兰大白兔原有的CSCs区分。GFP是来源于水母体内的能发光的绿色荧光蛋白,1962年首次由Shimomura等[14]从多母水管(aequorea victoria)中分离得到。由于GFP发出的绿色荧光灵敏度高、检测方便,且荧光稳定,能耐受高温,甲醛固定、石蜡包埋等处理都不会影响其荧光性质[15],因此目前越来越多的使用于标记细胞以及体内细胞追踪。GFP标记细胞需要载体,常见的病毒载体有慢病毒、腺病毒(adenovirus)、腺相关病毒(adeno-associated virus,AAV)等[16-17]。慢病毒是一种逆转录病毒,能同时转染分裂或非分裂的细胞、安全性能高、能长期表达,并且能发生相对免疫赦免即免疫反应小[18-19],慢病毒的这些特点使得其在眼科研究中的使用较为广泛,不会导致、引发眼内炎症[20-21]。综上考虑,本次实验中为标记兔CSCs,选择LV-EGFP标记。有研究示,新西兰大白兔眼角膜是与人类角膜指标最为相近,是角膜动物模型的合适选择[22]。尽管兔眼角膜与人眼角膜指标相似最多,但兔眼角膜厚度仍与人眼角膜厚度相隔较远,大约在350~400μm[23],体外行兔CSCs角膜基质注射时易刺进前房中,本实验中,注射进入基质层后肉眼可见角膜由透明变为灰白色混浊,术后1d裂隙灯下见角膜已恢复透明。实验中1wk及1mo实验结果表明注射进入的CSCs仍有活力;LV-EGFP标记的兔CSCs在角膜中可以存活1mo,且与邻近组织的炎症反应较轻,组织相容性好。
本次实验目的是探讨兔CSCs异体移植能否在角膜中存活及存活的时间,为后期角膜组织工程的细胞移植奠定基础,争取早日解决人工角膜缺乏生物活性等问题。实验组与对照组冰冻切片的差异能说明兔CSCs在角膜中可以存活至1mo,但不足之处是实验周期较短,样本量不够大,后期应增大样本量,延长观察时间。总之,本实验为体外移植LV-EGFP修饰的兔CSCs奠定了初步的实验基础,但移植后兔CSCs的功能及其转化还需进一步的研究。
- 国际眼科杂志的其它文章
- Effect of GSH and niacin combination on protein oxidation,ER stress,glycation and aggregation in HLE cells under high glucose condition
- Evaluation of cerebral visual functions in low myopic adolescents
- 模拟失重对成年小鼠闪光视网膜电图和视网膜微循环的影响
- 沉默SIAH1基因对H2O2诱导的人晶状体上皮细胞凋亡的影响
- 杞菊地黄丸治疗干眼症有效性及安全性的Meta分析
- OCTA在不同中医证型POAG患者视觉损害评价中的应用

