Hg2+和Pb2+对中国鲎N-乙酰-β-D-氨基葡萄糖苷酶的影响
林建城,罗新明,林娟娟
1. 莆田学院环境与生物工程学院,莆田 351100 2. 福建省新型污染物生态毒理效应与控制重点实验室(莆田学院),莆田 351100
根据几丁质酶作用机理不同,现认为至少包含有内切几丁质酶、外切几丁质酶和具外切酶性质的N-乙酰-β-D-氨基葡萄糖苷酶(EC3.2.1.52,NAGase)等3种组分[1]。近年来,NAGase在节肢动物中的生理作用被广泛关注。Koga等[2]从家蚕(Bombyxmori)的表皮层中获得NAGase,研究发现,蚕表皮NAGase与其周期性的蜕皮生理以及与生活周期中蛹的形成密切相关;随后,Buchholz[3]研究了南极磷虾(Euphausiasuperba)的蜕皮生理与NAGase活力变化的相关性,发现在南极磷虾蜕皮前短时间内NAGase大量合成,酶活力迅速提高,用于降解虾几丁质表皮;而Zou和Fingerman[4]的研究表明,招潮蟹(Ucapugilator)表皮和肝胰腺中NAGase的合成受类固醇蜕皮激素调控,NAGase活力变化与其周期性蜕皮之间存在密切相关。同样,朴顺金等[5]研究了不同养殖期凡纳滨对虾(Litopenaeusvannamei)外壳膜NAGase的性质,发现在虾幼体和生殖期时,由于蜕壳频繁,虾外壳膜NAGase比活力会迅速升高,从而进一步阐述了NAGase在节肢动物周期性蜕皮中的生理功能。
中国鲎(Tachypleustridentatus)属于节肢动物门肢口纲剑尾目,已成为了濒危物种,是国家二级保护动物,人类过度捕杀是导致其数量剧减的主要原因,另一个原因是工业生产产生的一些重金属由于过量排放严重破坏了海水系统,鲎赖以生存的海域环境受到严重污染,扰乱了鲎的正常生理活动与物质代谢。梁君荣等[6]的研究表明,Zn、Pb、Cu和Cd等重金属对中国鲎的胚胎发育有不同的影响,当这些重金属离子的浓度超过渔业水域水质标准浓度8倍时,Cd2+和Cu2+对鲎的胚胎发育无明显影响,但Zn2+和Pb2+会使鲎胚胎发育中卵径变小,发育速度下降,对鲎胚胎发育的毒性从大到小为Pb2+>Zn2+>Cu2+≈Cd2+。此后,研究发现,金属离子对节肢动物特别是甲壳动物几丁质酶的生理生化有重要影响。张伟妮等[7]的研究表明,Ag+、Pb2+、Zn2+和Hg2+等4种重金属离子对克氏原螯虾(Procambarusclarkii) NAGase酶活力均有不同程度的可逆抑制作用,其中Ag+和Pb2+对酶还有先激活后抑制的作用;还有研究发现,Zn2+对锯缘青蟹内脏(Scyllaserrata)[8]NAGase会产生可逆抑制作用,Zn2+的存在会降低酶的温度稳定性;而Hg2+对凡钠对虾(Penaeusvannamei)[9]内脏NAGase又有较强的不可逆的抑制作用。这说明环境中的金属离子对节肢动物中与蜕皮生理相关的几丁质酶产生重要影响。在中国鲎的胚胎发育到性成熟期间,至少需经19次蜕皮,鲎的蜕皮生理直接关系到鲎的正常生长与发育。Hg2+和Pb2+是环境中重金属离子污染物的重要组成份,直接影响到水生动物的生理代谢并引起慢性毒性效应[10-11],但它们对中国鲎几丁质酶的影响,目前还未有深入研究。笔者课题组之前已对中国鲎内脏NAGase进行了分离纯化[12],现继续探讨Hg2+和Pb2+这2种重金属离子对中国鲎NAGase的影响,研究中国鲎NAGase酶活力、构象变化和效应物之间的相关性,这对揭示海洋污染物与鲎蜕皮生理之间的相关性具有重要作用,并为能更好地保护鲎资源和合理开发利用鲎资源提供一些科学依据。
1 材料与方法(Materials and methods)
1.1 材料
参照文献[12]所述方法分离纯化中国鲎内脏NAGase,分别通过抽提、30%和80%的饱和硫酸铵分级分离、Sephadex G-200凝胶层析以及DEAE-32离子交换层析分离,纯化后获得聚丙烯酰胺凝胶电泳(PAGE)单一纯的酶制剂,比活力为505.21 U·mg-1,酶制剂在4 ℃下经过双蒸馏水透析后,用于Hg2+和Pb2+对NAGase影响的研究。
NAGase催化的底物对硝基苯-N-乙酰-β-D-氨基葡萄糖苷(pNP-β-D-GlcNAc),分析纯,由上海医药工业研究院生化室合成;Sephadex G-200是Pharmacia产品;纤维素DEAE-32是Whatman产品;硝基酚(pNP)、HgCl2和Pb(NO3)2等试剂均为分析纯,均为上海国药集团化学试剂有限公司产品。
1.2 方法
1.2.1 中国鲎NAGase活力测定
按文献[12]中NAGase活力的检测方法测定中国鲎NAGase活力。在2 mL的酶活测定体系中,包含1 mL 75 mmol·L-1HAC-NaAC缓冲液(pH 5.4),0.2 mL 5 mmol·L-1的底物pNP-β-D-GlcNAc,0.78 mL的双蒸馏水,20 μL酶液。在37 ℃下反应10 min,以2 mL 0.5 mol·L-1NaOH终止反应,测定A405 nm,以先加2 mL 0.5 mol·L-1NaOH、后加20 μL酶液为空白对照。以产物硝基酚(pNP)为标准物,制定标准曲线。1个酶活力单位(U)定义为:在上述条件下,每分钟催化水解产生1 μmol·L-1pNP所需的酶量规定为1 U,酶催化活力大小以酶促反应速度(v)大小表示。
1.2.2 Hg2+和Pb2+对中国鲎NAGase活力的影响
在NAGase活力的测定体系中,在0~200 μmol·L-1范围内加入不同浓度的HgCl2,测定加入HgCl2后NAGase的剩余酶活力;以同样的方法,在0~50 mmol·L-1范围内加入不同浓度的Pb(NO3)2,测定加入Pb(NO3)2后NAGase的剩余酶活力。以未添加金属离子的对照组酶活力为100%,其他各试验组以相对酶活力(%)表示。
1.2.3 Hg2+和Pb2+对中国鲎NAGase的抑制作用机理
在2 mL NAGase活力的测定体系中,底物pNP-β-D-GlcNAc浓度为5 mmol·L-1,改变NAGase浓度(1.7、3.4、5.1、6.8和8.5 μg·mL-1),分别测定在0、10、20、30和40 μmol·L-1等5种不同浓度HgCl2作用下NAGase的催化活力;同样测定在0、15、20、25和30 mmol·L-1等5种不同浓度Pb(NO3)2作用下NAGase的催化活力,并设立各自对照组,以酶浓度对酶活力作图,分别判断Hg2+和Pb2+对中国鲎NAGase的抑制作用机理。
1.2.4 Hg2+和Pb2+对中国鲎NAGase的抑制作用类型
在NAGase活力的测定体系中,改变pNP-β-D-GlcNAc底物浓度(0.15、0.20、0.25、0.33和0.50 mmol·L-1),分别测定在0、10、20、30和40 μmol·L-1等5种不同浓度HgCl2作用下NAGase的催化活力;同样分别测定在0、15、20、25和30 mmol·L-1等5种不同浓度Pb(NO3)2作用下的NAGase催化活力。以Lineweaver-Burk双倒数作图,确定中国鲎NAGase的米氏常数Km和最大反应速度Vm以及在HgCl2和Pb(NO3)2作用下的表观米氏常数Kmapp和最大反应速度Vmapp,分别判断HgCl2和Pb(NO3)2对NAGase抑制作用的类型,并求解各自抑制常数KI。
1.2.5 Hg2+和Pb2+对中国鲎NAGase荧光发射光谱的影响
Hg2+对中国鲎NAGase荧光发射光谱影响的测定,采用的NAGase浓度为5.72 μg·mL-1,HgCl2浓度分别为0、10、20、30和40 μmol·L-1;而Pb2+对NAGase荧光发射光谱影响的测定,采用的NAGase浓度为8.59 μg·mL-1,Pb(NO3)2浓度分别为0、50、75、100、200、400和500 μmol·L-1,酶在2 mL 37.5 mmol·L-1HAC-NaAC缓冲液(pH 5.4)中分别与不同浓度的HgCl2和Pb(NO3)2混合,静置30 min(37 ℃),后用美国Cary Eclipse荧光分光光度计扫描,在内源荧光激发光谱波长为232.2 nm的条件下,测定NAGase的内源荧光发射光谱。
2 结果(Results)
2.1 Hg2+和Pb2+对中国鲎NAGase活力的影响
由图1可知,Hg2+和Pb2+对中国鲎NAGase活性均有不同程度的抑制作用,抑制作用均呈浓度效应,Hg2+比Pb2+对NAGase的抑制作用强,200 μmol·L-1Hg2+可抑制酶活力97.0%,而30 mmol·L-1Pb2+可使酶活力下降53.6%。这说明Hg2+和Pb2+这2种重金属离子对中国鲎NAGase均有明显抑制作用,Hg2+对NAGase的抑制作用强于Pb2+。
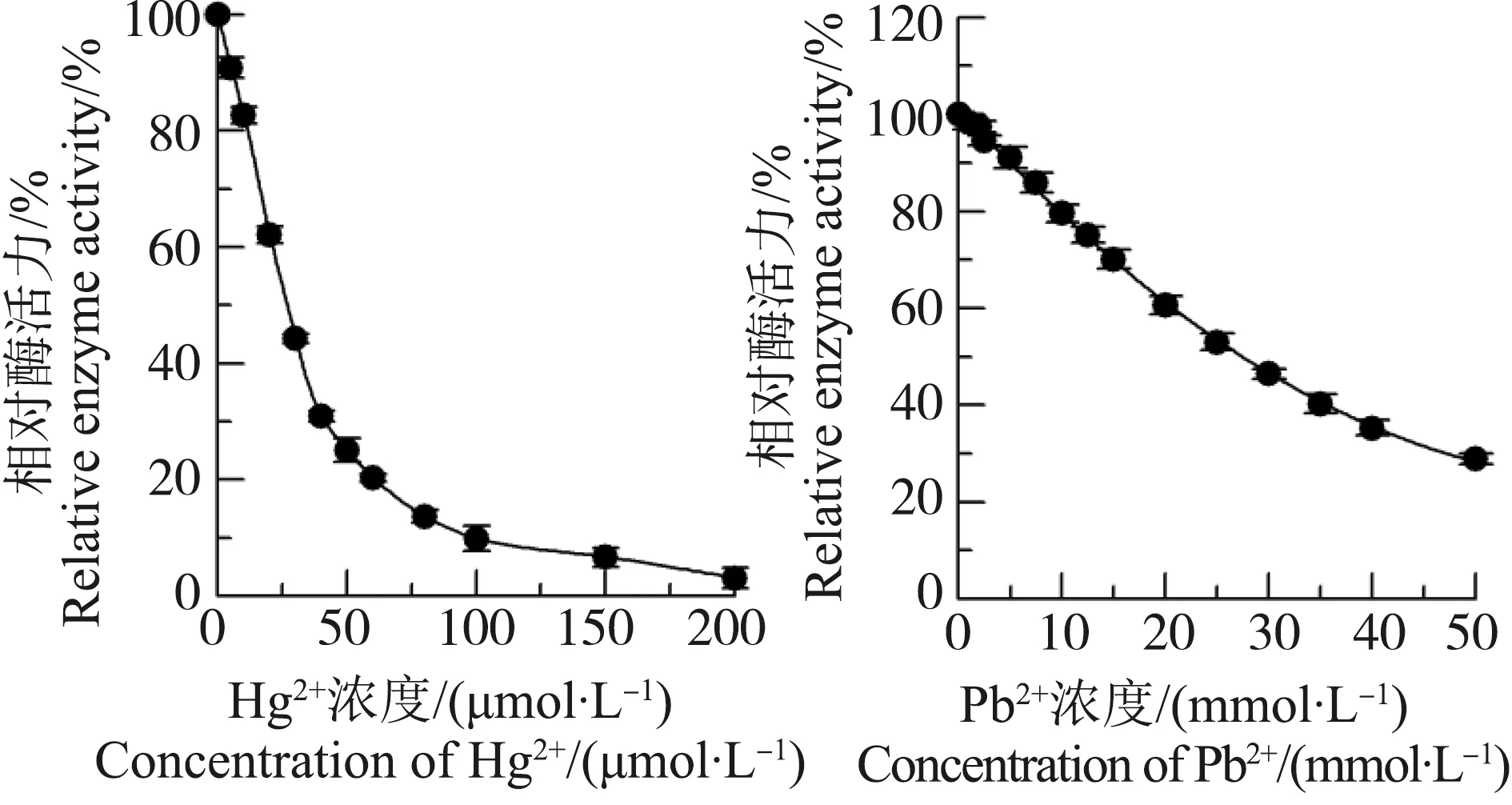
图1 Hg2+和Pb2+对中国鲎NAGase活力的影响Fig. 1 Effects of Hg2+ and Pb2+ on the activity of NAGase from Tachypleus tridentatus
2.2 Hg2+和Pb2+对中国鲎NAGase的抑制作用机理
在5个不同酶浓度下,研究了Hg2+对中国鲎NAGase的影响效应,结果如图2所示,以NAGase催化反应速度(v)对酶浓度作图,得到一组通过原点的直线,随Hg2+浓度逐渐升高,各直线斜率不断降低,说明Hg2+对NAGase的抑制作用是属于可逆抑制作用。同样,研究了Pb2+对中国鲎NAGase的影响效应,以加入Pb2+后NAGas催化反应速度(v)对酶浓度作图(图3),也得到一组通过原点的直线,随Pb2+浓度升高,各直线的斜率也在降低,说明Pb2+对中国鲎NAGase的抑制作用也是一个可逆过程,属于可逆抑制作用。结果表明,Hg2+和Pb2+都是通过抑制NAGase活力而降低酶的催化效率,不是通过降低反应体系中的有效酶量而使酶活力降低的[13]。
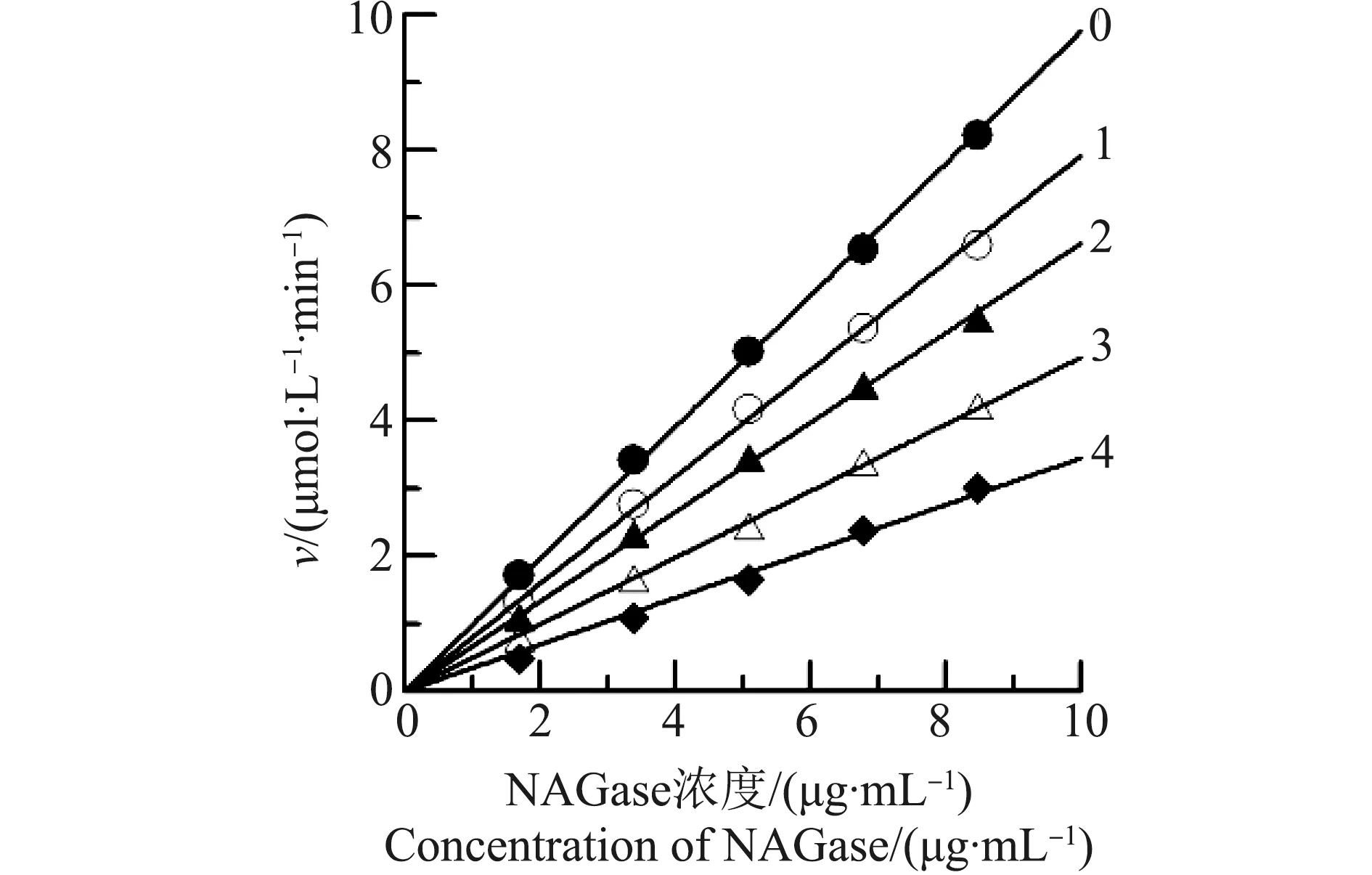
图2 Hg2+对中国鲎NAGase抑制机理的判断注:v为酶促反应速度;直线0~4,Hg2+浓度分别为0、10、20、30和40 μmol·L-1。Fig. 2 Determination of the inhibitory mechanism of Hg2+ on NAGase from Tachypleus tridentatusNote: v is the rate of reaction; Concentrations of Hg2+ for curves 0~4 were 0, 10, 20, 30 and 40 μmol·L-1, respectively.
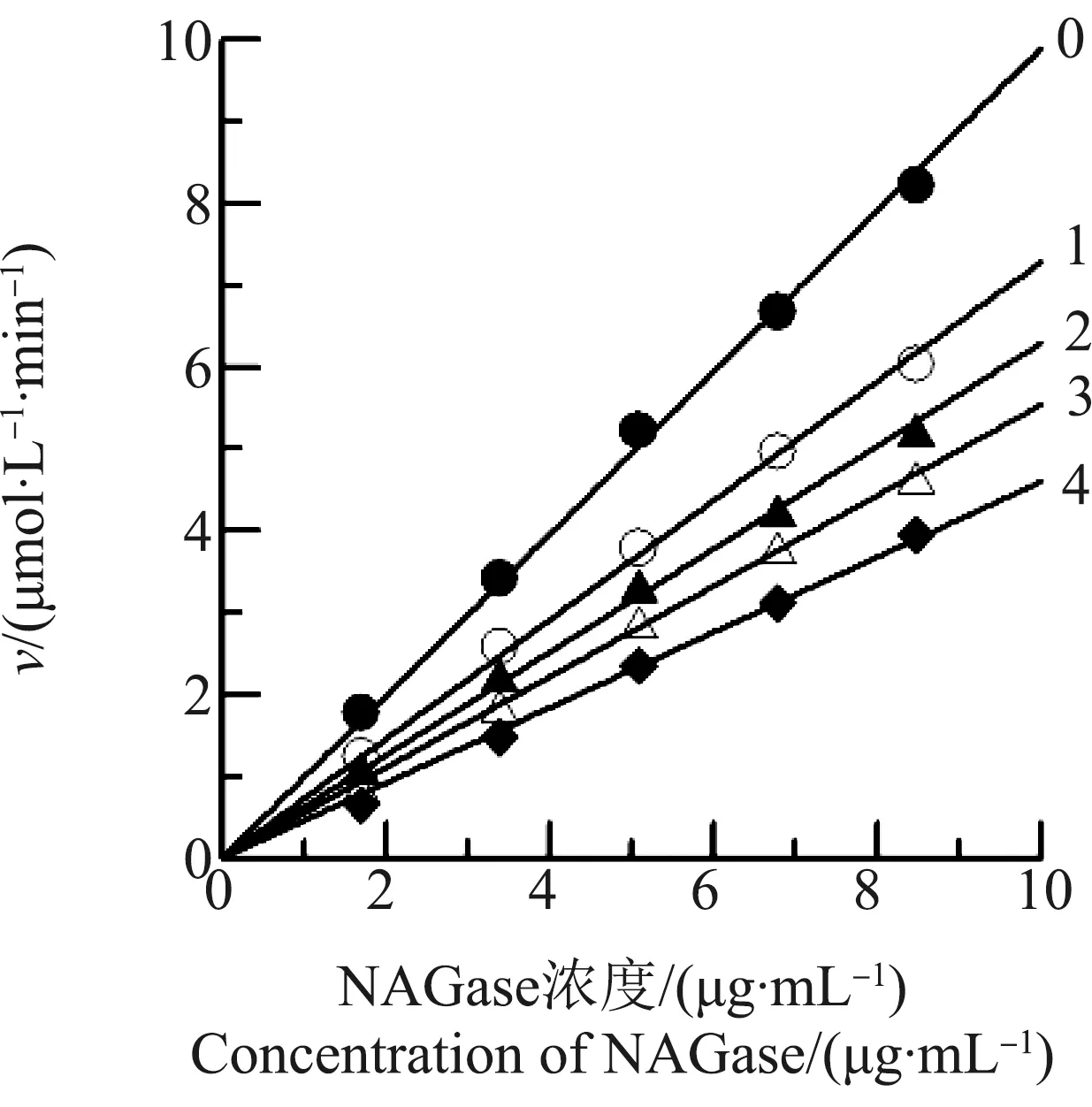
图3 Pb2+对中国鲎NAGase抑制机理的判断注:直线0~4,Pb2+浓度分别为0、15、20、25和30 mmol·L-1。Fig. 3 Determination of the inhibitory mechanism of Pb2+ on NAGase from Tachypleus tridentatus Note: Concentrations of Pb2+ for curves 0~4 were 0, 15, 20, 25 and 30 mmol·L-1, respectively.
2.3 Hg2+和Pb2+对中国鲎NAGase的抑制作用类型
通过Lineweaver-Burk双倒数作图判断Hg2+对中国鲎NAGase的抑制类型,结果(图4a)表明,随着Hg2+浓度增大,相应的5条直线的斜率也逐渐增大,这5条直线交于y轴上的一点,Hg2+对酶的抑制并不改变酶促反应的最大反应速度(Vm),Kmapp值随着Hg2+浓度的增大而增大,说明Hg2+对NAGase的抑制是属于竞争性抑制作用。Hg2+与底物之间竞争地与NAGase活性中心结合,从而影响了NAGase与底物的亲和力,Hg2+只与游离酶(E)结合,而不与酶-底物络合物(ES)结合。以图4a各直线斜率对相应的Hg2+浓度作图(图4b),得到一条直线,直线方程为y=1.323×10-3x+0.030,从直线方程可以求得Hg2+对中国鲎NAGase的抑制常数KI为22.68 μmol·L-1。
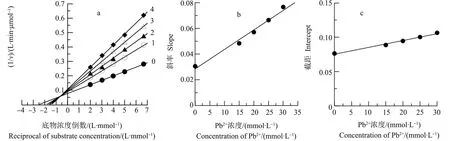
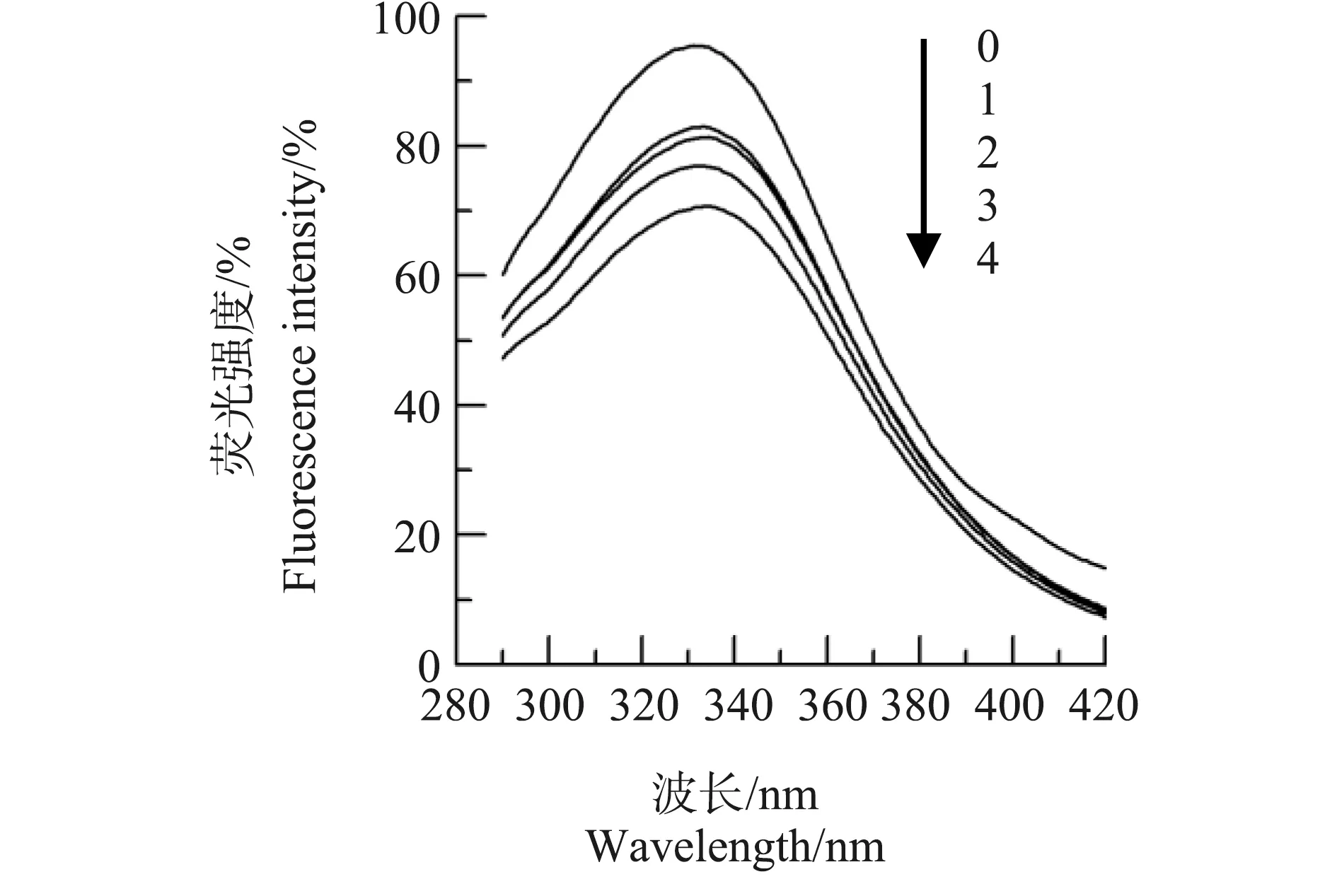
同样,研究了Pb2+对中国鲎NAGase的抑制类型,Lineweaver-Burk双倒数作图(图5a),结果显示,5条直线在第二象限相交于一点,各直线在横轴的截距和在纵轴的截距都随Pb2+浓度的变化而变化,随着Pb2+浓度的增大,NAGase相应的Kmapp值增大,而相应的Vmapp值下降。以图5a各直线斜率对Pb2+浓度进行二次作图(图5b),得到一直线,直线方程为y=1.516×10-3x+0.029,求出Pb2+对酶的抑制常数(KI)为19.13 mmol·L-1,即竞争性抑制常数;再以图5a各直线在纵轴的截距对Pb2+浓度作图(图5c),得到一直线,直线方程为y=0.997×10-3x+0.075,求出Pb2+对ES的抑制常数(KIS)为75.23 mmol·L-1,即非竞争性抑制常数KIS为75.23 mmol·L-1,KI 图4 Hg2+对中国鲎肠道NAGase抑制作用的Lineweaver-Burk关系图注:直线0~4,Hg2+浓度分别为0、10、20、30和40 μmol·L-1。Fig. 4 Lineweaver-Burk plots for inhibitory effect of Hg2+ on the activity of NAGase from Tachypleus tridentatus Note: Concentrations of Hg2+ for curves 0~4 were 0, 10, 20, 30 and 40 μmol·L-1, respectively. 图5 Pb2+对中国鲎肠道NAGase抑制作用的Lineweaver-Burk关系图注:直线0~4,Pb2+浓度分别为0、15、20、25和30 mmol·L-1。Fig. 5 Lineweaver-Burk plots for inhibitory effect of Pb2+ on the activity of NAGase from Tachypleus tridentatusNote: Concentrations of Pb2+ for curves 0~4 were 0, 15, 20, 25 and 30 mmol·L-1, respectively. 目前,研究蛋白质溶液构象的主要方法包括紫外吸收光谱、荧光光谱、圆二色谱和核磁共振等[13]。本研究是通过测定酶的荧光光谱变化来判断酶蛋白的空间构象的变化。由图6可知,天然酶NAGase的荧光发射峰在332 nm处,加入效应物Hg2+后,酶蛋白的荧光强度发生了变化,随着Hg2+浓度增大,酶的荧光强度逐渐下降,但酶的荧光发射峰没有位移,荧光发射峰的波长基本不变。酶的荧光强度发生变化表明了相应的酶蛋白的空间构象发生了变化,说明Hg2+对中国鲎NAGase的抑制作用是通过改变酶的空间构象所致。 进一步研究了Pb2+对中国鲎NAGase内源荧光发射光谱的影响,由图7可知,因为试验采用的酶浓度与Hg2+试验组不同,获得的荧光发射强度也有差异。结果表明,随着效应物Pb2+浓度增大,NAGase的荧光强度逐渐下降,当Pb2+浓度为500 μmol·L-1时酶的荧光消失,但酶的荧光发射峰始终没有产生位移。这说明Pb2+与中国鲎NAGase分子的结合致使酶蛋白空间构象产生变化,酶活力下降,酶荧光发射强度随之改变。 图6 中国鲎NAGase在HgCl2中的内源荧光发射光谱注:曲线0~4,Hg2+浓度分别为0、10、20、30和40 μmol·L-1。Fig. 6 Fluorescence emission spectra of NAGase from Tachypleus tridentatus in HgCl2 solutionNote: Concentrations of 0, 10, 20, 30 and 40 μmol·L-1 for curves 0~4, respectively. 图7 中国鲎NAGase在Pb(NO3)2中的内源荧光发射光谱注:曲线0~6,Pb(NO3)2浓度分别为0、50、75、100、200、400和500 μmol·L-1。Fig. 7 Fluorescence emission spectra of NAGase from Tachypleus tridentatus in Pb(NO3)2 solutionNote: Concentrations of 0, 50, 75, 100, 200, 400 and 500 μmol·L-1 for curves 0~6, respectively. 重金属离子对酶经常呈现抑制现象,但不同重金属离子对NAGase的抑制机理和抑制类型不同。杨学敏等[14]的研究表明:Fe3+和Cd2+对锯缘青蟹内脏NAGase的抑制均呈竞争性-反竞争性混合Ⅱ型效应。而Zn2+对锯缘青蟹NAGase则呈现可逆的混合型抑制作用,结果显示,Zn2+与游离酶(E)的亲和力比Zn2+与酶-底物络合物(ES)的亲和力强,在Zn2+作用下NAGase的荧光发射强度降低,说明Zn2+是通过改变酶蛋白空间构象变化致使酶活力下降[8];但ZnSO4对尼罗罗非鱼(Oreochromisniloticus)[15]精巢NAGase表现为竞争性的抑制作用。王君等[16]的研究表明,Cu2+对棉铃虫(Helicoverpaarmigera)蛹NAGase的抑制作用是一种可逆的混合型抑制;而CuSO4对尼罗罗非鱼精巢NAGase的抑制则为非竞争性抑制作用[15],同时,在CuSO4作用下酶的荧光发射峰值呈降低现象。此外,Ag+对克氏原螯虾内脏NAGase的抑制作用又表现为反竞争性抑制[7];而镉离子对尼罗罗非鱼精巢NAGase的抑制为竞争性抑制作用[17]。 Hg2+对酶往往有较强的抑制作用,其对不同性质的酶或对不同来源的酶作用机理同样存在差异。蔡西玲等[18]研究了Hg2+对木瓜蛋白酶的抑制机理,结果表明,当CHg2+≤10-6mol·L-1时,对酶表现为非竞争性不可逆激活作用,但当CHg2+≥10-4mol·L-1时,对酶的抑制作用呈现以竞争性抑制为主,Hg2+可与酪蛋白竞争性地与木瓜蛋白酶的活性中心结合,导致对酶的抑制,同时Hg2+结合后木瓜蛋白酶的荧光猝灭,荧光发射峰发生红移,表明Hg2+与酶蛋白之间存在相互作用,发生了能量转移,Hg2+可能导致木瓜蛋白酶分子的微环境疏水性有所降低,从而引起酶活力的下降。而耿芳宋等[19]的研究表明,Hg2+是人胎盘耐热性碱性磷酸酶的混合性抑制剂,并使酶的构象发生改变,当CHgCl2>1.00 mmol·L-1时,荧光强度不断下降,但峰位不变。此外,Hg2+对锯缘青蟹内脏NAGase的抑制表现为可逆的竞争性抑制作用[20],但对尼罗罗非鱼精巢NAGase又表现为不可逆抑制作用[21]。已有研究还发现,Hg2+对凡纳对虾内脏NAGase的不可逆抑制作用,可能是Hg2+与酶蛋白的巯基结合从而引起酶的空间结构变化,导致酶失活,而且底物还具有保护Hg2+所引起的酶失活作用[9]。本研究结果表明,Hg2+对中国鲎NAGase抑制作用表现为可逆的竞争性抑制,在Hg2+作用下NAGase荧光强度降低,但酶的内源荧光发射峰没有位移,说明Hg2+对NAGase催化活力的抑制是酶的空间构象发生变化所致,Hg2+可能也是与中国鲎NAGase酶蛋白的巯基产生鳌合作用而引起空间构象的变化。 Pb2+对酶的抑制机理目前研究的还不多。有研究表明,Pb(NO3)2是人胎盘耐热性碱性磷酸酶的反竞争性抑制剂,在不同浓度Pb(NO3)2的作用下,碱性磷酸酶的荧光强度和发射峰位均发生了变化,当Pb(NO3)2浓度为10.0 mmol·L-1时,酶活力丧失,荧光猝灭[19];而Pb2+对克氏原螯虾内脏NAGase的抑制又表现为非竞争性抑制[7]。从本研究结果可知,Pb2+对中国鲎内脏NAGase的抑制是一个可逆的过程,属于竞争性-非竞争性混合型抑制作用,比较了抑制常数KIS和KI值大小,发现Pb2+在游离酶和络合物之间,更易于与游离酶结合而引起对酶的抑制作用。Pb2+可使得中国鲎NAGase的内源荧光发射强度改变,但没有产生峰值移位现象,当Pb(NO3)2浓度是0.5 mmol·L-1时,NAGase的内源荧光猝灭(图7),而这时酶活力才刚开始下降(图1),这种现象说明了Pb2+使酶蛋白空间构象发生变化要快于造成的酶活力的变化,维系酶空间构象稳定的必需基团对Pb2+相当敏感,这与张伟妮等[15]研究的CuSO4对尼罗罗非鱼精巢NAGase活力和构象的影响结果相似;但Zhang等[8]在Zn2+对锯缘青蟹NAGase抑制动力学的研究中,发现Zn2+作用后NAGase活力的变化快于酶空间构象的变化。同时,进一步推测Pb2+可能是与NAGase的必需基团巯基形成鳌合物,或可能是与酶活性中心的羧基结合,从而导致酶蛋白空间构象变化[19]。 综上所述:Hg2+和Pb2+对中国鲎NAGase的抑制作用均表现为可逆过程,其中Hg2+对NAGase的抑制属于竞争性抑制作用,Hg2+只与游离酶结合,不与酶-底物络合物结合;而Pb2+对NAGase的抑制是属于竞争性-非竞争性混合型抑制作用,相比于酶-底物络合物,Pb2+对游离酶的亲和力更强。Hg2+和Pb2+对中国鲎NAGase的抑制作用都是酶蛋白空间构象的变化所致。而Hg2+和Pb2+与NAGase酶蛋白功能基团之间的互作机制有待进一步探讨。 致谢:感谢莆田学院环境与生物工程学院林授锴博士和汪秀妹博士在英文摘要写作上给予的帮助。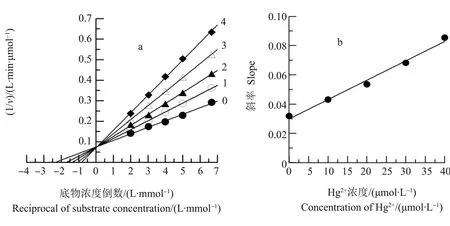
2.4 Hg2+和Pb2+对中国鲎NAGase内源荧光发射光谱的影响
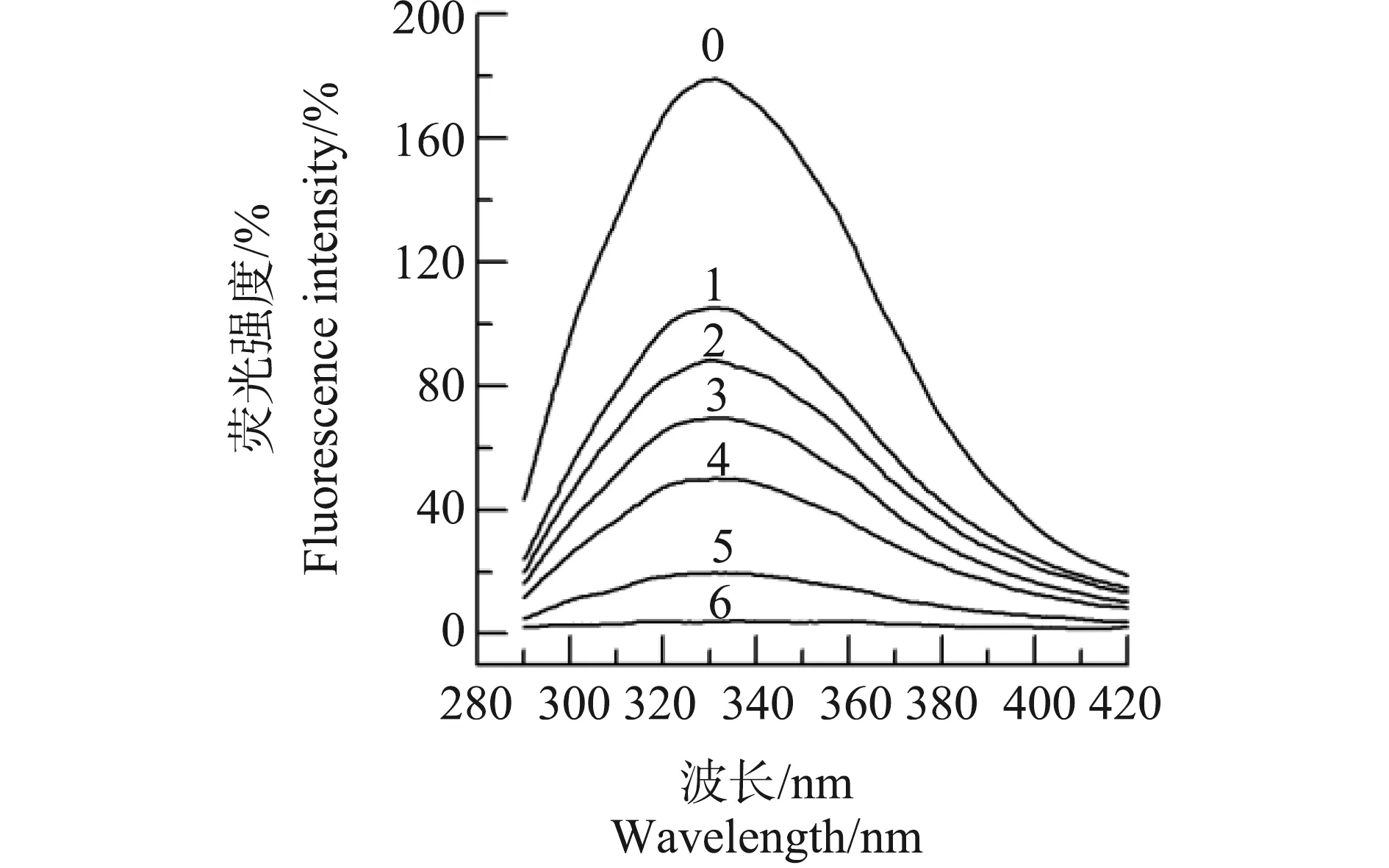
3 讨论(Discussion)