基于斑马鱼全生命周期毒性测试的研究进展
薛柯,许霞,薛银刚,,*,穆云松,刘菲,江晓栋,施昕澜,顾铭
1. 常州大学环境与安全工程学院,常州 213164 2. 江苏省环境保护水环境生物监测重点实验室,江苏省常州环境监测中心,常州 213001 3. 中国环境科学研究院,环境基准与风险评估国家重点实验室,北京 100012 4. 江苏理工学院化学与环境工程学院,常州 213001
斑马鱼(zebrafish,Daniorerio)是一种原产于印度和南亚河流的小型热带鱼[1],自1994年起作为一种全新的脊椎动物模型被学术界接受[2-3],它的器官、细胞类型、心血管系统、消化系统与哺乳动物相似[4-5]。另外,斑马鱼与人类的遗传和生理同源性显著[6],大约70%的人类基因至少有一个明显的斑马鱼直系同源物[7],神经系统组织和代谢与人类类似[8-9],生物学特性接近于人类生长全过程[10],它还有易于获得、价格低廉、容易饲养、符合“3R”原则、测试周期短并且在适当的光周期条件下能产出大量粘附性低、可浸泡、透明的鱼卵等优点[11-13],在生态毒理学和发育遗传学等领域中得到了广泛的研究[14],相对于小鼠、果蝇和线虫等模式生物,近年来斑马鱼的应用地位显著[15]。
斑马鱼的生命阶段主要包括胚胎(卵裂期、囊胚期、原肠胚期、分裂期、成形期和孵化期)、仔鱼和成鱼3个阶段,72 hpf(hour post fertilization, hpf)进入早期仔鱼阶段且主要器官发育完成,96 hpf时大多数器官发育完成,120 hpf时仔鱼发育完成[16-17]。生命周期试验主要分为2类:整个生命周期试验(full life cycle test)和部分生命周期试验(partial life cycle test)[18],毒性主要包括一般毒性(急性毒性、亚慢性毒性、慢性毒性、蓄积毒性和局部毒性等)和特殊毒性(致癌作用、致突变作用、生殖和发育毒性等)[19]。利用PubMed数据库,以zebrafish embryo, zebrafish larvae, zebrafish adult和zebrafish life cycle为限定条件,以toxicology为限定区域统计发现,近10年来,斑马鱼生命周期的毒理学研究所占比重不断上升并呈稳定增长的趋势(图1)。本文综述了斑马鱼全生命周期毒性的研究进展,为深入研究毒性物质对鱼类以及其他高等脊椎动物生长发育的影响提供一定的参考依据。
1 斑马鱼各生命阶段在毒理学中的研究进展(Research progress on partial life cycle test of zebrafish in toxicology)
1.1 斑马鱼胚胎在毒理学中的研究进展
1.1.1 急性毒性及发育毒性的研究进展
急性毒性是指机体(人或实验动物)一次或短期内(一般指24~96 h)多次接触外源化合物之后所引起的中毒效应,这种毒性效应可以反映在不同的组织水平上,并伴随着不同的症状,甚至死亡[19]。20世纪70年代,Laale[20]对斑马鱼胚胎在生态毒理学领域的应用进行了报道,后来Lange等[21]使用斑马鱼及其胚胎和RTG-2细胞进行毒性试验,结果证明,胚胎测试对毒性反应最敏感,并且认为胚胎毒性测试是替代鱼类急性毒性测试的最佳方法。
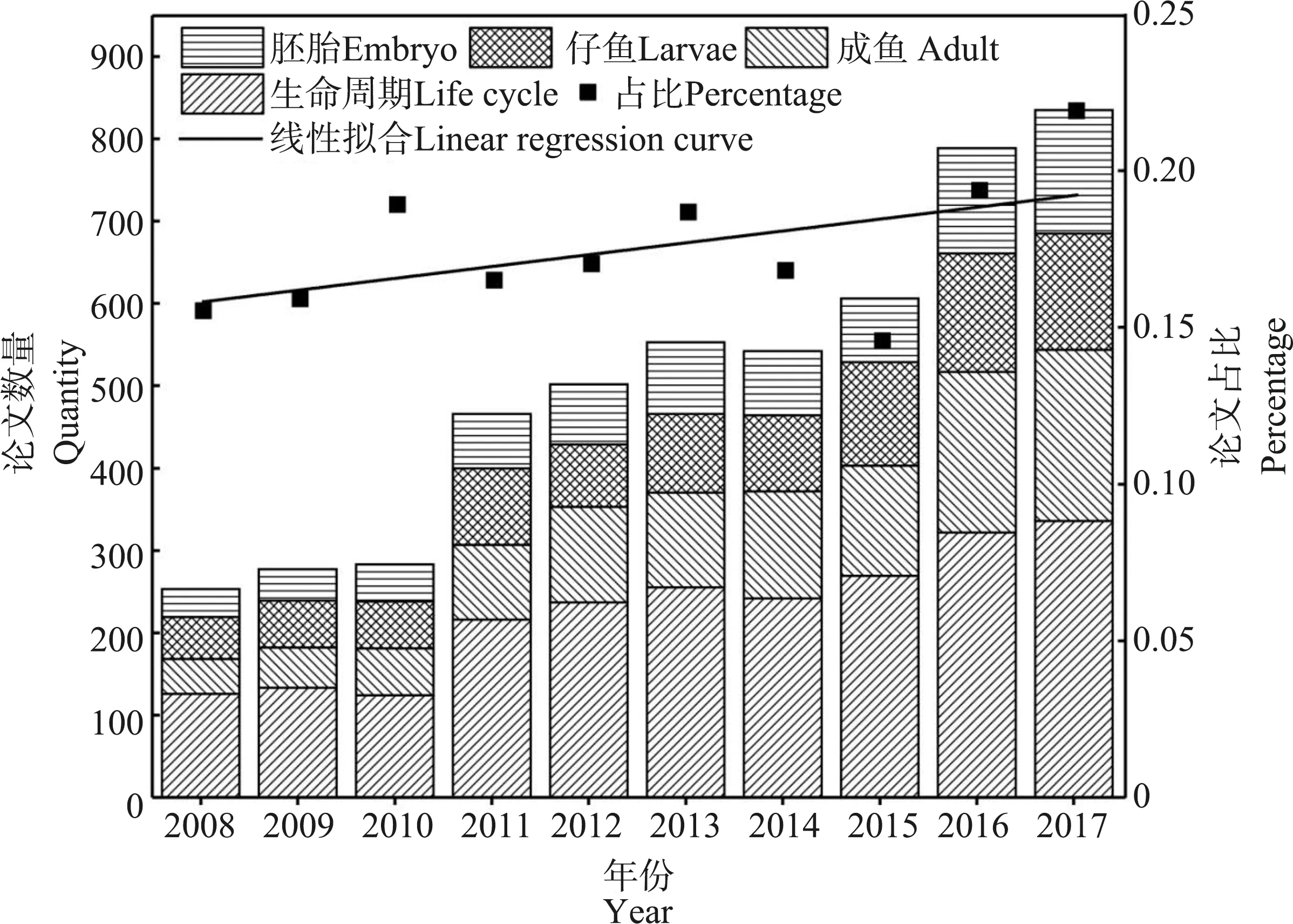
图1 斑马鱼生命周期相关的论文及占比Fig. 1 Statistical analysis of scientific papers related to zebrafish life cycle
2002年Nagel[22]进一步证明斑马鱼胚胎可以替代鱼类96 h的急性毒性试验,同年,德国率先使用斑马鱼胚胎48 h毒性试验(fish embryo toxicity, FET)代替鱼类急性毒性试验,自2005年以来,FET已成为德国全废水毒性试验(whole effluent test, WET)的重要组成部分[23]。在进行斑马鱼胚胎急性毒性测试的同时,也可以筛选发育不正常的胚胎作为致畸作用指标,相关研究人员总结斑马鱼胚胎形态学、亚致死等毒性终点(表1),如心跳变化、运动行为和孵化率等,这些终点丰富了毒性内容,且表明了化学物质可能存在的发育毒性和慢性毒性效应[24]。
1.1.2 内分泌干扰毒性的研究进展
内分泌干扰毒性的主要原因在于天然激素水平的失衡,而引起激素水平失衡的物质大多数来源于人类的生产和生活过程中产生和排放的污染物,由于这类物质具有与生物体内激素相同的活性,会影响生物内分泌系统的正常工作,因此称之为“环境内分泌干扰物(environmental endocrine disrupters, EEDs)”[25-26]。目前,大多数报道以特定的终点如性别分化或诱导卵黄蛋白原(vitellogenin, VTG)来研究对雌激素、雄激素和甲状腺受体起作用的EEDs的影响[27]。斑马鱼胚胎模型在内分泌干扰毒性研究中的应用是通过观察EEDs暴露对激素应答基因的影响进行检测筛选,VTG作为敏感型的分子生物标记物,已被广泛应用于斑马鱼胚胎模型中[28]。然而,在斑马鱼胚胎模型中尚未有雄激素和糖皮质激素的报道,对于这些终点的检测原则上可以通过转基因报告菌株分析其应答基因,但是现有的菌株,如pERE tata-Luc,只被成功地运用到仔鱼或成鱼阶段[29]。对内分泌干扰毒性的分析,特别是对不直接干扰受体调控基因(如性别分化),需要在仔鱼敏感的发展阶段进行。因此,斑马鱼胚胎可以作为简单的筛选工具,但在研究更复杂的激素调节过程中的应用尚待开发。
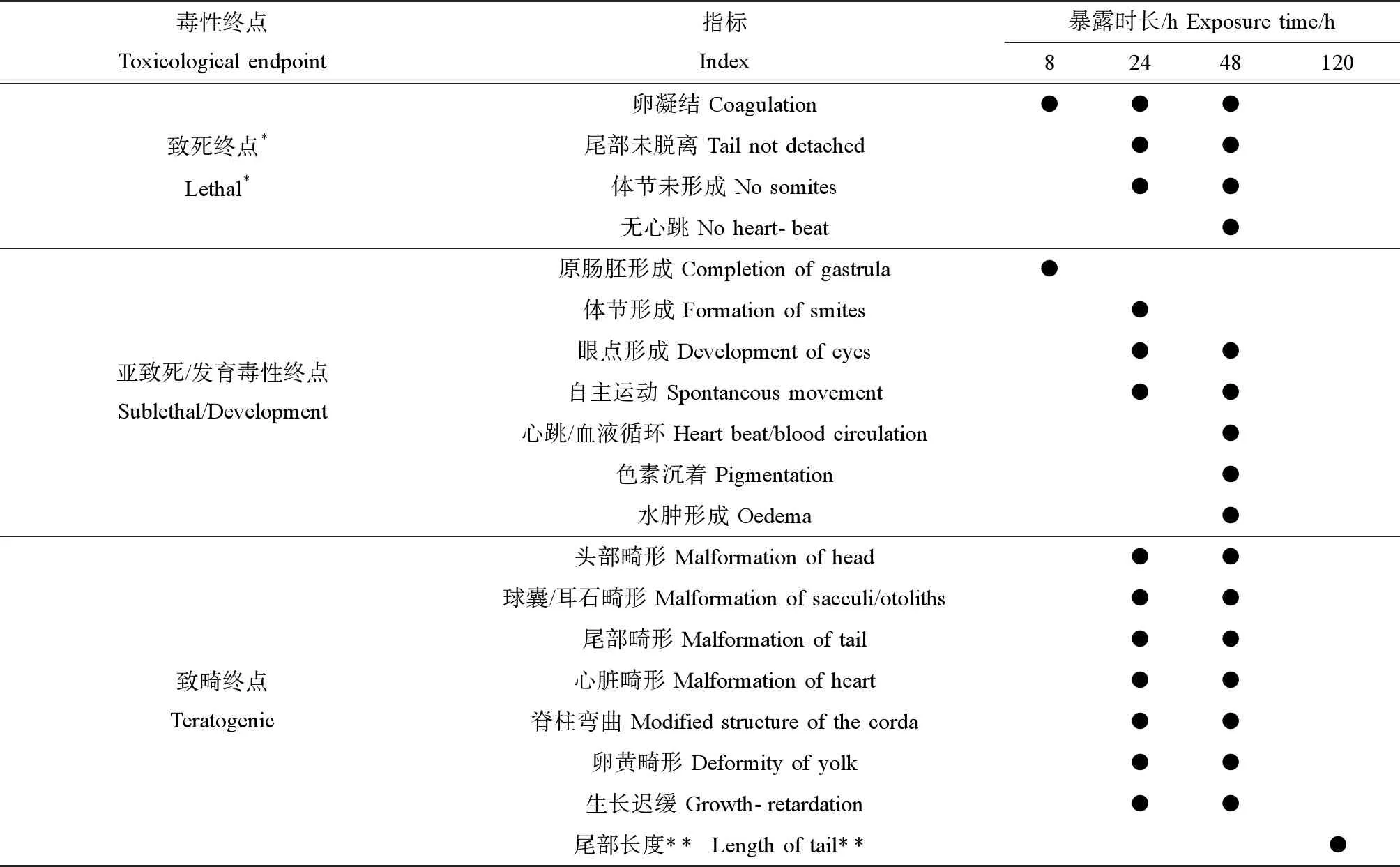
表1 斑马鱼胚胎急性毒性和致畸性的终点[22]Table 1 Lethal and sublethal endpoints for evaluating the acute toxicity and teratogenicity of chemicals on zebrafish embryos [22]
注:*在致畸毒性试验中,只有卵凝结判定为死亡;** 暴露48 h后将胚胎转移到没有试验化合物的水中;120 hpf仔鱼变直,可以精确地测量尾长。
Note: *Within the teratogenicity test for a better comparison with mammalian data only the endpoint "coagulated" is used as a lethal effect. ** In this case the eggs are transfered into water without the test compound after 48 h. After natural hatching the larvae is straightened and the tail length can be determined.
对斑马鱼胚胎的毒理研究还涉及神经毒性、遗传毒性和基因技术等领域[30]。MacRae和Peterson[31]还报道了斑马鱼及其胚胎在药物开发中的应用,并提出斑马鱼模型与传统药物开发方法的结合有助于平衡药物毒性和疗效。斑马鱼胚胎在毒理学研究中的前景主要是:(1)确定更合适的分子标记物作为毒性测试指标(如内分泌干扰毒性);(2)建立短期毒性测试(如急性毒性)和长期毒性测试(如慢性毒性和发育毒性)之间的关系;(3)斑马鱼胚胎模型的开发及应用可以为环境管理决策服务;(4)斑马鱼及其胚胎在医学领域的研究可以扩大其在毒理学的应用。
1.2 斑马鱼仔鱼及成鱼在毒理学中的研究进展
一般在完成孵化后48~72 h的斑马鱼可以自由运动并且能够自主取食,标志着正式进入了仔鱼期,斑马鱼仔鱼发育要持续数周,因此,目前针对仔鱼的毒性试验除短期暴露外,还有长期暴露试验。由于斑马鱼仔鱼具备自主游动能力,因此,一些工作以仔鱼行为作为评价指标,进行毒性试验。斑马鱼成鱼四月龄进入性成熟期,一般5~6月龄的斑马鱼开始被用于成鱼毒性试验中。由于斑马鱼成鱼体内的各种生理生化系统和内分泌系统己经发育完毕,所以能用于毒性评价的指标非常丰富,成年斑马鱼相比于胚胎和仔鱼,最大的优势在于可以取出处理后斑马鱼体内的不同器官,来具体评价污染物对不同器官或组织的影响[32]。斑马鱼相对于其他模式生物应用于毒性检测而言,节省了时间和人力成本,具有快速、简便和高效的优势,降低了人和生态系统面临的毒性风险,是一种应用潜力更大的环境污染应急预警方法,被国际标准化组织(International Organization for Standardization, ISO)、经济合作与发展组织(Organization for Economic Co-Operation and Development, OECD)和欧盟等组织认定为标准毒性测试生物(表2)。
野生型斑马鱼在毒理学中得到了广泛的应用,但这种方法仍有不足之处,如检测灵敏度度相对较低,实验过程及结果统计相对繁琐等。随着转基因技术的日益成熟,将具有特异性调控作用的基因导入斑马鱼体内,从而产生针对不同种类污染物可产生特异性表型的转基因斑马鱼,使针对不同污染物的分子生物标志物数据库不断扩展,为污染物环境监测与预警提供更多的数据支持[33],为环境样品中关键致毒物质筛查提供新的解决思路[34]。
目前,应用于环境监测的转基因斑马鱼主要有以下5种类型:芳香烃反应元件(aromatic hydrocarbon response element, AHRE)、亲电反应元件(electrophile response element, EPRE)、金属离子反应元件(metal response element, MRE)、雌激素反应元件(estrogen response element, ERE)和维甲酸和类维生素X反应元件(retinoic acid and retinoid X response elements, RAREs, RXREs)(表3)。随着科学技术手段的不断进步,将来会有更多的转基因(反应元件)斑马鱼品系建立。各种带有不同反应元件的转基因斑马鱼胚胎可以像基因芯片一样排列在微孔板中,可以准确地检测出水环境中各种污染物的种类,并根据荧光强度来推算污染物的浓度[48-49]。Petersen等[44]通过暴露转基因斑马鱼tg(cyp19a1b-GFP)胚胎监测5种不同的环境雌激素,结果发现,所潜在的和弱的类雌激素都能够监测到。此外,Pawar等[38]将转基因斑马鱼(pTol2-MT-Ia1-DsRed2)的胚胎暴露至Cd2+、Cu2+、Hg2+、Pb2+和Zn2+溶液中,通过观察荧光强度确定毒性强弱。
2 斑马鱼多阶段毒性评价及整个生命周期的毒理学研究进展(Research progress on multi-stage and complete life cycle toxicity evaluation)
2.1 斑马鱼多阶段毒性评价及整个生命周期在毒性测试中的应用
随着对鱼类毒性试验了解的不断深入,人们逐渐发现传统的单一生命阶段毒性试验提供的数据较为片面,不能客观全面地反映有毒化合物对生物的毒性,大量研究已经发现,对于同一有毒污染物,不同生命阶段的鱼会表现出不同的敏感性和中毒反应,多阶段毒性评价能够避免由生命阶段不同而导致的敏感性差异[50-51]。通过整个生命周期毒性试验可以发现低剂量有毒化合物暴露的影响,并有助于建立长期化学品的安全浓度,提供可能的延迟毒性的详细信息[52]。在毒理学评价中,单个生命阶段的毒理学试验结果较为片面,而整个生命周期的毒性试验时间跨度较大,对外界环境要求较高,实际操作起来难度较大。因此,许多毒性试验选择3个单独的斑马鱼生命阶段(胚胎、仔鱼和成鱼)[53]。斑马鱼不同的生命阶段有着不同的毒性测试标准体系,在多阶段毒性评价中可以参照对应的标准(表3)进行试验。笔者查阅OECD、ISO、美国环境保护局(United States Environmental Protcction Agency, US EPA)和日本环境省等标准资源库发现,目前US EPA(Fish Life Cycle Toxicity, 1996)和日本环境省(the Medaka (OryziasLatipes) Full Life-Cycle Test Guideline, 2002)制定了鱼类整个生命周期毒性试验。
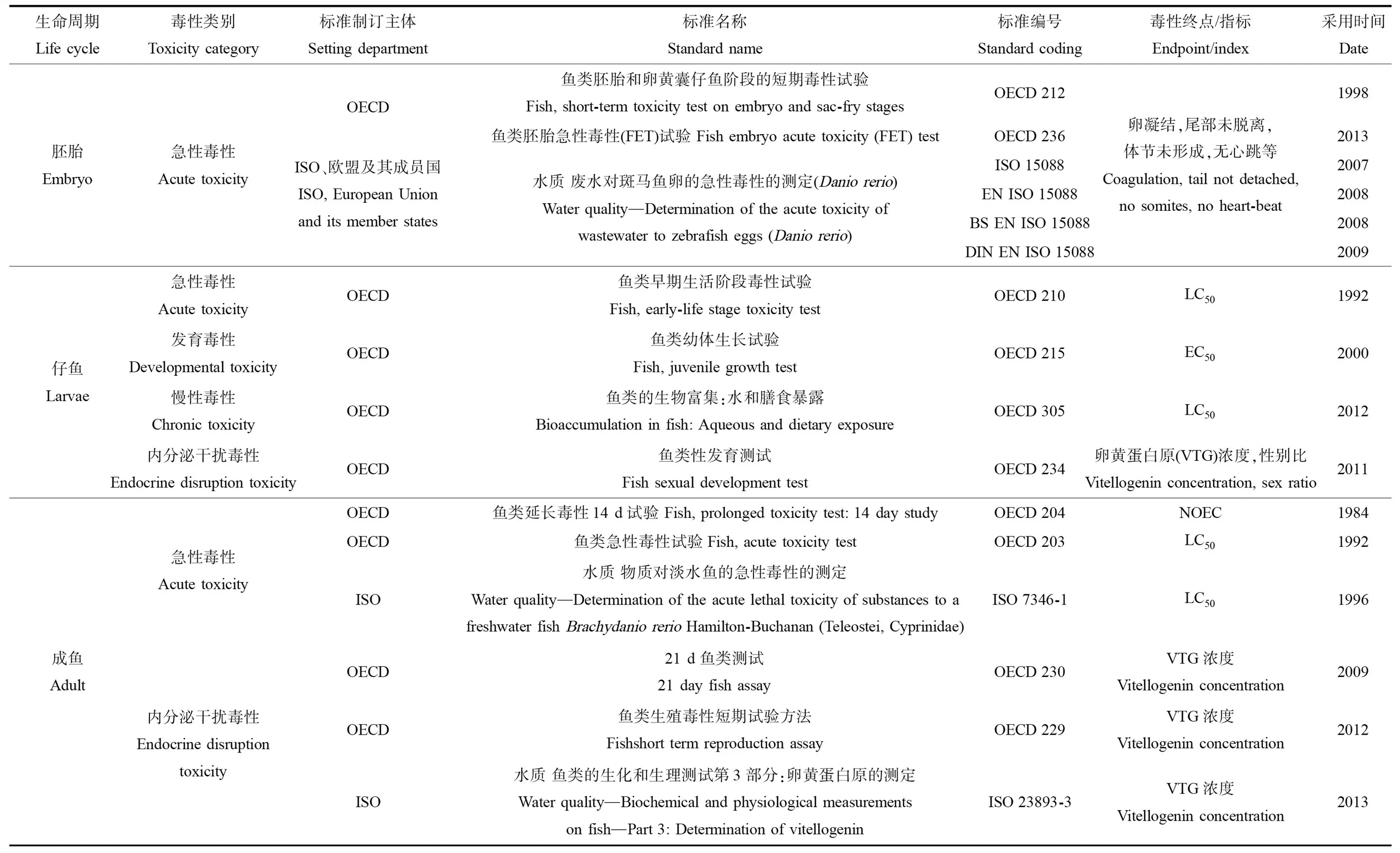
表2 利用斑马鱼生命周期开展毒性测试的标准Table 2 Standard for zebrafish life-cycle toxicity test
注:LC50表示半数致死浓度,EC50表示半数效应浓度,NOEC表示无可观察效应浓度。OECD表示经济合作与发展组织,ISO表示国际标准化组织。
Note: LC50stands for median lethal concentration; EC50stands for median effect concentration; NOEC stands for no observed effect concentration; OECD stands for Organization for Economic Co-Operation and Development; ISO stands for International Organization for Standardization.

表3 不同反应元件的转基因斑马鱼在环境监测中的应用Table 3 Application of transgenic zebrafish with different response elements in environmental monitoring
注:AHRE表示芳香烃反应元件,MRE表示金属离子反应元件,ERE表示雌激素反应元件,EPRE表示亲电反应元件,RAREs表示维甲酸反应元件,RXREs表示类维生素X反应元件。共有序列中,N=A, T, G或C;R=A或G;W=A或T。
Note: AHRE stands for aromatic hydrocarbon response element; MRE stands for metal response element; EPRE stands for electrophile response element; RAREs stands for retinoic acid response element; RXREs stands for retinoid X response elements. Within each consensus sequence, N = A, T, G, or C; R = A or G; W = A or T.
在鱼类毒性检测的环境污染物中主要分为重金属、内分泌干扰物和有机物[54]。最早提出鱼类生命周期毒性试验的Mount和Stephan[55]将黑头呆鱼的整个生命周期暴露于马拉硫磷和丁氧基乙醇酯中定量分析黑头呆鱼的生长繁殖所受的影响。随着斑马鱼模型的开发和应用,越来越多的研究针对这3类物质开展斑马鱼多阶段毒性评价和整个生命周期毒性试验。通过不同的评价方法,不同的暴露时长,以形态变化、基因表达、行为和生理学特征等指标来评价污染物的毒性(表4)。
2.2 国内斑马鱼及其毒性试验标准的发展
斑马鱼在我国生物科学中的研究始于1998年,孟安明院士在清华大学建立国内第一家以斑马鱼为模式动物的发育生物学实验室[49]。2000年后,斑马鱼研究团体飞速增长,截至2017年,中国斑马鱼学者在国际斑马鱼信息中心(the Zebrafish Information Network, ZFIN)网站注册的独立实验室已达100个[56]。国家斑马鱼资源中心隶属于中国科学院水生生物研究所,其斑马鱼资源保藏库现拥有1 200多个斑马鱼品系和10 000余份冻存精子,可提供斑马鱼品系等资源服务、转基因和基因敲除等技术服务、养殖和健康等咨询服务,以及技术培训和学术会议服务等[15]。此外,国际也有着相当数量且实力雄厚的斑马鱼生物信息学数据库(表5)。通过Web of ScienceTMCore Collection (v5.29)数据库以斑马鱼为主题同时限定区域分析(不含港澳台) 可知,2000—2001年中国斑马鱼相关研究论文在世界中的占比仅为1.6%,之后中国斑马鱼论文占比持续增长,到了2010年首次突破10%,而到了2017年,更是达到22.9%(图2),另搜索中国知网数据库发现,以“斑马鱼”为主题的中文文献已有4 010篇(1990—2017年)。

图2 Web of ScienceTM Core Collection数据库中1997—2017年中国斑马鱼论文数量及占比Fig. 2 The proportion of Chinese zebrafish papers from 1997 to 2017 from Web of ScienceTM Core Collection datebase
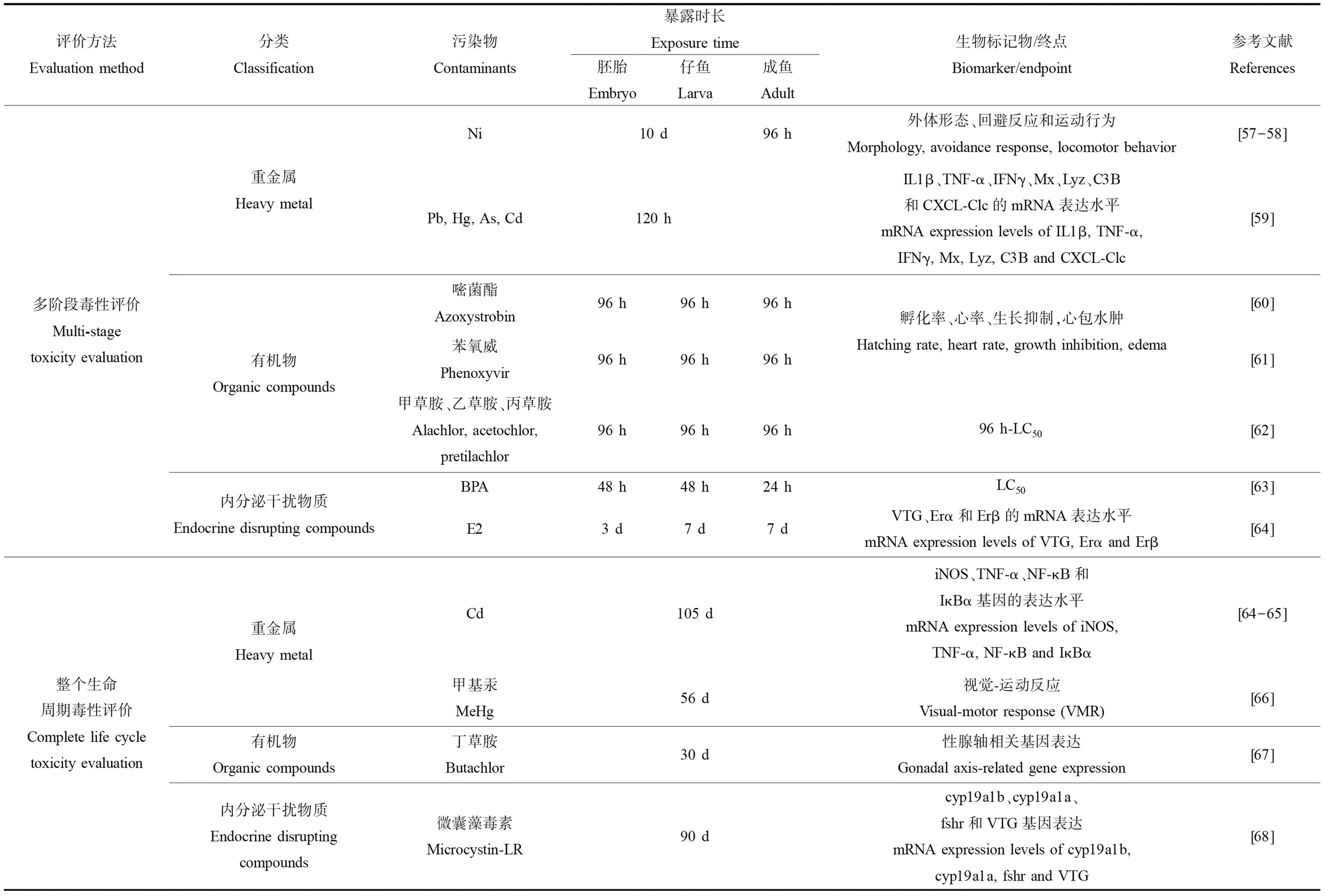
表4 斑马鱼多阶段毒性评价和整个生命周期毒性评价的应用Table 4 Application of multi-stage and complete life cycle toxicity evaluation
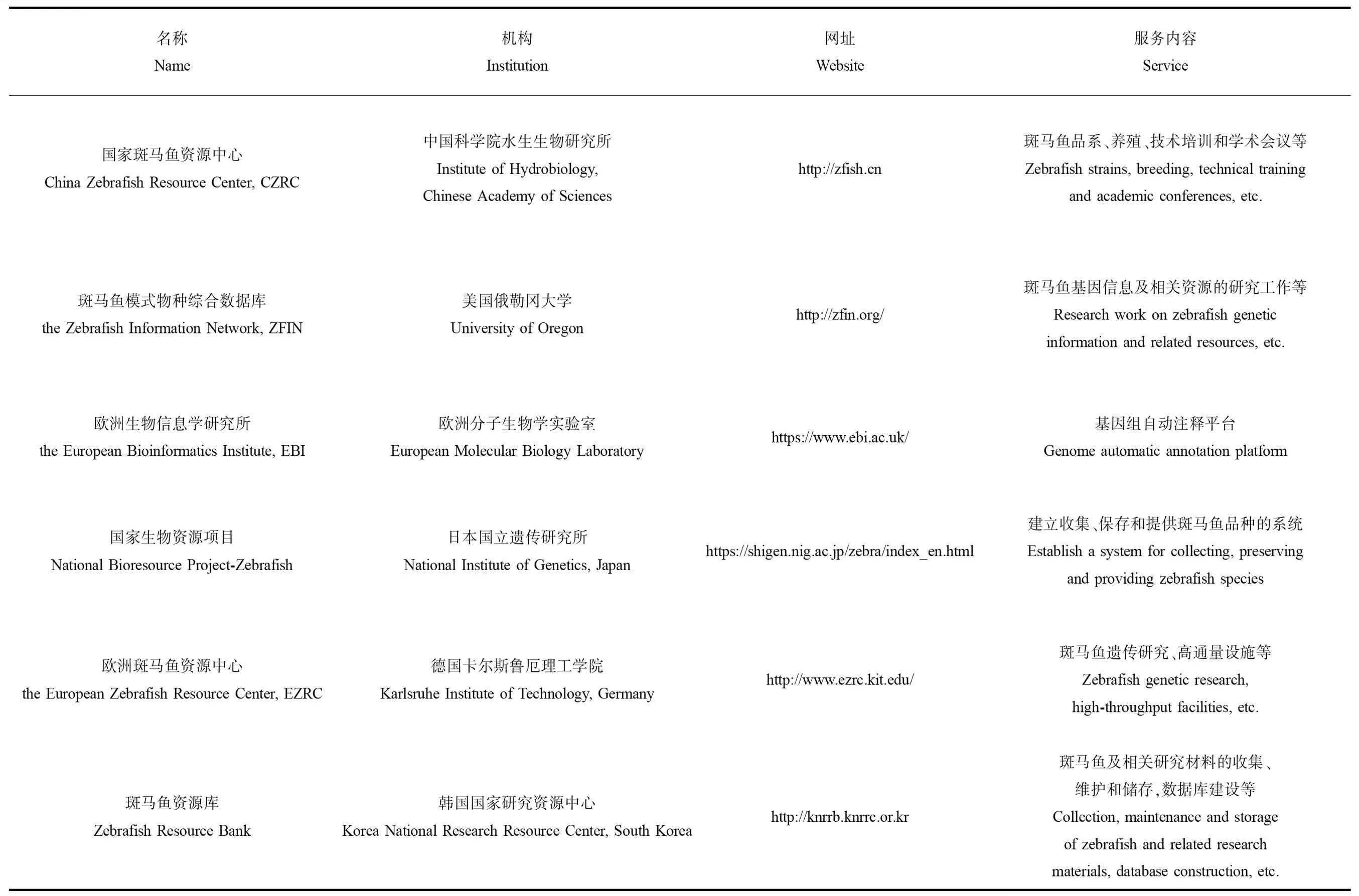
表5 斑马鱼生物信息学资源库Table 5 Zebrafish bioinformatics resource library

表6 国内斑马鱼相关标准制定进展Table 6 Progress in the development of domestic zebrafish related standards
在国内标准制定上,1992年出台的《水质 物质对淡水鱼(斑马鱼)急性毒性测定方法》(GB/T 13267—91)中首次将斑马鱼用于水质检测,经过20余年的发展,已有13个国家标准将斑马鱼作为推荐物种用于测试水质、农药、废水和化学品的毒性(表6)。2015年11月原环境保护部发布《关于征求国家环境保护标准<城镇污水处理厂污染物排放标准>(征求意见稿)意见的函》(环办函〔2015〕1782号),并发布《城镇污水处理厂污染物排放标准》征求意见稿和征求意见稿编制说明向社会征求意见,首次增加综合毒性指标来反映排放废水的综合毒性,包括发光细菌、大型溞、水藻和斑马鱼胚胎急性毒性。
3 展望(Outlook)
斑马鱼以其卓越的生物学特性成为毒理学研究中最重要的模式生物之一,是毒性测试和其他生物研究的哺乳动物模型的一种可替代方案,其全生命周期毒性检测技术已在重金属、有机污染物及内分泌干扰物质等方面有了较为广泛的研究,相关标准正在推进和完善。本文通过综述斑马鱼全生命周期毒性测试的研究进展,对未来开展相关研究提出以下几点建议:
(1)斑马鱼不同的生命阶段有不同的应用,能满足不同的需求,以特定的毒性终点来表征化合物的毒性。在胚胎阶段确定更合适的分子标记物作为毒性测试指标及建立短期毒性测试和长期毒性测试之间的关系,可初步判断有毒化合物的毒性类型及潜在危害程度,从而使斑马鱼胚胎模型更好地为环境管理决策服务。
(2)近年来基因组学等组学技术兴起,转基因斑马鱼进行环境污染物毒理学研究成为生态毒理学研究新热点。随着各种转基因斑马鱼的开发和利用,其灵敏度和效率也不断提高,利用斑马鱼的基因表达来研究毒性机制将更有利于以斑马鱼为模型研究环境污染物对人类健康的影响。
(3)目前国内尚没有一份针对某一化学品的斑马鱼整个生命周期和多阶段毒性试验的标准规范,建立一套斑马鱼整个生命周期和多阶段毒性试验的标准规范并对重金属、内分泌干扰物和有机污染物进行毒性评价具有较大的研究价值,对有毒化合物的生态风险评估以及水体污染的生物监测具有一定的指导意义,这将在以后的生态毒理学领域中具有较大的研究价值。
致谢:感谢中国环境监测总站金小伟高工在文章修改中给予的帮助。

