类固醇激素在环境中的污染现状及归趋
杨雷,张晋娜,史文俊,彭涛,熊倩,石义静,#,应光国1,,*
1. 中国科学院广州地球化学研究所,有机地球化学国家重点实验室,广州 510640 2. 华南师范大学环境研究院,广东省化学品污染与环境安全重点实验室,环境理论化学教育部重点实验室,广州 510006 3. 中国科学院大学,北京 100049
类固醇激素是一类四环脂肪烃化合物,具有生物活性基团,包含环戊烷多氢菲母核,即3个六元环和1个五元环(图1)。类固醇激素有助于控制机体的正常代谢、昼夜节律和性征发育等,也能帮助机体抵御某些疾病和伤害[1]。同时,环境中的类固醇激素又是一类非常重要的内分泌干扰物(endocrine disrupting chemicals, EDCs),其在极低的浓度下(如1 ng·L-1)就可能对生物体造成危害[2],故相比于其他内分泌干扰物,类固醇激素具有更强的干扰效果。因此,环境中残留的类固醇激素可能对环境构成潜在威胁[3-4]。据文献报道,类固醇激素不仅在城市污水处理厂、养殖场及其周边环境中频繁检出,甚至在多种鱼体组织中也有检出,且部分检出浓度高于预测无效应浓度(predicted no effect concentration, PNEC)[4-6]。目前,关于类固醇激素的研究主要集中于雌激素[7-9],而关于雄激素、孕激素、糖皮质激素和盐皮质激素的研究则相对较少。本文对类固醇激素的主要来源、途径、污染现状和环境行为等进行了系统的总结和归纳,以期为类固醇激素的后续研究提供参考,为进一步评价类固醇激素对环境所带来的风险和威胁提供基础数据。

图1 类固醇激素的框架(6-6-6-5结构)Fig. 1 Framework of steroid hormones (6-6-6-5 structure)
1 类固醇激素的分类及相关性质(Classification and properties of steroid hormones)
根据来源,类固醇激素可以分为天然和合成两大类。环境中天然类固醇激素主要来自人和动物体的代谢物,如粪便、尿液等[10-12];合成类固醇激素则是通过人工合成,经使用后释放到环境中。所有类固醇激素穿透质膜后与细胞内受体结合而发挥作用,根据与之结合的受体不同,可分为雌激素、雄激素、孕激素、糖皮质激素和盐皮质激素五类,物理化学性质见表1。
雌激素(estrogen)是C18类固醇激素,类固醇激素中仅自由态的雌激素可电离,雌激素能影响内分泌系统、机体代谢和骨骼生长,同时也可以促进和维持女性的第二性征[1,13]。雄激素(androgen)是C19类固醇激素,在哺乳动物中,天然雄激素主要由睾丸产生,用于促进雄性器官的生长、组织再生和维持雄性第二性征,合成雄激素常被用作生长促进剂和动物的疾病预防和治疗[1,13]。孕激素(progestogen)是C21类固醇激素,主要作用是促进女性器官生长及维持第二性征和生殖功能[1],可以单独使用或与雌激素一起使用[14],用于治疗月经紊乱、不育症和子宫内膜异位症等[13]。糖皮质激素(glucocorticoid)是C21类固醇激素,由肾上腺皮质中束带分泌,能影响蛋白质、脂质和糖类的合成,同时也具有免疫抑制、抗炎、抗毒和抗休克的功能[15-16]。盐皮质激素(mineralocorticoid)是C21类固醇激素,由肾上腺皮质球状带细胞分泌,主要作用是促进肾小管保钠排钾[17]。
2 类固醇激素在不同环境介质中的污染分布(Occurrence of steroid hormones in various environmental matrix)
环境介质中类固醇激素主要来源于人类活动、畜牧、水产养殖、药厂以及医院等[15]。类固醇激素在机体内参与代谢活动,未被代谢的部分及代谢产物以自由态和共轭态的形式通过粪便和尿液排出体外[18]。以人类为源的城市污水处理厂和以动物为源的养殖场是环境中类固醇激素的主要来源[12,14]。畜禽养殖场污水往往不经过处理或简单处理后直接排放,畜禽粪便作为有机肥农用的方式也较为普遍[19]。同时,现有城市污水处理系统未能完全去除类固醇激素,使得类固醇激素及其代谢产物在环境中蓄积,对生态系统构成潜在威胁。
2.1 污水处理厂
天然和合成类固醇激素通过机体代谢排放的方式进入城市污水系统,随着人们对其危害的认识逐渐加深,污水处理厂中类固醇激素的分布及归趋受到了研究者们的广泛关注。类固醇激素在进水中的浓度从侧面反映出其在服务区域内的使用情况,在出水和活性污泥中的浓度则表明类固醇激素的去除情况及其对环境残留的贡献。笔者总结了不同国家和地区污水处理厂中常见类固醇激素(包括5种雌激素、14种雄激素、10种孕激素和8种糖皮质激素)的浓度分布及去除情况(附表SI-1)。总体上,进出水及活性污泥中雌激素和雄激素的检出浓度普遍高于孕激素和糖皮质激素(图2)。
污水处理厂进水检测出的类固醇激素以天然类固醇激素为主。天然雌激素17α-雌二醇(E2α)、17β-雌二醇(E2β)、雌酮(E1)和雌三醇(E3)的检出频率和检出浓度较高,浓度最高达8 150 ng·L-1(E1)[20],合成雌激素17α-乙炔雌二醇(EE2)浓度相对较低,除新加坡某一污水处理厂外(152.7 ng·L-1),检出浓度均低于19.9 ng·L-1。天然雄激素雄酮(ADS)、表雄酮(EADR)、1,4-雄烯二酮(ADD)和雄烯二酮(AED)等的检出浓度一般比其他类固醇激素高1~3个数量级[5,21-23]。孕激素孕二醇(PGD)、17α-羟孕酮(17α-HP)和甲基炔诺酮(NGT)等的检出频率和检出浓度较高,浓度最高达400 ng·L-1(PGD)[23]。中国广东某污水处理厂合成孕激素NGT的检出浓度为28.3~35.3 ng·L-1[14],远高于其他合成孕激素。天然糖皮质激素的检出浓度(1~130 ng·L-1)高于合成糖皮质激素(ND~15.1 ng·L-1),其中皮质醇(CRL)、可的松(CRN)、泼尼松龙(PREL)和泼尼松(PRE)等检出频率和浓度也较高,最高达130 ng·L-1(CRL)[24]。盐皮质激素在污水处理厂的检出情况暂未见报道。导致类固醇激素高浓度检出可能是因为:(1)这几类天然类固醇激素的大量排放;(2)共轭态类固醇激素(葡萄糖醛酸盐和硫酸盐)在微生物的作用下发生解离,释放出自由态类固醇激素;(3)由结构相似的其他几类类固醇激素或化学物质转化而来[5,14-15]。
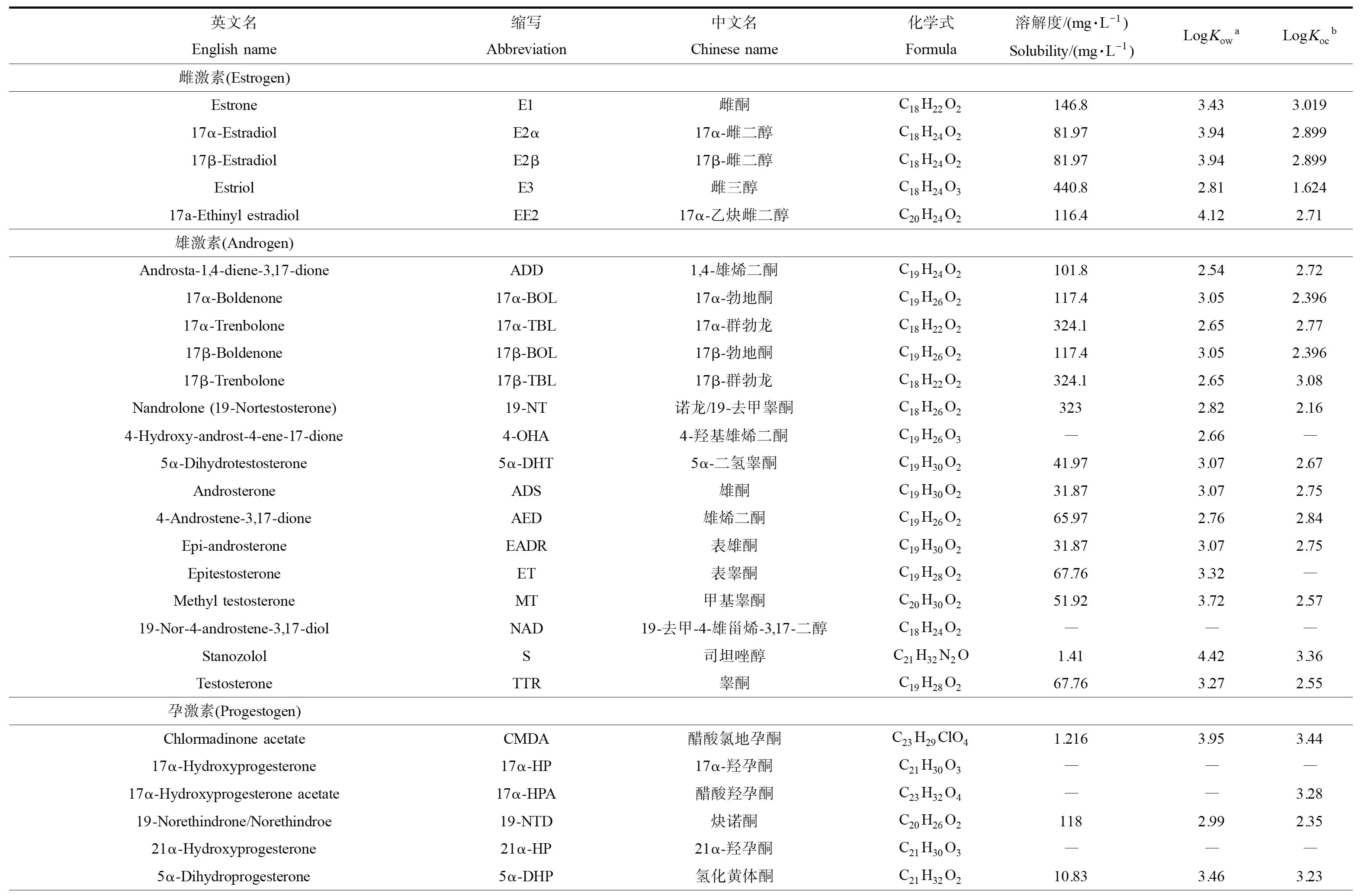
表1 常见类固醇激素的物理化学性质Table 1 Physical and chemical properties of common steroid hormones

续表1英文名English name缩写Abbreviation中文名Chinese name化学式Formula溶解度/(mg·L-1)Solubility/(mg·L-1)LogKowaLogKocbPregnanediolPGD孕二醇C21H36O20.61714.892.807糖皮质激素(Glucocorticoid)CorticosteroneCORT皮质酮C21H30O4143.41.991.566CortisolCRL皮质醇C21H30O5219.61.621.38CortisoneCRN可的松C21H28O5297.41.811.31DexamethasoneDEX地塞米松C22H29FO575.141.721.57HydrocortisoneHDT氢化可的松C21H30O5219.61.621.3846α-MethylprednisoloneMPREL6α-甲基泼尼松龙C22H30O5123.31.821.5PrednisonePRE泼尼松/强的松C21H26O53121.591.3PrednisolonePREL泼尼松龙C21H28O5221.41.41.39盐皮质激素(Mineralocorticoid)AldosteroneALD醛固酮C21H28O5640.41.231DeoxycorticosteroneDOC脱氧皮质酮C21H30O391.163.122.498
注:aKow为辛醇水分配系数,bKoc为有机碳分配系数,数据来源于美国环保局的EPI Suite;“―”表示未查到。
Note:aKowis octanol-water partition coefficient, andbKocis the organic carbon partition coefficient, both of which are calculated based on EPI Suite from U.S. EPA. “―”, not available.
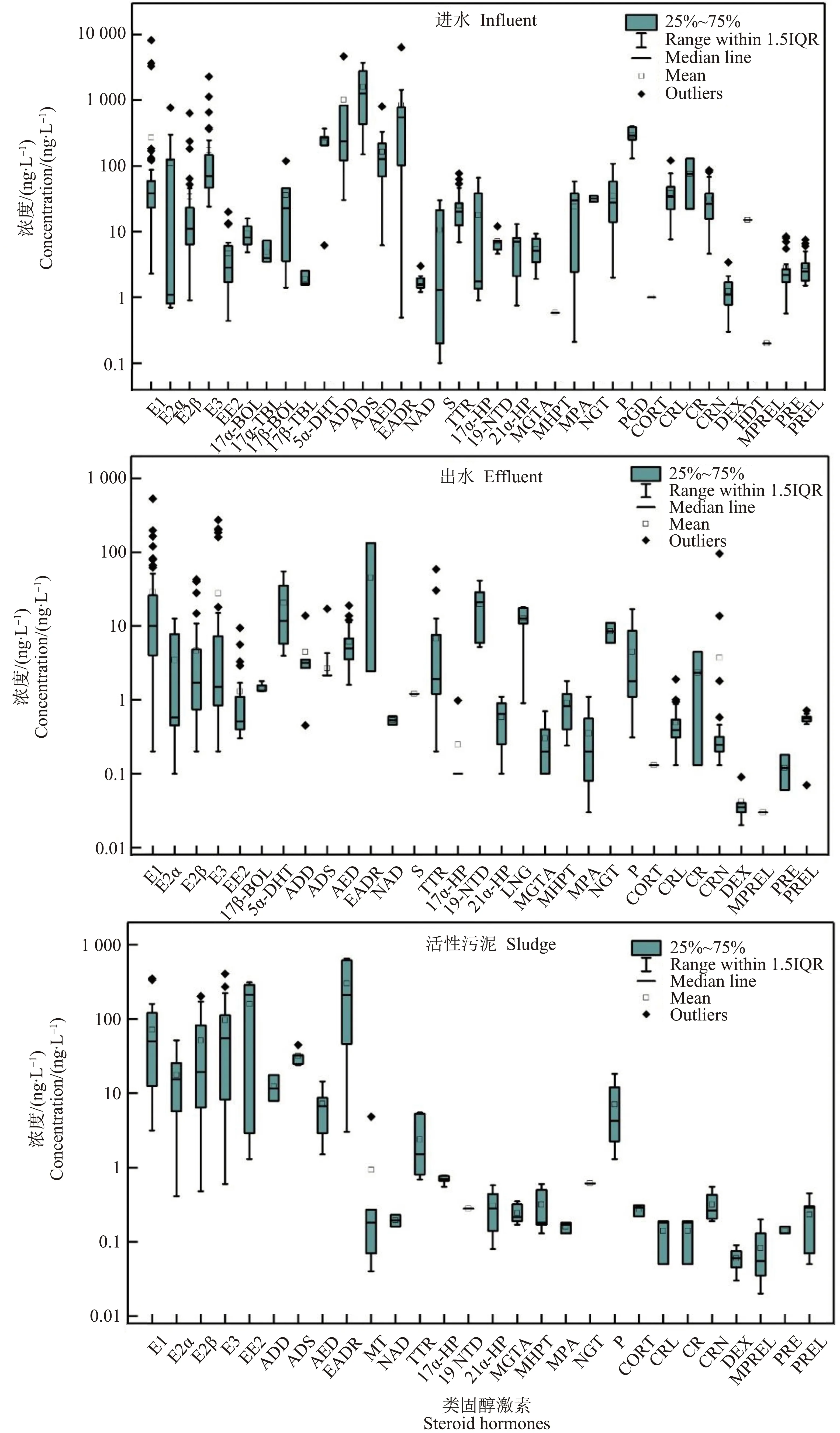
图2 污水处理厂中类固醇激素的浓度分布Fig. 2 Occurrence of steroid hormones in wastewater treatment plants
不同国家和地区的污水处理工艺对类固醇激素的处理效果存在较大差异,但是总体效果良好[14,21,24-25],出水浓度普遍低于20 ng·L-1(图2),尤其是雄激素,其在水相中的去除率均较高,如进水中高浓度检出的ADS、EADR和ADD,其出水浓度均降低1~3个数量级[14,22]。然而,部分类固醇激素也存在异常现象,例如在美国查尔斯顿市某污水处理厂中,E1进水浓度为31 ng·L-1,而其在出水中浓度达到38 ng·L-1[26]。
在活性污泥中不同种类类固醇激素的浓度分布差异较大(图2),除孕激素黄体酮(P)外,雌激素和雄激素的浓度(分别为ND~406 ng·g-1和ND~655 ng·g-1)相比孕激素和糖皮质激素高1~2个数量级(浓度分别为ND~0.7 ng·g-1和ND~4.4 ng·g-1)。在北京某污水处理厂活性污泥中,P的检出浓度达到11.2~18.3 ng·g-1[5,21],与雄激素和雌激素浓度属同一数量级[14,27-28]。活性污泥中天然类固醇激素的浓度高于合成类固醇激素,高频检出的类固醇激素种类与进水中相似。
不同国家检出的同种类固醇激素浓度往往存在较大差异。例如,北京8个污水处理厂进水中P的浓度(33.1~108 ng·L-1)[5,21]远高于日本2个污水处理厂进水中的浓度(3.1~10 ng·L-1)[29]。同一地区不同污水处理厂中的同种类固醇激素也存在差异,Liu等[14]和Zhang等[22]分别报道了中国广东地区不同污水处理厂进水中的ADD浓度,分别为121~248 ng·L-1和30.2~4 650 ng·L-1,这可能是污水处理厂的地理位置、服务人群、处理工艺的差异以及采样季节、天气情况,尤其是采样方法局限性导致的[30]。
Fan等[21]、Liu等[14]和Zhang等[22]等详细报道了污水处理厂各个工艺段多种类固醇激素的浓度分布及去除情况,得出以下结论:(1)沉砂池对大部分类固醇激素的去除效果不明显,对某些类固醇激素的去除率甚至为负值;(2)活性污泥加氯化消毒为主的污水处理厂中,缺氧池对类固醇激素的去除起主要作用,厌氧-缺氧-好氧组合工艺为最佳二级处理工艺;(3)氧化沟加紫外消毒为主的污水处理厂中,氧化沟能显著去除所有类固醇激素,是最主要的工艺;(4)活性污泥对各种类固醇激素的降解效果优于氧化沟,雌激素、雄激素和孕激素主要通过吸附和降解共同去除,糖皮质激素则主要通过降解去除;(5)紫外光(UV)对大部分类固醇激素的去除没有效果;氯化过程对类固醇激素处理效果较差。目前,通过O3、纳米过滤等先进技术对类固醇激素的去除研究较少,因此,应该开发更有效的处理技术和措施,以更好地控制环境中类固醇激素的浓度。
2.2 养殖场
养殖场是环境类固醇激素的又一重要来源。有研究指出,通过养殖场排放到环境中的类固醇激素量和通过人体排放到环境中的量相当,某些情况下,甚至超过人体类固醇激素排放量[4,12,31-32]。目前,已有众多关于养殖场粪便、冲刷废水及周边土壤和水体中类固醇激素浓度分布及去除效果的研究,附表SI-2列出了养殖场中多种常见类固醇激素(包括5种雌激素、10种雄激素、12种孕激素和3种糖皮质激素)的检出情况。
类固醇激素在养殖场各环境介质中普遍存在[12,33-34],粪便中类固醇激素的浓度普遍低于冲刷水,而检出的类固醇激素种类则无明显差异(图3)。在养殖场粪便中(附表SI-2),类固醇激素的检出浓度为ND至数千ng·L-1。养殖场粪便中天然类固醇激素占主导地位,例如粪便中天然雄激素的浓度(ND~1 000 ng·g-1)远高于合成雄激素(ND~75.4 ng·g-1)。
在养殖场冲刷废水中(附表SI-2),共检出26种类固醇激素(附表SI-2),除中国广西某养猪场冲刷水中天然雄激素5α-二氢睾酮(5α-DHT)未被检出外,天然雄激素的浓度(240~10 500 ng·L-1)均远远高于合成雄激素的浓度(1.9~95.9 ng·L-1)。冲刷废水中天然雌激素的浓度较高(ND~5 400 ng·L-1),E1的检出频率和检出浓度最高(5 400 ng·L-1)[34],冲刷水中合成雌激素的报道较少[12,34],EE2浓度为<6.3~410 ng·L-1。冲刷水中孕激素浓度存在较大差异,浓度范围为ND(羟孕酮(HP))~9 333 ng·L-1(去氢孕酮(DGT)),P、甲羟孕酮(MP)和NGT等检出频率和浓度较高,浓度最高达7 080 ng·L-1(NGT)。冲刷废水中糖皮质激素的报道较少,仅在中国广西养猪场冲刷水中检出合成糖皮质激素地塞米松(DEX),浓度达到180 ng·L-1[12]。皮质激素因具有消炎、免疫抑制等作用被人们广泛使用,未来的工作应加强有关皮质激素的监测及其生态毒理的研究。

图3 养殖场中类固醇激素的浓度分布Fig. 3 Occurrence of steroid hormones in livestock farms
关于养殖场冲刷水颗粒物中类固醇激素浓度的报道较少[35],目前仅统计出8种孕激素,浓度最高达98.3 ng·g-1(DGT)[35]。除醋酸羟孕酮(17α-HPA)在冲刷水颗粒物中检出(3.34~4.54 ng·g-1)而未在养殖场粪便检出外[35],粪便和冲刷水中可检出类固醇激素种类和浓度均远远高于颗粒物。
在养殖场周边土壤中(附表SI-2)共检出6种类固醇激素,浓度最高达107 ng·g-1(E1)[36]。土壤中的类固醇激素残留量取决于养殖场废弃物的使用量和使用频率[12],因此,将养殖场废弃物施用于土壤前应进行高温堆肥等处理[37],以降低其中类固醇激素的浓度。
不同养殖场配备的污水处理工艺不同,效果不一,类固醇激素浓度也存在差异。Liu等[12]在广西养猪场的厌氧消化池、储污池及出水中检出11种类固醇激素,大部分类固醇激素浓度远低于其在冲刷水中的浓度,说明厌氧消化池和储污池对类固醇激素具有较好的去除效果。研究者认为厌氧消化池和储污池中的类固醇激素可能通过稀释、降解及吸附作用得到去除。值得注意的是,EE2在储污池(124 ng·L-1)、储污池出水(258 ng·L-1)和冲刷水(410 ng·L-1)中均具有较高的浓度,说明其在养殖过程中被作为兽药大量添加,应引起人们的高度关注,加强养殖场中兽药的规范使用。Zheng等[36]研究发现,3个储污池串联工艺,使类固醇激素得到了很好的去除,使其最终出水浓度低于5 ng·L-1。同时,也有研究发现,储污池系统出水中的雌激素浓度随季节及处理方式波动较大,检出浓度在ND至数千ng·L-1之间[38],这可能与水相溶解氧含量、储污池体积、串联储污池数量、厌氧池体积和温度等因素有关。
不同国家和地区的不同类型养殖场中类固醇激素的检出浓度存在较大差异。例如,日本某养猪场冲刷水[34]中E2β的浓度(1 000~1 500 ng·L-1)远高于其在中国浙江某养猪场冲刷水[39]中的浓度(20 ng·L-1)。Liu等[35]在广西养猪场的新鲜猪粪中检测出P的浓度为485~1 020 ng·g-1,而Zheng等[36]在美国养牛场的新鲜牛粪中则未检出P。造成这种现象的原因可能是:(1)养殖场内天然类固醇激素的含量受动物种类、年龄、性别以及所处的生长周期和类固醇激素的种类影响[31]。例如,成年母猪的类固醇激素排放量远高于小猪(乳猪,14~35 kg)或大猪(大约2~7月,35~125 kg),且成年母猪主要通过粪便排出体内类固醇激素,而小猪和大猪主要通过尿液排放[15];(2)不同国家的类固醇激素兽用标准不同,使得不同养殖场使用的激素类药物的种类及用量存在较大差异。例如,醋酸群勃龙是常用的生长促进剂,其在牲畜体内能被转化17α-群勃龙(17α-TBL)和17β-群勃龙(17β-TBL)[40],有报道指出,在中国广西养猪场和德国养牛场的粪便和冲刷水中检出了17α-TBL和17β-TBL[12,33],而在别的国家暂未报道检出。
目前,关于养殖场类固醇激素的研究集中于自由态雌激素和部分雄激素,亟需对其他几类类固醇激素及共轭态开展大量研究。
2.3 地表水、沉积物及地下水
随着越来越多未经处理及处理不完全的工业废水和生活污水排放到地表环境中,导致不同国家和地区的地表环境中类固醇激素频繁被检出[41-43]。附表SI-3列出了地表水、沉积物和地下水中多种常见类固醇激素(包括5种雌激素、12种雄激素、10种孕激素和4种糖皮质激素)的检出情况。
由图4可知,地表水中雄激素的检出浓度较高,最高达390 ng·L-1(ADS)[44],雌激素、孕激素和糖皮质激素的检出浓度则相对较低,浓度分别为ND~33.9 ng·L-1、ND~38 ng·L-1和ND~29 ng·L-1。部分类固醇激素除外,例如在印度地表水中检出合成雌激素EE2的浓度高达98~350 ng·L-1,研究者认为这与避孕药的大量使用有关[45]。
沉积物中类固醇激素的研究集中于雌激素,检出的浓度范围为ND至几十ng·g-1(图4)。然而,巴西红树林的沉积物中EE2的浓度最高达129.78 ng·g-1[46],理论上,海洋沉积物中的EE2在厌氧条件下能被转化为E1,最终发生矿化,对于这种高浓度检出的现象研究者未能给出合理的解释,具体机理有待深入研究。沉积物中的类固醇激素浓度远低于其在地表水中的浓度,这可能与类固醇激素的理化性质有关(表1)。有研究指出,logKow值低于2.5时,化合物倾向于溶解在水相中,高于4.0时倾向于吸附在沉积物中[47]。
地下水中类固醇激素的相关研究较少[12,42],其检出浓度均较低(ND~10.1 ng·L-1),与沉积物中的浓度相近,远低于地表水中的浓度(图4)。
不同国家和地区地表水中检出的类固醇激素浓度存在较大差异(附表SI-3),例如在印度地表水中E3的检出浓度为104~370 ng·L-1[45],而在中国[48]、巴西[49]和马来西亚[50]等国家地表水中其检出浓度均低于13.9 ng·L-1。这可能与地理位置、经济发展水平、人口及动物数量和季节气候等因素有关[2,30,51]。由附表SI-3可知,类固醇激素在发展中国家如中国、印度和巴西等的检出浓度高于美国、日本和法国等发达国家,这可能是由于发展中国家对激素药物监控力度不足,存在激素药物滥用的现象[52-53]。
2.4 生物体
由于水产养殖药物的滥用和其他污染物的存在,水产品的质量持续下降[54],食用水产品是否对人类健康造成危害,已逐步成为人们关注的焦点。目前,关于类固醇激素在生物体内富集的研究,主要针对雌激素在鱼体组织中的富集[55-58],关于其他生物体内类固醇激素富集的研究相对较少。附表SI-4列出了不同鱼体组织以及虾蟹中多种常见类固醇激素(包括4种雌激素、9种雄激素、6种孕激素和3种糖皮质激素)的检出情况。
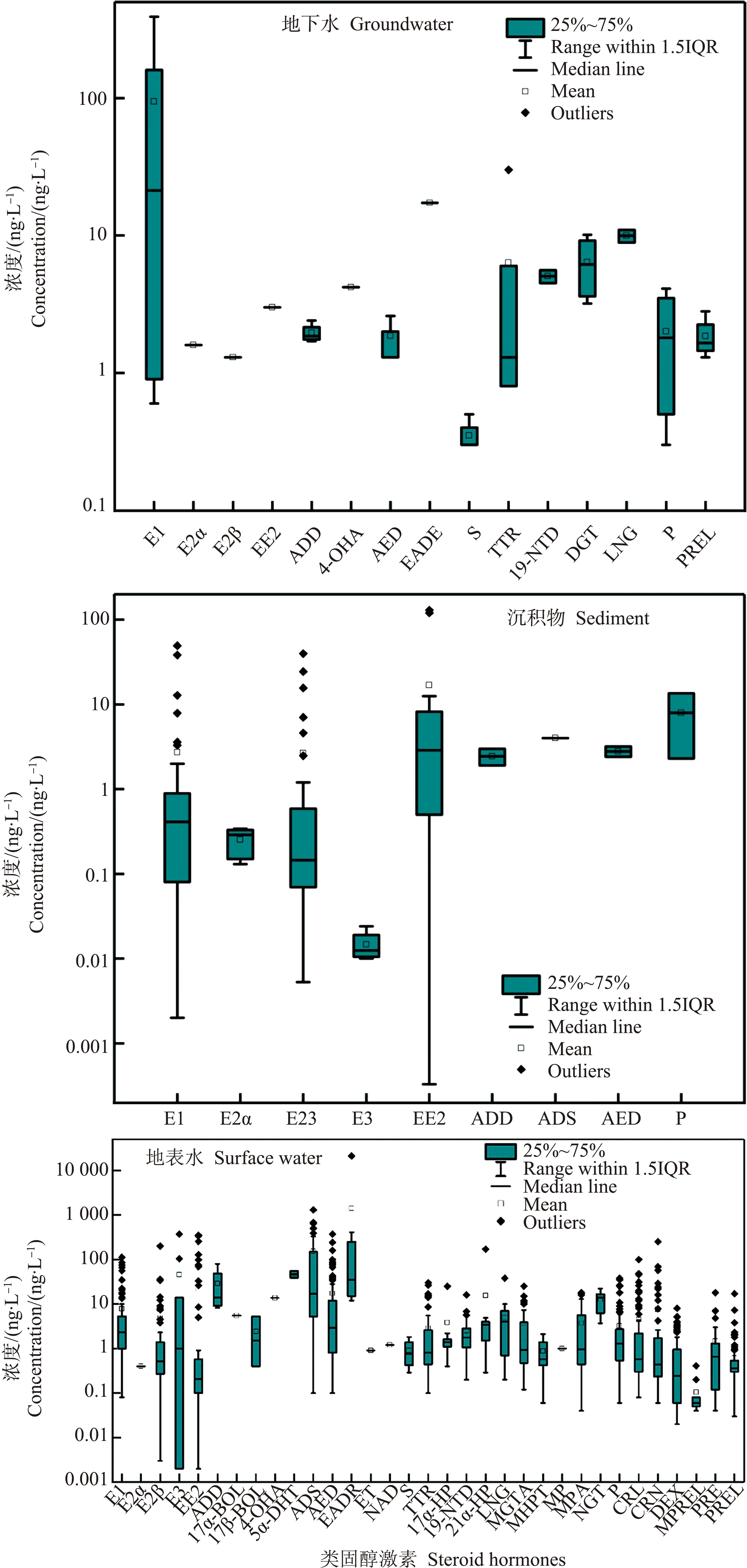
图4 地下水、沉积物和地表水中类固醇激素的浓度分布Fig. 4 Occurrence of steroid hormones in sediment, groundwater and surface water
类固醇激素在鱼体组织、虾和蟹中普遍检出。在鱼体胆汁中共检出16种类固醇激素(附表SI-4),以天然糖皮质激素CRL为主,浓度高达700 000~5 900 000 ng·L-1[4],有研究表明,当鱼类感受到压力(解剖或高密度养殖等操作)时会释放大量的CRL[59],这可能是其高浓度检出的原因。除CRL外,天然类固醇激素AED、ADD、TTR和P的检出频率和浓度也较高,浓度最高达27 000 ng·L-1(AED)[4]。合成雄激素17α-勃地酮(17α-BOL)的检出频率和浓度(ND~4 500 ng·L-1)也较高,而饲料和其他环境样品,均未检测出17α-BOL,说明其在生物体中检出是由于其他物质转化而来[4]。
在鱼体血浆中(附表SI-4),共检出12种类固醇激素,常检出的类固醇激素与胆汁中的类似。血浆中CRL仍是主要的检出类固醇激素,浓度最高达9 600 000 ng·L-1[4]。除此之外,合成孕激素醋酸环丙孕酮(CPTA)也具有较高的检出频率,浓度最高达28 000 ng·L-1[4],这可能是由于CPTA的亲脂性,使其更倾向于在鱼体血浆中富集[4]。
在鱼体肝脏中(附表SI-4),共检出11种类固醇激素。天然雄激素AED、TTR和糖皮质激素CRL的检出频率和检出浓度较高,浓度最高为CRL(970 ng·g-1)[4]。CPTA在多个肝脏样品中被检出,最高浓度达到250 ng·g-1[4]。由附表SI-4可知,与胆汁和血浆相比,肝脏中检出的类固醇激素浓度更低,这可能是由于肝脏作为解毒器官对有毒物质(包括外源性类固醇激素)进行了分解[4]。
在鱼体肌肉中(附表SI-4),共检出17种类固醇激素,浓度最高达2 700 ng·g-1(CRL)。天然糖皮质激素CRL和CRN是最主要的类固醇激素,CRN仅在肌肉中检测到,在环境样品和饲料中均未检出,表明其是内源性类固醇激素[12]。合成类类固醇激素CPTA、17α-BOL和19-NT检出率较高,除CPTA(ND~46 ng·g-1)外,浓度均较低(<0.74 ng·g-1)。甲壳类动物(虾和蟹)肌肉中(附表SI-4),共检出6种类固醇激素,浓度最高为11.1 ng·g-1(CRN),其他类固醇激素浓度均低于1.0 ng·g-1[60],可见,在甲壳类动物肌肉中检出的类固醇激素种类和浓度较鱼类更低,这是因为CRL在鱼肉中的贡献率较高[61]。同时,Liu等[54]研究发现,海洋软体动物中的类固醇激素种类(13种)较其他脊椎和甲壳类动物较多,其自身不能合成类固醇激素,表明海洋软体动物对类固醇激素具有较强的富集能力。目前,关于鱼体生殖腺中类固醇激素富集的研究较少[55],生殖腺中共检出3种雌激素,浓度范围从16.9 ng·g-1(E2)至78.5 ng·g-1(E3),与水和沉积物中的类固醇激素浓度有关。但是,研究者无法解释生殖腺中的类固醇激素浓度高于其在肌肉中浓度的现象,具体机理有待进一步研究[55]。
水体中类固醇激素的浓度可以显著影响鱼体组织中类固醇激素的浓度。与河流、河口或沿海水域的鱼体胆汁相比,暴露于污水处理厂受纳水体中的鱼胆汁中的类固醇激素浓度更高,尤其是合成类雌激素[62-63]。Yang等[64]发现,在E1浓度为 Liu等[4,60]评估了食用鱼类的风险,在国际粮食及农业组织联合会世界卫生组织食品添加剂专家委员会的指导原则中,可查到2种类固醇激素的人体每日允许摄入量(ADIs),其中,TTR为120 μg·d-1,P为1 800 μg·d-1,针对体重为60 kg的成年人,得出TTR和P的最大危险商数(the maximum hazard quotients, HQs)分别为5.8×10-4和9.9×10-5,远低于1,并未对人类健康构成威胁[60]。 以上研究表明,不同物种组织中类固醇激素的浓度分布和富集能力存在差异。鱼体组织中类固醇激素总浓度减少顺序为血浆>胆汁≥肌肉>肝脏,血浆和胆汁中大部分类固醇激素浓度显著高于其在肝脏和肌肉中的浓度[4,58,65-66]。甲壳动物(虾和蟹)中的类固醇激素总浓度低于鱼体。部分养殖场中仍存在非法使用合成类激素药物的现象。由于缺乏允许人体最大摄入量的相关标准且相关毒性数据有限,已报道的数据仅反映出某一区域的污染情况,不具备代表性,导致得出的结论并不完全符合真实情况,因此,仍需开展大量研究,进一步评估人类食用水产品是否具有潜在的健康风险。 环境中的类固醇激素,会发生吸附、迁移、转化和降解等过程,其在环境中的存在状态和环境行为与所处环境条件和类固醇激素物理化性质等有关。 类固醇激素进入环境后一般会快速吸附到沉积物中,逐步达到吸附-解吸平衡,后期通过微生物降解作用使其浓度逐渐降低。环境条件的变化会导致吸附在沉积物中的类固醇激素被再次释放,造成二次污染[67]。Holthaus等[68]研究发现,24 h内有80%~90%的E2β和EE2与河流底层沉积物相结合。其他研究者也发现,河流中的河床底泥能在24 h内吸收13%~92%的雌激素,在开始的0.5 h内,底泥对雌激素的吸附速率极高,随后逐渐下降[69]。Casey等[70]在农业土壤中开展TTR的吸附-降解实验,发现前5 h内水相中的TTR浓度由于吸附作用迅速下降,然后缓慢增加,这可能是由于已经吸附的TTR发生了解吸作用。可见,类固醇激素进入环境后可以快速与吸附剂结合,平衡时间和吸附速率与类固醇激素种类及吸附剂相关,且已经被吸附的类固醇激素也会发生解吸。 类固醇激素在土壤和沉积物中的吸附包括表面吸附和分配2种形式,吸附是物理吸附和化学吸附共同作用的过程,同时受到多种因素共同影响[71]。王磊等[72]综述了影响疏水性有机物非线性吸附的因素,发现土壤性质(极性、比表面积)和组成(黏土矿物和有机质)及外界因素(多价态离子)等均能影响疏水有机物吸附类型。不同的吸附类型可以采用不同的吸附模型来表示,例如,线性的吸附等温线说明吸附主要受疏水分配机制作用,非线性的等温线则说明吸附剂上的吸附位点存在能量差异,且吸附速率常数随着浓度的降低而降低。Bonin和Simpson[73]研究发现,E2β、E1和EE2在4种土壤样品和2种黏土矿物中的吸附等温线呈非线性关系,蒙脱石对雌激素的吸附作用强于高岭石和沙子,吸附作用受到有机碳含量和黏土矿物影响。然而,也有研究发现,TTR、E2β和EE2在土壤中的吸附等温线呈线性关系,疏水分配作用是主要的吸附机理[74]。Sangster等[75]发现,E2β、E1、P和TTR在硅质土壤和沙质沉积物中也是线性吸附,影响吸附的主要因素是有机碳含量和沉积物颗粒的粒径大小,其中有机碳含量的影响最大。 温度、pH和盐度是影响类固醇激素吸附的重要因素。Qi和Zhang[76]研究发现,低温和低pH有利于TTR吸附到3种不同粒径的土壤颗粒上,尤其是黏土颗粒(0.6~2 μm)。Ma等[77]研究发现,农业土壤和黏土矿物对TTR的吸附作用随着温度的升高而减弱。也有研究表明,针铁矿和高岭石悬浮液对EE2和E1的吸附几乎不受pH的影响[78],不同成分的沉积物对甲基睾酮(MT)的吸附也不受pH影响[79],这可能是pH值对不同类固醇激素的官能团和疏水性等影响存在较大差异导致的。Bowman等[80]研究盐度对E1和E2β吸附的影响,发现盐度未对E2β的吸附产生影响,但增强了E1的吸附。Ong等[79]在雄性化罗非鱼鱼塘中的沉积物中进行MT的间歇性吸附实验,发现线性吸附系数(Kd)值和吸附量随着盐浓度的增加而增加,这是因为在高盐度溶液中,MT的水溶解度降低从而引起“盐析效应”,导致析出的MT吸附到沉积物中。Noppe等[81]调查了法国北部斯凯尔特河中雌激素的含量,发现斯凯尔德河河口的E1浓度分布与盐度一样存在明显的梯度,因为盐度可以降低其在水中的溶解度。Braga等[82]研究也得到类似结果,深海污水排放口附近的类固醇激素在接触高离子浓度海水时溶解度下降,发生聚集并沉降到海底。 土壤胶体和黏土矿物种类也是影响类固醇激素吸附的重要因素。有研究指出,具有高吸附力和流动性的土壤胶体对TTR的吸附力是同等体积土壤的3倍,且随着粒径的减小而显著增加(P<0.05),同时解吸量随着土壤深度和水土比的增加而显著增加(P<0.05)[76]。此外,不同类型土壤对类固醇激素的吸附机制存在差异,例如沙子中TTR的主要吸附机制是静电引力,而其在黏土中则是氢键和官能团[76]。不同黏土矿物对类固醇激素的吸附存在差异,Van Emmerik等[83]研究发现,不同黏土矿物对E2β的吸附能力顺序为蒙脱石>高岭石>伊利石≥针铁矿,由于蒙脱石具有夹层空间,具有更好的膨胀性,因此更易吸附类固醇激素。与非膨胀性黏土如高岭石相比,膨胀性黏土对雌激素具有更强的吸附作用。Bonin和Simpson[73]设计了类固醇激素的竞争吸附实验,发现竞争吸附强度与有机碳和矿物含量有关,进一步表明土壤特性可以影响类固醇激素的吸附。 综上所述,类固醇激素进入环境后能快速达到吸附-解吸平衡,吸附剂种类和有机质含量是影响其吸附行为的最重要因素,同时,类固醇激素种类、土壤粒径、温度、pH、盐度、土壤胶体和黏土矿物种类等也可以影响其吸附行为。目前,关于类固醇激素的吸附研究集中于单一环境因素对吸附模型的影响,并未深入研究其吸附机制,今后研究工作应密切关注类固醇激素与吸附剂之间的分子水平作用机理。同时,应该与迁移及生物降解相结合,以合理解释环境中类固醇激素浓度虽然低,却在水生生态系统中一直被检出的现象。 进入环境后的类固醇激素,在地表径流和渗滤作用下,进入河流、地下水和海洋中,导致其在各种环境介质中均有检出。水平方向上,Williams等[84]对英国河流中的雌激素进行了监测,发现随着河水的流动,下游河水中的E1浓度下降幅度超过河水稀释作用后的浓度,表明雌激素在河水中发生了迁移。Isobe等[85]在东京湾的研究中发现,靠近污水排放点位置的雌激素浓度较高,随着离排放点距离的增加而逐渐降低,但是关于E2β比E1迁移更远的现象,研究者并未给出合理解释,因为E2β的logKoc值(3.71~4.12)比E1(3.40~3.81)更高,且据报道E2β在水体中易被氧化为E1[18],因此,造成这种结果的原因可能是类固醇激素的理化性质差异、潮汐作用和生物降解转化。Labadie和Budzinski[86]研究发现,大部分类固醇激素,尤其是E1的迁移距离在冬季会增加,表明类固醇激素迁移还受季节的影响。 类固醇激素在土壤的垂直断面方向也会发生迁移,合理解释了养殖场附近的井水中检测出多种类固醇激素的现象[9,12]。Labadie等[87]对乌兹河下游冲积层淡水位置和富含黏土的河口位置进行研究,发现在冲积层/黏土界面深度为-15 cm处E1浓度为28.8 ng·g-1,是表层浓度的9倍,而富含黏土的沉积物垂直断面中的E1浓度稳定下降。Sangsupan等[88]设计了室内迁移吸附试验,发现约50%的类固醇激素吸附在顶层10 cm的土层中,27%的E2β和42%的TTR可以通过土柱淋溶,这表明雌激素可以在疏松沉积物中发生迁移渗透到底层,从而污染地下水。Arnon等[89]研究了养牛场储污池下方的沉积物剖面的类固醇激素浓度分布情况,在深度为-45 m和-32 m的位置检测到了TTR和雌激素,采用对流、弥散和吸附模型均不能合理解释TTR和雌激素出现的深度,表明可能存在其他运输机制影响类固醇激素的转运,这些机制可能涉及类固醇激素和粪肥之间的相互作用以及优先路径,导致运输率增加。Steiner等[90]设计了E1和E2β的田间运输试验,证实了E1和E2β通过优选径流/大孔隙流路径进行迁移,胶体的存在也可以增强E1和E2β的迁移。类固醇激素共轭物也会发生迁移,Shrestha等[91]在猪场附近6.5~8.1 m深的地下水中检测到E2β-雌二醇-3-葡糖苷酸的浓度高达425 ng·L-1,环境中雌激素共轭物具有较高的水溶性和较强的流动性,虽然无明显的内分泌干扰效应,但是在一定条件下,雌激素共轭物可以解离成具有活性的自由态雌激素[91],故其是地表水和地下水中自由态雌激素的重要来源之一,应引起关注。 3.3.1 非生物降解 目前,关于类固醇激素的非生物降解(水解和光解)研究主要集中于雌激素,其中水解仅局限于对雌激素酸度系数(pKa)值的报道[92]。 类固醇激素的光降解作用可分为光分解和光催化。光分解是分子吸收光能后分解的过程,是去除污染物的一种绿色环保方式。据文献报道,直接采用太阳光可以降解E1、E2、E3和EE2,但去除效率较低,分解半衰期为40~75 d[93]。Caupos等[94]研究发现,光分解效率的顺序为日光<长波紫外线(UVA)<中波紫外线(UVB)<短波紫外线(UVC)。在UVC光照下30 min可以降解91.6%的EE2[95],而UVA光照下降解50%的E1则需要8 h。此外,实验条件如水基质、溶解性有机物(dissolved organic matter, DOM)、初始浓度和pH也能影响光分解的效率。Sornalingam等[96]归纳和总结了不同的实验条件下类固醇激素降解速率和动力学曲线的异同,发现不同基质中光分解速率顺序为Milli-Q水<河水<乙腈;DOM可能对光分解产生积极或消极影响,这取决于DOM对反应体系中氧自由基的影响;一定范围内,随着类固醇激素初始浓度的升高光分解速率下降;pH通过改变类固醇激素的表面电荷和反应体系中的氧自由基进而影响光分解,Chen等[97]研究发现,E3的光分解速率随着pH从6.0上升到8.0而缓慢增加,然后在pH从8.0升到10.0的过程中迅速增加。 光催化是通过光激活催化剂去分解化合物,用于克服光分解速率慢的缺点[96]。TiO2因具有低毒、廉价、化学稳定性、光稳定性及可降解范围广等特点,成为首选的光催化剂,ZnO是第二常用的光催化剂[98]。基质、DOM、初始浓度和pH对光催化作用与光分解作用相似。值得注意的是,pH对光催化的影响机制更复杂,由于常用催化剂TiO2是两性物质,pH为6.5时具有零点电荷,当pH值过高时,类固醇激素和催化剂同时带有负电荷而相互排斥,导致光解速率下降。类固醇激素共轭物的葡萄糖醛酸苷或硫酸盐部分也可以促进其光催化。例如,Mizuguchi等[99]以固定在玻璃珠上的TiO2对雌激素进行光催化降解,发现与E2β或E1相比,E2β或E1的共轭物降解速率更快。同时还发现,O3氧化和光催化的协同作用可以增加TTR降解和矿化速率[100]。掺杂催化剂似乎对类固醇激素的去除率影响不大,Coleman等[101]在固定的TiO2系统中对雌激素进行光催化降解,发现添加银或铂对雌激素的光催化降解没有影响,造成这种结果的原因可能是类固醇激素的浓度相对较低(0.8~2.3 mg·L-1),在掺杂催化剂之前存在的空穴和羟基自由基已经足够参与类固醇激素降解。可见,光催化剂可以提高光降解速率,但是与光分解相比,环境因子对光催化的影响机制更加复杂,亟需深入研究。除雌激素和部分雄激素外,其他几类类固醇激素的光降解研究几近空白,亟需开展大量研究。 3.3.2 生物降解 关于类固醇激素的生物降解研究,主要利用微生物(包括细菌、微藻和真菌)对其进行降解。在好氧条件下,活性污泥是研究微生物降解的良好载体。Chang等[5]采用活性污泥对9种雄激素和9种孕激素进行了好氧降解研究,降解半衰期(T1/2)分别为0.6~3.3 h和0.8~3.0 h。Liu等[102]采用活性污泥对P和左炔诺酮(LNG)降解,其降解速率较慢(T1/2=4.3 h, 12.5 h),可能是由二者的温度和反应体系等实验条件不同所引起。Liu等[35]在好氧条件下分别采用单菌和养猪场废水对P进行降解,T1/2分别为18.5 h和7.5 h,这可能归因于养殖废水中含有较多可以降解P的菌株,或含有可进一步降解P降解产物的菌株。Coulter和Talalay[103]研究了好氧条件下单菌对TTR的降解,首次提出了氧依赖型降解途径,即C9(10)位点C—C键断裂烷基化(9,10-seco途径),这是针对雄激素研究最广泛的好氧生物降解途径。Horinouchi等[104]发现了TTR在丛毛单胞菌和诺卡氏菌作用下同样可通过9,10-seco途径降解,首先将C17位的羟基转化为酮基,并在A环的C1位引入双键,随后在B环的C9(10)位羟基化使得A环芳构化,通过水解形成A环和B,C,D环2种化合物,上述降解过程均与5,3-酮类固醇异构酶、3α-脱氢酶和3β-脱氢酶相关。目前的研究主要集中在A环的降解,关于B,C,D环及侧链的详细降解途径有待深入研究。Peng等[105]发现斜生栅藻和蛋白核小球藻降解P的T1/2为16~39 h。同时也有研究报道,微藻Microchaete tenera可以降解P,降解速率与P的初始浓度、光照强度、温度以及CO2浓度等有关[106]。真菌也可以降解类固醇激素,白腐菌Trametes versicolor在5 h内可以将5 mg·L-1的E2降解至检出限以下,对混合雌激素同样具有降解作用,可显著降低雌激素活性[107]。 厌氧条件下,类固醇激素的降解则相对较慢。Zheng等[108]研究了厌氧条件下养殖场污水中3种天然雌激素E2α、E2β和E1的生物降解过程,发现经过52 d以后上述类固醇激素仍剩余77%~85%(初始浓度为5 mg·L-1),这与Ying等[109]的研究结果一致,即E2β、EE2在厌氧条件下降解70 d后,几乎没有变化。对于雌激素共轭物,厌氧降解速率同样显著低于好氧降解速率,且主要降解机制明显不同。在好氧条件下,17α-雌二醇-3-硫酸酯环的降解机制是C17位点的氧化,而厌氧条件下,则是C3位酯键的解偶联[110]。目前,已有研究者从厌氧环境中筛选出有效降解TTR的单菌:反硝化菌S. denitrificans DSMZ 13999和S. denitrificans DSMZ 18526,发现与好氧降解机制不同,厌氧条件下通过C2(3)位点C—C键断裂烷基化(2,3-seco)的途径实现雄激素的降解,这为在厌氧环境中去除类固醇激素提供了新思路[111-112]。以上研究表明,相比厌氧条件,在好氧条件下大部分类固醇激素更易降解,微生物降解速率增加顺序为真菌和微藻<单菌<混合菌。 目前,关于类固醇激素的转化研究相对较多,转化机理主要包括了羟基化(发生位点为9α、6β、11(α,β)、14β和16β等)、加氢还原(17C═O→17β-OH等)、去氢氧化(3β-OH→3C═O、17β-OH→17C═O等)、脱乙酰作用(—O-Ac→ —OH)、双键异构化及侧链断裂等[113]。 类固醇激素在环境中主要以自由态和共轭态的形式存在,在一定条件下2种形态可以相互转化。生物体内的类固醇激素通常会与葡萄糖醛酸或硫酸盐结合,导致它们与天然类固醇激素的性质存在较大差异。一方面,天然类固醇激素共轭物的极性比天然类固醇激素更强,这使得它们更有利于从人类和动物体内消除,另外一方面,与天然类固醇激素相比,其共轭物的活性相对较弱[18]。Gadd等[38]研究发现,与葡萄糖醛酸结合的雌激素易解离,这可能是大量的粪便细菌(大肠杆菌)产生了β-葡萄糖醛酸酶,其在下水道迁移过程中继续解离,导致自由态雌激素增加。Liu等[18]综述了雌激素及其共轭物在污水处理厂的去除方式,研究指出,污水处理厂对天然雌激素的去除不稳定,造成这种结果的原因可能是雌激素共轭物的解离,例如研究者发现污水处理厂中E1的去除率低于基于生物速率常数的预测值,估算出共轭态E2和共轭态E1对E1去除率降低这一结果的贡献至少占39%,远远大于直接从E2转化生成E1的量(22%),可见,雌激素共轭物对E1去除率降低起着重要作用。目前,已有研究者建立了多种孕激素共轭物的检测方法[114],关于雄激素和皮质激素共轭物的研究则鲜有报道[115],废水中类固醇激素共轭物的存在可能会影响污水处理厂对天然类固醇激素的去除效果,这是一个有趣的科学主题,但至今尚未得到解决。 不同类型的自由态类固醇激素之间也可以发生转化,如图5所示。Egorova等[116]证实了不同环境条件、不同微生物作用下AED、ADD、17α-BOL和TTR之间可以相互转化,其中,发现Mycobacterium sp. 2-4M不能降解9α-羟基雄甾-4-烯-3,17-二酮(9-OH-AD),但可以降解ADD,造成这种结果的原因是1(2)-脱氢酶的缺失和9α-羟化酶活性的存在。van der Geize等[117]在R. erythropolis SQ1中发现了2种1(2)-脱氢同工酶(命名为KSD1和KSD2)以及破坏编码2种酶的ksD基因,发现R. erythropolis SQ1菌株将AED转化为9-OH-AD,但未能继续降解9-OH-AD。同时还对该菌株中的9α-羟化酶进行了分子和基因的鉴定,该酶为双组分IA类单加氧酶,由KshA和KshB蛋白组成,破坏KshA基因后发现该菌株对谷甾醇的降解中未生成AED或ADD,破坏KshB基因后发现该菌株不能切割谷甾醇的侧链,表明9α-羟化酶在谷甾醇降解中起着重要作用[117]。C17β位点还原也是微生物对类固醇激素进行转化过程中的关键反应之一,其中17β-羟基脱氢酶控制着C17β位点的还原反应及其逆反应,并广泛存在于哺乳动物和微生物中,通过结构、反应底物、性质、功能和所在部位进行区分,目前在哺乳动物中至少报道了11种17β-羟基脱氢酶,一些属于短链醇脱氢酶或短链脱氢还原酶,其余的属于醛醇还原酶[118]。微生物中的17β-羟基脱氢酶则较少被分离和表征,研究较多的是来自于Comamonas testosteroni的2种3(17β)-羟基脱氢酶,第1种酶对C3位点和C17位点上的酮基发生还原及其逆反应,第2种酶仅作用于C18类类固醇激素且对C3β位点不产生作用,进而合理解释了C17类类固醇激素之间的相互转化[118]。Donova和Egorova[119]综述了微生物作用下类固醇激素转化的研究进展(包括母核氧化和羟基化),其中类固醇激素母核在9α-羟化酶和1-脱氢酶的作用下发生B环氧化,形成不稳定的1,4-二烯-9α-羟基类固醇激素中间体后自发破坏B环中的C9(10)键,然后母核进一步降解。类固醇激素羟基化是光能化中最重要的反应之一,目前已经报道出多种微生物能在类固醇激素母核或侧链的不同位置(C9α、C16α、C2α和侧链C25)引入一个或多个羟基[113],进而改变类固醇激素的极性和毒性。Arioli等[120]设计好氧条件下0.9%生理盐水-粪便悬浊液对类固醇激素的转化实验,发现AED与ADD和TTR在C1(2)位点和C17位点分别相互转化,同时AED也可以在C17位点去氢氧化为ET,ADD则可以与17β-BOL在C17位点通过去氢加氢作用相互转化,或者在C17位点加氢还原为17α-BOL。研究者还指出,ET和17α-BOL之间可以相互转化,但转化过程中的中间体仍需进一步确认。众多研究表明,谷甾醇在微生物作用下生成P,在C17位点发生羟基化作用生成17α-HP,继续经微生物作用,侧链断裂生成ADD,接着在C1(2)位点去氢氧化生成AED,这也解释了富含植物甾醇的造纸厂下游水体中ADD和AED浓度异常高的现象[14,41]。雌激素也能发生类似的转化,杨明等[71]综述了E2β、E2α和E1三者之间的转化关系,E2β易被微生物在C17位点去氢氧化为E1,而E1又可以在厌氧条件下通过C17位点羟基外消旋作用生成E2α。可见,深入研究类固醇激素的转化机理,不仅可以控制其环境污染,还可以实现微生物介导的商业化生产。 图5 有氧环境下类固醇激素之间的相互转化注:实线代表直接转化,虚线代表非直接转化。Fig. 5 Mutual transformation of steroid hormones in aerobic environmentNote: The solid lines gives the direct transformation while the dotted lines means the non-direct ones. 综合类固醇激素的污染现状及其环境行为,现有研究表明类固醇激素广泛存在于环境介质并对生物体构成潜在威胁。目前,关于类固醇激素的研究仍然存在以下不足: (1)环境中类固醇激素的研究主要局限于发达国家和较发达的发展中国家,而且以自由态及共轭态的雌激素为主,关于雄激素、孕激素、皮质激素及其共轭态的研究相对较少; (2)环境介质中类固醇激素的吸附、迁移、降解和转化机理的研究不成熟; (3)类固醇激素在各种生物体,尤其是哺乳动物和底栖动物中的含量水平与转化规律还不完全明确; (4)类固醇激素,尤其是立体异构体的毒性效应和毒性机理及其人体健康风险评估还不全面。 随着类固醇激素的广泛使用,需要进一步开展以下方面的研究。加强环境中类固醇激素的分布、迁移、降解和转化研究,尤其是东南亚、南美等地区的研究;利用先进的分析技术手段(如:高端色谱-质谱联用技术)建立不同环境介质及生物体中类固醇激素及其共轭态的检测方法,并把鱼体、牲畜和人体组织样品中类固醇激素的含量检测作为下一步研究重点;重新评估污水处理系统对类固醇激素的去除效率,综合考虑共轭态与自由态相互转化对去除效果的影响;采用组学等新技术研究多种类固醇激素共存的联合毒性效应,重点关注立体异构体的毒性效应,同时建立标准化测试技术体系,推导出预测无效应浓度(predicted no effect concentration, PNEC)值,为健康风险评估和决策制定提供毒性数据。3 类固醇激素的环境行为(Occurrence and fate of steroid hormones in the environment)
3.1 吸附
3.2 迁移
3.3 降解
3.4 转化

4 结论与展望(Conclusion and prospect)

