木犀草素与叶酸对黄曲霉毒素B1致食管上皮细胞毒性及MTHFR基因高甲基化的影响
付凌萌,吴 逸,王 菁,魏 婕,王少康,孙桂菊
(东南大学公共卫生学院营养与食品卫生学系,江苏 南京 210009)
黄曲霉素素B1(aflatoxin B1,AFB1)是常见的污染农作物的真菌毒素,广泛存在于谷物、油籽、坚果和香料中,其稳定性好,故难以在食品加热加工过程中被降解[1]。AFB1暴露可在器官中产生诸多不良反应,国际癌症研究机构将其划分为一类致癌物[2]。食管作为上消化道的一部分,不可避免地会接触AFB1这类外源性化学毒物,进而受到毒害作用。研究表明,AFB1污染食物是食管癌可能的危险因素[3-4]。
而相关研究显示,木犀草素可抑制黄曲霉毒素的产生[5],对黄曲霉毒素的毒性有抑制作用[6]。木犀草素(luteolin,LUT)是天然的黄酮类化合物,多以糖苷形式广泛存在于芹菜、青椒等蔬菜以及菊花、金银花等中草药中[7]。Resende等[8]研究多种黄酮类化合物对不同诱变剂的抗突变性,只有木犀草素对包括黄曲霉毒素在内的多种直接或间接诱变剂的诱变作用都具有保护作用,该保护作用可能与抑制活性物质的形成并防止细胞凋亡和DNA损伤有关[9]。木犀草素还可以保护食管,有抗食管肿瘤作用[10-11]。动物实验证实,叶酸(folic acid,FA)也经可减弱AFB1的毒害作用[12-13]。体外实验证明叶酸可抵抗AFB1的致突变性[14],叶酸作为人体必需的水溶性B族维生素之一,参与机体重要的生理活动,与细胞增殖、组织生长及机体发育密切相关。由于真核细胞本身不能够合成叶酸,体外获得充足的叶酸在机体发育的过程中于是变得尤为重要。FA也与食管癌的发生息息相关,多个研究表明FA是食管癌的保护因素[15-16]。有研究将木犀草素与叶酸缀合到超顺磁性氧化铁纳米颗粒,发现其对癌细胞有抑制作用,有望成为抗癌剂[17],由二者的抗肿瘤效应联想到二者对AFB1共同的抗毒效应。
故考虑到木犀草素与叶酸对黄曲霉毒素均有抑制作用,且二者均可保护食管不受危害,本研究用木犀草素与叶酸单独及联合干预经AFB1染毒的人正常食管上皮细胞(human normal esophageal epithelial cells,HEEC),检测细胞增殖、周期、凋亡及亚甲基四氢叶酸还原酶(5,10-methylenetetrahydrofolate reductase,MTHFR)蛋白表达水平及基因启动子CpG区的甲基化状态,阐明木犀草素和叶酸对AFB1的细胞毒性及表观遗传改变的影响,为二者协同降低AFB1对食管的毒性提供理论依据。
1 材料与方法
1.1 材料与试剂
人正常食管上皮细胞 上海中科院细胞库;AFB1(纯度≥98%) 德国Sigma公司;LUT(纯度≥98%) 上海阿拉丁生化科技股份有限公司;FA(纯度≥97%)、DMEM不完全高糖培养基 美国Gibco公司;双抗(青霉素、链霉素)、0.25%(质量分数)胰蛋白酶溶液、磷酸盐缓冲液(phosphate buffered saline,PBS) 美国Hyclone公司;特级胎牛血清 美国Clark公司;二甲基亚砜 南京博全科技有限公司;细胞活性检测试剂盒(cell counting kit-8,CCK-8) 上海翊圣生物公司;细胞周期检测试剂盒和Annexin V/碘化丙啶(propidium iodide,PI)双染凋亡检测试剂盒 南京凯基生物科技发展有限公司;二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量检测试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶制备试剂盒、HRP标记山羊抗兔 武汉谷歌生物科技;MTHFR抗体美国Abcam公司;GAPDH 碧云天生物技术有限公司;DNA提取试剂盒、DNA染料 北京百泰克生物技术有限公司;NaHSO3美国Zymo公司;引物 美国Thermo公司;EpiTYPER™ Reagent Kit 美国Agena公司。
1.2 仪器与设备
CO2恒温培养箱 美国Napco公司;RT-6000酶标分析仪 美国Rayto公司;IX51倒置相差显微镜 日本Olympus公司;Centrifuge小型台式高速冷冻离心机德国Eppendorf公司;NanoDrop2000超微量分光光度计美国Thermo公司;脱色摇床和电泳仪 北京六一仪器厂;垂直电泳槽 美国Bio-Rad公司;Inage Master VDS凝胶自动成像仪 瑞典Pharmacia公司;核酸自动提取仪北京百泰克生物技术有限公司;384-well SpectroCHIP®bioarray芯片、MassARRAY Nanodispenser点样机、MassARRAY Analyzer 4.0质谱仪 美国Agena公司。
1.3 方法
1.3.1 细胞培养
将HEEC接种于完全培养液(含质量分数10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的DMEM不完全高糖培养基)中,置于37 ℃、5% CO2恒温饱和湿度培养箱培养。每天用倒置显微镜观察细胞的生长情况,每天换液一次,传代2~3 d一次。细胞状态良好,处于对数生长期(融合度达80%)时即可进行实验。
1.3.2 AFB1对HEEC活力的影响
用CCK-8法检测AFB1染毒对细胞活力的影响,待细胞处于对数生长期时,胰酶消化离心,制成细胞悬液,计数6×104个/mL细胞接种于96 孔培养板,每孔悬液100 μL。培养24 h后分别加入AFB1浓度为0(空白对照组)、13、25、50、100、200 μmol/L的培养液染毒,每组设5 个平行孔。取3 板分别培养24、48、72 h后,每孔贴壁加入10 μL CCK-8工作液,于细胞培养箱内孵育3.5 h,终止培养,酶标仪测定450 nm波长处的OD值。细胞抑制率根据下式计算。

1.3.3 LUT与FA对AFB1染毒的HEEC的干预
取生长至对数生长期的细胞,分为7 组:空白对照组、染毒组(200 μmol/L AFB1)、LUT干预组(AFB1+LUT组:200 μmol/L AFB1+160 μmol/L LUT溶液)、FA干预组(AFB1+FA1组:200 μmol/L AFB1+20 μmol/L FA溶液;AFB1+FA2组:200 μmol/L AFB1+200 μmol/L FA溶液)、联合干预组(AFB1+LUT+FA1组:200 μmol/L AFB1+160 μmol/L LUT+20 μmol/L FA;AFB1+LUT+FA2组:200 μmol/L AFB1+160 μmol/L LUT+200 μmol/L FA的溶液),各组HEEC处理24 h后检测各项指标,每组重复测3 次。
1.3.3.1 CCK-8法检测细胞活力
同1.2.2节配成细胞悬液后计数6×104个/mL细胞接种于96 孔培养板,培养24 h后加入上述7 组培养液,每组设5 个平行孔。取3 板分别培养24 h后,后具体操作同1.2.2节。
1.3.3.2 流式细胞术检测细胞周期
各组处理细胞24 h后收集细胞,PBS洗涤2 遍(2 000 r/min离心5min)并调整细胞浓度为1×106个/mL,留少量上清液与细胞沉淀混匀,滴加体积分数70%乙醇迅速振摇混匀,于4 ℃固定过夜。2 000 r/min离心细胞5 min,吸弃上清液,用1 mL PBS重悬细胞,再离心洗涤细胞一次,吸弃上清液,加入100 μL RNase A 37 ℃水浴 30 min,再加入400 μL PI染色混匀,置暗处30 min后用流式细胞仪检测细胞周期。
1.3.3.3 流式细胞术检测细胞凋亡
各处理组培养24 h后用不含EDTA的胰酶消化收集不同处理的细胞。PBS洗涤2 遍(2 000 r/min离心5 min)并调整细胞浓度为1×105个/mL,加入500 μL的结合缓冲液悬浮细胞,加入5 μL Annexin V-FITC混匀后,加入5 μL PI混匀,置暗处15 min后用流式细胞仪检测凋亡率。
1.3.3.4 Western Blot检测MTHFR蛋白表达情况
参照Li Chao等[18]的方法,略作改动。各处理组培养24 h后,PBS冲洗细胞3 次,加裂解液裂解细胞3~5 min,收集冰浴30 min,期间反复吹打以确保细胞裂解完全。4 ℃ 12 000×g离心5 min,吸取上清液,用BCA法测定总蛋白浓度,然后配制8%(质量分数,下同)分离胶及5%浓缩胶,上样后进行SDS-PAGE分离、湿转法转膜过夜,用封闭液(5% BCA、TPBS配制)封闭,室温下脱色摇床缓慢摇动2 h。MTHFR抗体(1∶1 000)4 ℃脱色摇床缓慢孵育过夜。次日TBST清洗聚偏氟乙烯(poly(vinylidene fluoride),PVDF)膜3 次,每次10 min。加HRP标记的山羊抗兔IgG抗体(1∶3 000),室温下脱色摇床孵育30 min后,用TBST清洗PVDF膜3 次,每次10 min,配制化学发光混合液,浸没PVDF膜后适时曝光,条带采用Image J软件进行半定量灰度值分析。
1.3.3.5 MassARRAY甲基化检测HEEC的MTHFR基因启动子区甲基化情况
参照Zhu Yunyun等[19]的方法,略作改动。通过NCBI获得MTHFR基因序列及其启动子,利用CpG岛在线预测网站http∶//www.ebi.ac.uk/Tools/seqstats/emboss_cpgplot/预测其基因启动子区潜在的CpG岛,该段序列相对于转录起始位点的位置为4 812~5 405 bp,长度为594 bp,共33 个单位信息,覆盖49 个位点(图1)。用EpiDesigner软件进行引物设计,引物(5’端:AGGAAGAGAGGGAAGTGGTAGTTATTGGGAGTTATATT;3’端:CAGTAATA CGACTCACTATAGGGAGAAGGCTACAACACAAAAACCCCCTACAC)(表1)。用DNA提取试剂盒提取各处理组细胞DNA,用NaHSO3处理待检测DNA样品。聚合酶链式反应(polymerase chain reaction,PCR)法扩增目的基因片段,扩增程序:94 ℃ 4 min;94 ℃ 20 s,56 ℃ 30 s,72 ℃ 60 s,45 个循环;72 ℃3 min。虾碱性磷酸酶(shrimp alkaline phosphatase,SAP)混合液去除反应体系中游离的核苷酸,将PCR/SAP反应产物混合并在37 ℃孵育,进行3 h的体外转录和RNase A消化,随即进行芯片点样,用MALDI-TOF分析点样后的芯片,最后用EpiTYPERTM软件对原始数据进行评估和分析。

图1 MTHFR基因的CpG位点Fig. 1 CpG sites of MTHFR gene

表1 MTHFR引物信息Table 1 Information about primers used for MTHFR amplification
1.4 数据统计分析
数据统计分析采用SPSS 19.0软件,多组间数据比较采用单因素方差分析,事后两两比较采用Dunnett's t检验,P<0.05为显著性差异水准。
2 结果与分析
2.1 AFB1对HEEC活力的影响

图2 AFB1作用于HEEC不同时间的抑制率Fig. 2 Inhibition rates of AFB1 against HEEC at different culture times
由图2可知,HEEC经不同浓度的AFB1分别处理24、48 h和72 h后,细胞活力均被抑制。1~200 μmol/L范围内,细胞抑制率随着AFB1浓度的增加而升高,100、200 μmol/L AFB1处理组细胞抑制率极显著高于空白对照组(P<0.01),AFB1可以抑制HEEC的增殖,抑制率呈剂量依赖性升高,与Parveen等[20]研究AFB1对犬肾细胞毒性作用结果一致。同一浓度不同处理时间,AFB1低浓度(13、25、50 μmol/L)时抑制率与时间成反比,可能是细胞自我应激保护作用导致的[21]。而100、200 μmol/L AFB1处理组细胞的抑制率则随着作用时间的延长而升高。综合考虑剂量及处理时间对AFB1的影响,选择200 μmol/L建立细胞损伤模型。
2.2 LUT及FA对AFB1染毒的HEEC的影响
2.2.1 LUT及FA对AFB1染毒细胞增殖的影响

图3 LUT及FA对AFB1染毒HEEC增殖抑制的影响Fig. 3 Effects of LUT and FA on proliferation inhibition of AFB1-treated cells
如图3所示,AFB1+LUT、AFB1+LUT+FA1及AFB1+LUT+FA2组细胞抑制率显著低于染毒组(P<0.05),而单独使用FA干预(AFB1+FA1组、AFB1+FA2组),效果不显著(P>0.05)。AFB1+LUT组与AFB1+LUT+FA1组及AFB1+LUT+FA2组细胞抑制率差异无统计学意义(P>0.05)。在用LUT及FA干预后,含有LUT的组别抑制率均明显降低,提示LUT降低了AFB1对HEEC增殖的抑制,对AFB1抑制增殖有保护作用。
2.2.2 LUT及FA对AFB1染毒的HEEC细胞周期的影响


图4 LUT及FA对AFB1染毒的HEEC细胞周期的影响Fig. 4 Effects of LUT and FA on cell cycle of HEECs with AFB1 exposure
由图4a可知,AFB1可诱导HEEC周期发生改变,G0/G1期细胞比例升高(P<0.05),S期细胞比例降低(P<0.05),说明AFB1将HEEC阻滞于G0/G1期,抑制细胞分裂增殖,与Liu Caixia等[22]的研究结果一致。由图4b可知,与染毒组相比,LUT干预组、联合干预组G0/G1期细胞比例较染毒组显著降低(P<0.05),S期的细胞所占比例显著升高(P<0.05),减少了AFB1对细胞G0/G1期的阻滞作用。AFB1+LUT组与AFB1+LUT+FA1组及AFB1+LUT+FA2组各细胞周期占比差异无统计学意义(P>0.05)。说明LUT可减少G0/G1期的细胞,增加S期的细胞,减轻AFB1对细胞周期的阻滞作用。
2.2.3 LUT及FA对AFB1染毒HEEC细胞凋亡的影响


图5 LUT及FA对AFB1染毒的HEEC细胞凋亡的影响Fig. 5 Effects of LUT and FA on HEEC apoptosis induced by AFB1
由图5a可知,分析实验结果发现,染毒组细胞凋亡率显著高于空白对照组(P<0.05),表明AFB1促进HEEC凋亡。由图5b可知,LUT干预组、联合干预组细胞凋亡率虽然高于空白对照组(P<0.05),但显著低于AFB1染毒组(P<0.05),说明LUT及FA抑制了AFB1的促凋亡作用。虽然FA单独干预后的细胞凋亡率与染毒组无显著差异,但联合LUT后显著抑制了AFB1的促凋亡作用,且该联合效应强于LUT单独干预组(P<0.05)。
2.2.4 Western Blot检测MTHFR蛋白表达结果
由图6a可知,AFB1染毒可以上调HEEC的MTHFR蛋白的表达(P<0.05)。经LUT干预相比染毒组可下调细胞MTHFR蛋白表达(P<0.05)。由图6b可知,用FA进行干预,发现FA增强染毒细胞MTHFR蛋白的表达,20 μmol/L的FA干预能显著上调MTHFR蛋白表达(P<0.05);LUT联用不同浓度的FA干预能显著减弱AFB1对MTHFR蛋白表达的影响,作用强于LUT干预组(P<0.05)。

图6 LUT及FA对经AFB1染毒的HEEC的MTHFR蛋白表达影响Fig. 6 Effects of LUT and FA on the expression of MTHFR protein in AFB1-induced HEECs
2.2.5 MassARRAY甲基化检测HEEC的MTHFR基因启动子区甲基化情况
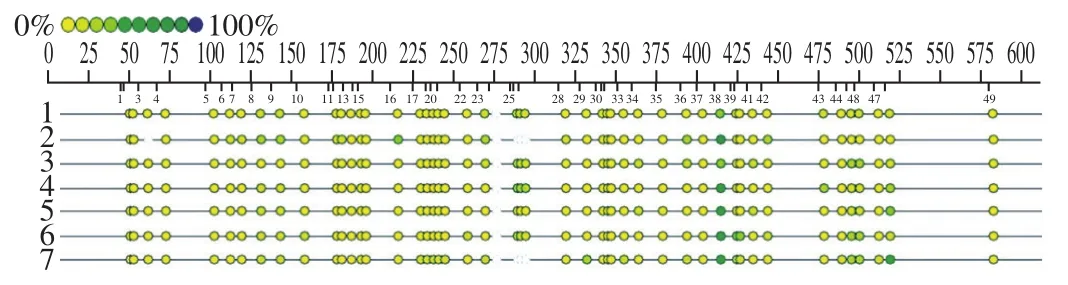
图7 MassARRAY甲基化检测结果Fig. 7 Results of MassARRAY methylation

表2 MassARRAY甲基化水平定量结果(n=3)Table 2 Quantitative results of MassARRAY methylation level (n= 3)
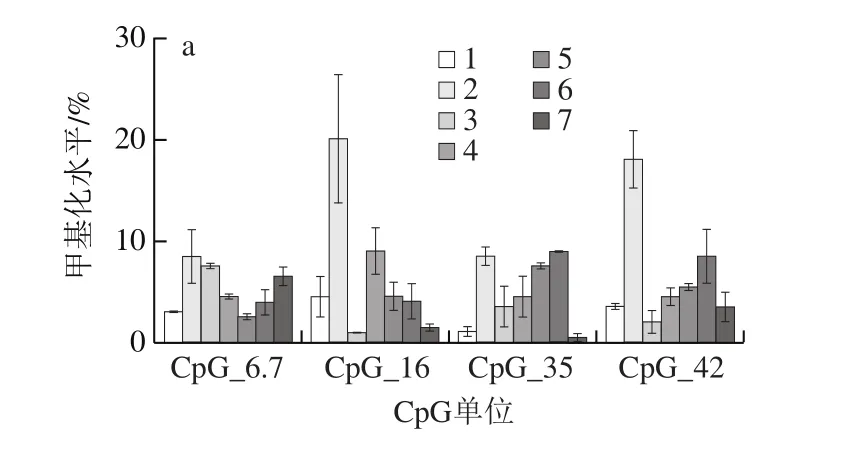
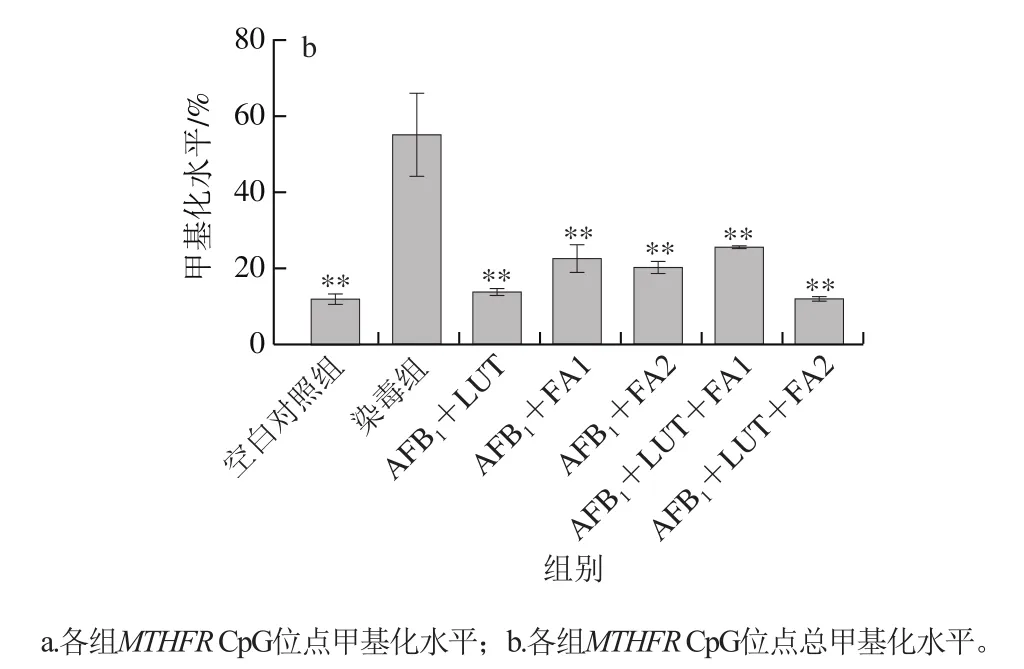
图8 甲基化水平升高的CpG单位的MassARRAY甲基化检测结果Fig. 8 Results of MassARRAY methylation for CpG units with elevated methylation levels
由表2及图7、8可知,本次共获得了29 个有效单位信息,包括43 个位点。这些CpG单位的甲基化水平范围是0.00~74.00%,经统计分析,除CpG_6.7、CpG_16、CpG_35、CpG_42位点外,其余位点甲基化水平在染毒组和空白对照组中的差异无统计学意义(P>0.05)。分析这几个位点的甲基化水平,结果显示染毒组甲基化水平显著高于空白对照组(P<0.05)。比较CpG_6.7位点的甲基化水平,染毒组细胞甲基化水平显著高于空白对照组(P<0.05),200 μmol/L FA组的甲基化水平显著低于染毒组(P<0.05);对于CpG_35位点,发现LUT组及LUT联用200 μmol/L FA干预组的甲基化水平显著低于染毒组(P<0.05),与空白对照组接近(P>0.05);对于CpG_16、CpG_42位点,各干预组干预效果显著(P<0.05)。分析各组4 个位点总的甲基化水平,染毒组细胞甲基化水平显著高于空白对照组(P<0.05),各干预组甲基化水平均相对染毒组降低(P<0.01)。
3 讨 论
AFB1具有急性毒性、慢性毒性及蓄积性致癌作用[23],伊朗一项研究发现AFB1污染是食管癌可能的危险因素,食管癌高风险区小麦粉中AFB1含量为(0.80±1.14) ng/g,显著高于低风险的(0.26±0.31)ng/g(P=0.003)[3]。同样的,在对江苏淮安食管癌高发区和山东桓台食管癌低发区进行的调查研究发现,食管癌高发区淮安地区玉米样品中AFB1含量为13.5 μg/kg,远高于食管癌低发区桓台的1.3 μg/kg(P<0.05),而根据食物频率法调查AFB1的膳食摄入量,淮安地区为1.723(0.242~49.772)μg/kg,桓台为0.397(0.267~1.218)μg/kg,食管癌高发区的外暴露量远高于低发区(P<0.05),说明食管癌的发生与AFB1有关[4]。因此,探讨AFB1对食管细胞的毒性作用对AFB1毒性的防控有重要意义。
多个研究表明由于细胞种类不同,AFB1对细胞周期的影响体现在不同阶段,导致HepG2细胞停滞于S期和G2期[24],增加人支气管上皮细胞中S期细胞数量[25]。细胞周期的阻滞导致细胞增殖的抑制[26],故本研究中AFB1通过将细胞周期阻滞于G0/G1期,进而抑制细胞增殖。而LUT的干预可减少G0/G1期的细胞,增加S期的细胞,减轻AFB1对周期的阻滞作用,从而相对增加细胞增殖。
细胞凋亡是细胞的程序性死亡,它的启动可通过两种基本途径:外在和内在途径。外在途径由死亡受体启动,内在途径由线粒体或溶酶体透化介导[27]。AFB1诱导细胞凋亡可能与线粒体功能受损有关[28-29]。有研究表明,AFB1通过诱导氧化应激,减少细胞线粒体含量和增强Bax、caspase-3、p53表达导致精子细胞线粒体依赖性细胞凋亡[30]。而也有研究显示,LUT可通过抑制细胞凋亡等作用减轻乙酰氨基酚诱导的 L02 肝细胞损伤[31]。本实验中AFB1增强了HEEC的凋亡,LUT以及LUT联合FA可以减少这种凋亡,且两者联合作用强于LUT单独作用。表明LUT及二者联合可以通过抑制细胞凋亡保护HEEC。
MTHFR是叶酸代谢途径中的关键酶[32],它将5,10-亚甲基四氢叶酸不可逆地催化转化为5-甲基四氢叶酸,而后者又是循环叶酸的主要形式,它将甲硫氨酸转换为S-腺苷甲硫氨酸,S-腺苷甲硫氨酸用于细胞内各的甲基化反应的供体,特别是DNA甲基化[33]。而膳食AFB1暴露可能导致DNA甲基化的改变[34]。DNA甲基化在基因调控中起重要作用,如参与基因表达,影响染色质构型和DNA的结构稳定性、转录因子与其他蛋白质的结合,导致X染色体失活,致衰老和致癌作用[35]。DNA甲基化是一种表观遗传修饰,其包括在CpG二核苷酸的胞嘧啶中添加甲基。这些CpG二核苷酸主要位于CpG岛上,其主要聚集在蛋白质编码基因的启动子区域周围[36]。有研究表明MTHFR基因与AFB1在癌症形成过程中可能有着密切联系[37],且其甲基化与食管肿瘤发生密切相关[38],故本研究在AFB1对人食管上皮细胞的染毒及LUT、FA的干预实验中检测了MTHFR基因启动子CpG区的甲基化状态,以阐明AFB1所致的表观遗传改变以及LUT、FA对该表观遗传改变的影响。
MassARRAY是近年来新出现的DNA甲基化定量检测方法。它比亚硫酸氢盐测序PCR(BSP)能更有效地反映低甲基化区域的真实甲基化水平,它可以检测到低至5%的甲基化水平[39],故而能更准确的定量甲基化水平。本研究采用该方法检测了MTHFR启动子区甲基化水平,发现经AFB1染毒后多个位点甲基化水平高于空白对照组,而经LUT及FA干预后,甲基化水平有所下降。甲基化水平的升高与诸多疾病的发生有关,特别是癌症。Xia Fada等[40]的研究13 种癌组织miR-204启动子区的甲基化水平,发现13 种癌组织中该基因甲基化率均高于正常组织。MTHFR甲基化水平与哈萨克族食管癌的相关性研究中,病例组MTHFR基因的甲基化率高于空白对照组(P<0.05),提示MTHFR基因的甲基化与食管癌的发生有密切的关系[41]。本研究用AFB1染毒HEEC,MTHFR甲基化升高,表明MTHFR在AFB1对食管的作用中起到了一定的作用。DNA甲基化后,基因序列保持不变,但不同的甲基化表达水平可能会起到不同的作用。这种修饰反应经常发生在富含CG序列的二核苷酸中,其结构与支持染色体,胚胎发育,细胞记忆和衰老的结构密切相关。研究DNA甲基化在肿瘤风险的预防,早期诊断和预后发展的临床评价有重要的指导作用[42]。本研究FA虽在周期凋亡中未对AFB1染毒产生的相关变化,在MTHFR高甲基化上和LUT体现了同样的干预作用,且联合作用较强,体现了二者在AFB1的毒性作用中的抑制作用,一定程度上阻止了食管毒性向癌症的转化。
本研究结果显示AFB1上调了MTHFR的蛋白表达,LUT可以下调MTHFR蛋白的上调,而FA则是相反的作用,和LUT联合后该相反的作用消失。研究表明,MTHFR基因多态性可以影响MTHFR的活性及稳定性,进而影响叶酸的正常代谢[41]。参考该研究,推测MTHFR的高甲基化影响蛋白表达,甲基化水平升高的MTHFR蛋白导致叶酸代谢紊乱,从而导致叶酸干预的反向作用,而联用LUT则纠正了其对叶酸代谢的影响,对MTHFR蛋白的上调不再是继续上调而是下调,使叶酸的正向干预作用得以显现。而Kim等[43]的研究也证明叶酸有双重调节作用。
综上,本研究发现AFB1抑制HEEC的增殖,阻滞其周期,促进凋亡,LUT对这些毒性作用有相应的改善;在AFB1可引起MTHFR高甲基化,LUT与FA及二者联合均可降低升高的甲基化水平,对该表观遗传改变具有调节作用,体现了抗AFB1毒性作用;MTHFR高甲基化的同时,蛋白表达水平也有所上调,LUT可以减少上调,改善AFB1对MTHFR蛋白表达的影响,而FA体现的是反向调节作用,考虑是MTHFR基因高甲基化导致的叶酸代谢紊乱,对其确认及机制的探讨有待进一步研究。

