乳酸菌细菌素Durancin GL对单增李斯特菌的抗菌活性及机制
吴学友,朱 悦,陈正行,鞠兴荣,
(1.江南大学食品学院,粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;2.南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏省粮油质量安全控制及深加工重点实验室,江苏 南京 210023)
单核细胞增生性李斯特菌(简称单增李斯特菌)是一种食源性病原菌,其广泛存在于水、土壤、植物中[1]。该菌可污染牛奶[2]、肉制品[3]、蔬菜[4]等食品,在加工、运输和冷藏条件下均可生长[5]。单增李斯特菌是人畜共患菌,可引起人和动物脑膜炎、败血症、胃肠炎等疾病,威胁人类生命与健康[6-7]。此外,研究发现单增李斯特菌可形成生物膜[8],该结构影响了化学防腐剂的抑菌效果,给食品加工带来难题。此外,化学防腐剂的安全隐患以及抗生素耐药菌的大量出现越来越受到人们重视。因此,寻找新型天然绿色安全的抑菌物质已经迫在眉睫。
乳酸菌是公认的食品级安全微生物,广泛应用于食品工业,尤其是乳制品行业。细菌素是由细菌核糖体合成并分泌至细胞外的一类具有抗菌活性的蛋白质(多肽)[9-10]。研究发现其对目标菌的抑制具有浓度低、效价高等特点,且目标菌不会产生耐药性[11]。乳酸菌产生的细菌素本身就存在于食品基质中,其来源明确,安全可靠;应用于食品防腐保鲜具有独特优势以及极大潜力[12]。近年来,不同来源新型细菌素的研究与挖掘受到科研工作者的广泛关注,众多新型细菌素陆续见诸报道[13-16]。这些细菌素抑制目标微生物的机理研究也有相关报道,如Nisin[17-18]、Pediocin Pa-1[17,19-20]、Plantaricin 163[21]等。Nisin是目前研究最为透彻的细菌素,自1957年首次商业应用以来已有60余年且成效显著[22],开展新型细菌素的发掘以及阐释其抑制目标菌相关机理具有重大的价值。
研究发现,肠球菌及其产生的细菌素对单增李斯特菌具有良好的抑制作用[23-26]。乳酸菌细菌素Durancin GL是由干酪制品中肠球菌产生的一种新型细菌素,本课题组前期研究发现,该细菌素由43 个氨基酸组成,且N-端含有保守序列YYGNG[27],具有良好的理化稳定性,如经吐温、玻雷吉和十二烷基硫酸钠等表面活性剂处理后其抑菌活性保持不变,且在pH 2~11范围内或经100 ℃处理30 min仍保持活性[28]。此外,Durancin GL对单增李斯特菌具有较强的抑制作用,包括抗Nisin的L. monocytogenes NR30[29]。为了充分认识该新型细菌素对单增李斯特菌抗菌活性、探索抑制单增李斯特菌相关机理,本研究通过最小抑菌浓度(minimum inhibitory concentration, MIC)和杀菌动力学考察Durancin GL对单增李斯特菌的抑制作用,结合监测胞内物质泄漏、菌体存活情况以及形态学分析探讨Durancin GL对单增李斯特菌的抑制机制。
1 材料与方法
1.1 材料与试剂
Durancin GL表达载体由本实验室自行构建[27];pGEX-P-1载体 美国GE公司;单增李斯特菌L. monocytogenes Scott A 江苏省疾病预防控制中心;表达菌株Escherichia coli Rosetta(DE3)、表达载体pGEX/his-durAB、细菌基础培养基、脑心浸液(brian heart infusion,BHI)培养基 北京陆桥技术股份有限公司;LIVE/DEAD BacLight Bacterial Viability Kit美国Thermo Fisher Scientific公司;其他试剂均为分析纯国药集团化学试剂有限公司。
1.2 仪器与设备
微型台式冷冻离心机 美国Thermo Fisher Scientific公司;AKTA蛋白纯化系统 美国GE公司;M2e酶标仪 美谷分子仪器(上海)有限公司;FE32 DDS-电导率仪 德国Meitele-Tuoliduo公司;UV-1800紫外分光光度计 日本岛津公司;GeminiSEM 300扫描电子显微镜 德国Carl Zeiss公司;JEM-2100透射电子显微镜日本Hitachi公司。
1.3 方法
1.3.1 Durancin GL的外源表达及制备
将本实验室构建的表达载体pGEX/his-durAB转入表达菌株E. coli Rosetta(DE3)中,参考Ju Xingrong等[29]的方法,在5 L Jupiter生物反应器中制备Durancin GL,生物反应器运行参数为:装液量为2.5 L,温度37 ℃,搅拌转速300 r/min,无菌空气流速为0.5 L/min。每隔一段时间检测生物反应器中菌体质量浓度、pH值、上清液以及细胞破碎液中细菌素的效价。参考文献[30]将制备的细菌素经梯度稀释,通过琼脂扩散法检测其对单增李斯特菌的抑菌效果,以抑菌圈直径不小于2 mm为具有抑菌效果,用有抑菌效果的最高稀释倍数表示细菌素的效价。发酵结束后,菌液于4 ℃下10 000×g离心15 min,弃上清液,反复洗涤菌体沉淀后采用液氮冷冻,经细胞破碎仪处理,再次于4 ℃下10 000×g离心15 min,取上清液,利用AKTA蛋白纯化系统,借助亲和层析柱GE GSTrap 4B分离纯化细菌素,再经肠激酶切除标签,再次重复这一步骤去除标签蛋白后,经冷冻干燥即制得乳酸菌细菌素Durancin GL冻干粉,于-20 ℃保存备用。
1.3.2 MIC的测定
MIC定义为抗菌剂可以抑制经过夜培养的微生物出现可见生长的最低质量浓度[31]。将制备的细菌素配制系列梯度溶液,通过琼脂扩散法检测其对单增李斯特菌的抑菌效果,以抑菌圈直径不小于2 mm为具有抑菌效果,以有抑菌效果的最低细菌素溶液质量浓度作为外源表达细菌素对单增李斯特菌的MIC,单位为mg/L。实验重复5 次。
1.3.3 Durancin GL对单增李斯特菌生长曲线、OD值和pH值的影响
以体积分数1%向经121 ℃、15 min灭菌处理过的BHI液体培养基中接种单增李斯特菌,置于37 ℃恒温培养箱中,以150 r/min摇动培养。每隔一定时间检测菌体生长情况(以600 nm波长处菌液的OD值表示),在对数生长期加入乳酸菌细菌素Durancin GL(终浓度为50 AU/mL),绘制单增李斯特菌生长曲线,以加入等量无菌水的实验组作为对照。菌液OD值和pH值分别采用分光光度计和pH计进行测定。实验重复3 次,取平均值。
1.3.4 Durancin GL对单增李斯特菌电导率、OD260nm和OD280nm的影响
单增李斯特菌的培养方法同1.3.3节,OD600nm=0.6时,经4 ℃下8 000×g离心15 min收集菌体沉淀,用50 mmol/L磷酸钾缓冲液(pH 6.0)洗涤细胞3 次,菌体沉淀重悬于200 μL 50 mmol/L磷酸钾缓冲液(pH 6.0),使其OD600nm=0.4,加入乳酸菌细菌素Durancin GL(终浓度为50 AU/mL),每隔一段时间取样一次,4 ℃、8 000×g离心15 min,用电导仪测定上清液的电导率。用分光光度计测定上清液OD260nm、OD280nm。以添加等量50 mmol/L磷酸钾缓冲液(pH 6.0)处理组为对照。实验重复3 次,取平均值。
1.3.6 Durancin GL对单增李斯特菌存活率的影响
参考文献[32]的方法并略修改,具体操作如下。当监测到单增李斯特菌已处于对数生长期后期时,向体系内加乳酸菌细菌素Durancin GL(终浓度为50 AU/mL),继续培养5 min,经4 ℃、10 000×g离心15 min收集菌体沉淀,取适量沉淀重悬于20 mL质量分数0.85% NaCl溶液中,孵育1 h,每隔15 min混匀溶液1 次,经4 ℃下10 000×g离心15 min收集菌体沉淀,再次重悬于质量分数0.85% NaCl溶液中制备单增李斯特菌菌悬液(OD670nm=0.03~0.30)。取1 μL该菌悬液加入3 μL试剂盒中组分A与组分B等体积混合物,在室温下黑暗环境中孵育15 min,立即转入倒置荧光显微镜,选择激发波长485 nm,分别在530 nm(绿色)和630 nm(红色)波长处观察拍照。对照组为未经乳酸菌细菌素Durancin GL处理的单增李斯特菌。
1.3.7 扫描电子显微镜和透射电子显微镜观察
通过扫描电子显微镜和透射电子显微镜观察Durancin GL对单增李斯特菌的细胞损伤。以体积分数1%向经121 ℃、15 min灭菌处理过的BHI液体培养基中接种单增李斯特菌,置于37 ℃恒温培养箱中,以150 r/min摇动培养。当监测到单增李斯特菌处于对数生长期时,向体系中加入乳酸菌细菌素Durancin GL(终浓度为50 AU/mL),继续培养5 min,4 ℃、1 500×g离心35 min收集菌体沉淀,参照文献[33]的方法对菌体进行前处理,并通过扫描电子显微镜和透射电子显微镜观察菌体形态和内部结构。对照组为未添加乳酸菌细菌素Durancin GL处理的单增李斯特菌。
1.4 数据统计与分析
实验结果表示为平均值±标准差,采用SPSS 25.0软件进行数据处理与分析,采用单因素方差分析结合Duncan's法检验差异显著性。
2 结果与分析
2.1 Durancin GL的外源表达及对单增李斯特菌的MIC

图1 重组菌生长与细菌素的积累Fig. 1 Growth of recombinant bacterium and bacteriocin accumulation
大肠杆菌原核表达系统因其高效易纯化的优点,被广泛应用于目的蛋白质的外源表达。从图1可以看出,重组菌进入对数生长期后,细菌素表达开始累积,发酵上清液与菌体破碎液中Durancin GL效价测定结果显示两者差异极大,表达的细菌素Durancin GL主要位于大肠杆菌细胞内。经测定,本实验制备的乳酸菌细菌素Durancin GL对单增李斯特菌L. monocytogenes Scott A的MIC为(2.5±0.4)mg/L。
2.2 Durancin GL对单增李斯特菌生长曲线的影响

图2 Durancin GL对单增李斯特菌生长曲线的影响Fig. 2 Effect of durancin GL on growth curve of L. monocytogenes
图2 为乳酸菌细菌素Durancin GL对单增李斯特菌生长曲线的影响,即抑菌动力学曲线。在对数生长期,向培养体系中添加乳酸菌细菌素Durancin GL后,实验组中OD600nm暂停增加,说明单增李斯特菌生长受抑制。添加乳酸菌细菌素Durancin GL后,实验组菌落总数开始下降,表明单增李斯特菌活菌数量减少。随后因细菌素被消耗,大肠杆菌增长速率超过被抑制速率,表现出菌体总数的增加。杜贺超等[21]研究中使用的细菌素剂量更高,其结果显示目标细菌大量死亡。
2.3 Durancin GL对单增李斯特菌细胞膜通透性的影响
菌体细胞膜通透性可以通过电导率的改变进行观察。在培养期间,添加磷酸钾缓冲液的对照组电导率变化不显著,乳酸菌细菌素Durancin GL处理组电导率随着时间延长而增大(图3),推测乳酸菌细菌素Durancin GL处理的单增李斯特菌膜通透性变大,导致菌体胞内物质流出,引起上清液电导率的增加。

图3 Durancin GL对单增李斯特菌电导率的影响Fig. 3 Effect of durancin GL on electrical conductivity of L. monocytogenes
2.4 Durancin GL对单增李斯特菌细胞膜完整性的影响
上清液的OD260nm、OD280nm反映了单增李斯特菌膜对蛋白及核酸大分子的通透性,进而能够反映细胞膜完整性的变化。如图4所示,在2 h培养时间内,对照组的OD260nm和OD280nm基本保持不变,乳酸菌细菌素Durancin GL处理的单增李斯特菌OD260nm和OD280nm随着时间延长不断增大,在1.5 h时均达到最大值0.2。上清液中OD260nm和OD280nm的增加表明乳酸菌细菌素Durancin GL能破坏细胞膜,使单增李斯特菌细胞中的大分子物质外流,细胞生长代谢受到影响。这说明乳酸菌细菌素Durancin GL不仅能提高单增李斯特菌细胞膜通透性,而且能破坏细胞膜的完整性。
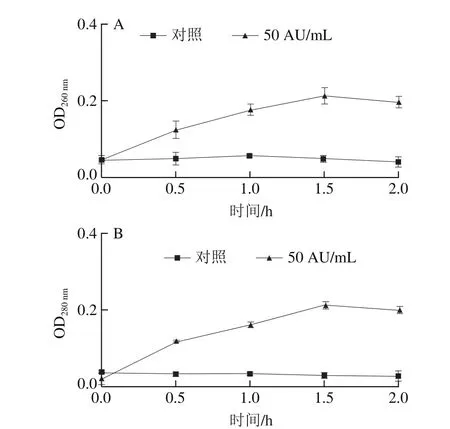
图4 Durancin GL对单增李斯特菌OD260 nm(A)和OD280 nm(B)的影响Fig. 4 Effect of durancin GL on optimal density of L. monocytogenes at 260 nm (A) and 280 nm (B)
2.5 Durancin GL对单增李斯特菌存活率的影响
LIVE/DEAD BacLight Kit常用于快速检测细菌细胞存活率[33],近年来应用越来越广泛。利用荧光探针检测乳酸菌细菌素Durancin GL对单增李斯特菌存活情况的影响,绿色代表活菌体,红色代表死菌体。从结果中可以看出,未经乳酸菌细菌素Durancin GL处理的单增李斯特菌生长状态良好(图5A),乳酸菌细菌素Durancin GL可以导致单增李斯特菌部分死亡(图5B)。图5结果直观反映了细菌素Durancin GL对单增李斯特菌的影响,因该方法是通过荧光探针的荧光信号来反映Durancin GL处理后单增李斯特菌细胞膜通透性的变化,而细胞膜通透性的增加不一定会导致细胞死亡,因此,细菌素Durancin GL作用于单增李斯特菌后细胞存活情况的检测采用平板计数法更为准确(图2)。

图5 Durancin GL对单增李斯特菌存活情况的影响Fig. 5 Effect of durancin GL on survival of L. monocytogenes
2.6 Durancin GL对单增李斯特菌形态和结构的影响
采用扫描电子显微镜和透射电子显微镜观察单增李斯特菌的外部形态及内部结构。扫描电子显微镜观察结果显示,未经乳酸菌细菌素Durancin GL处理的单增李斯特菌呈杆状,表面光滑且饱满(图6A);细菌素Durancin GL处理的单增李斯特菌菌体表面凹陷、有褶皱(图6B)。

图6 Durancin GL对单增李斯特菌形态和结构影响的扫描电子显微镜图Fig. 6 Effect of durancin GL on morphology and structure of L. monocytogenes observed by scanning electron microscopy

图7 Durancin GL对单增李斯特菌形态和结构影响的透射电子显微镜图Fig. 7 Effect of durancin GL on morphology and structure of L. monocytogenes observed by transmission electron microscopy
透射电子显微镜观察结果可以看出,未经处理的单增李斯特菌菌体结构致密,内部及细胞膜完整(图7A);乳酸菌细菌素Durancin GL处理后,观察到单增李斯特菌菌体结构疏松,胞内透亮(图7B),说明细胞质已外流,说明乳酸菌细菌素Durancin GL对单增李斯特菌的内部结构及外部形态均造成影响。结合图3~7结果,推断是乳酸菌细菌素Durancin GL与单增李斯特菌细胞表面受体结合后引起的某些物质交换或者结构变化,造成细胞通透性增加,进而影响细胞功能与形态,导致菌体细胞死亡。
3 讨 论
本研究通过将实验室构建的表达载体pGEX/his-durAB转入表达菌株E. coli Rosetta(DE3)中,在5 L发酵罐中外源表达、制备乳酸菌细菌素Durancin GL。其对单增李斯特菌的MIC为(2.5±0.4)mg/L。考虑到制备后的细菌素冻存保藏,每次取用时需要重新测定其效价,为此本研究依然采用效价作为评价实验中使用的细菌素活性标准。在前期研究中发现制备的乳酸菌细菌素Durancin GL效价为50 AU/mL时,对单增李斯特菌具有较好的抑制效果。
研究通过对乳酸菌细菌素Durancin GL抑制单增李斯特菌活性及其机制的探讨,明确了Durancin GL对单增李斯特菌的抑制效果,该细菌素作用于单增李斯特菌时,OD260nm与OD280nm检测结果说明胞内蛋白质类和核酸类释放到细胞外环境中。一方面,细菌素引起菌体细胞透性的增加,导致物质释放;另一方面,随着胞内物质的释放,菌体细胞裂解死亡,从而加剧胞内物质的释放,随之使菌体的形态(胞内、胞外)均发生改变。杜贺超等[21]对细菌素Plantaricin 163抑制热杀索丝菌作用机制的研究,以及刘国荣等[34]对双歧杆菌细菌素Bifidocin A抑制大肠杆菌作用机理的研究均得到类似结论,这与已见报道的Ⅱa类细菌素作用机制[35-36]较为一致。
微生物污染是食品工业中最重大的安全问题,控制及消灭微生物技术的探索一直未曾间断。在化学防腐剂被逐渐舍弃的未来,食品级来源的乳酸菌细菌素潜力无限。更安全和更可持续发展是食品产业链对于未来发展的清晰定位,食品级乳酸菌细菌素作为防腐保鲜剂防止微生物污染、提高食品安全性是非常值得称赞的应用趋势[37]。为此,深入、全面、透彻地认知细菌素抑制目标菌的机理机制,将为细菌素早日应用提供重要保障。

