白细胞介素12在肝癌中的差异表达及生物信息学分析*
张 莉 翟 蕙 李文静 刘传苗
蚌埠医学院第一附属医院感染性疾病科,安徽省蚌埠市 233000
肝细胞肝癌(Hepatocellular carcinoma,HCC)是一种恶性程度高、易转移、易复发的恶性肿瘤,危害人体健康,其致死率在各种癌症死亡率中排第三位[1]。近年来,越来越多的研究关注于肝细胞肝癌发生的分子机制,但目前仍然尚不十分清楚。由于肝细胞癌早期症状和临床体征不明显,并且由于其发病具有隐匿性、病程进展迅速,因而大多数患者在确诊时已是癌症晚期,所以预后差、生存率低。因此,提高早期诊断率对于提高患者的预后具有重要意义。开展肝癌早期诊断和治疗的关键分子机制的研究对于降低肝癌死亡率具有重要意义。白细胞介素12(Interleukin-12,IL-12)是趋化因子家族的一种细胞因子,具有免疫调节作用。其是由一条35kDa(被称为p35)和一条40kDa(被称为p40)的肽链通过二硫键连接在一起,组成的异源二聚体。其中p35链由IL12A(Interleukin 12A)基因编码,p40链由IL12B(Interleukin 12B)基因编码。目前IL-12被认为是潜在的抗肿瘤免疫治疗的有效细胞因子之一。其抑癌机制主要是通过对肿瘤的微环境进行免疫调节,抑制肿瘤周围血管的生成,进而减少肿瘤细胞的营养供应[2]。目前对于IL-12在肝癌中的研究较少,还没有对IL12A和IL12B基因在肝癌中的系统分析,因此本研究在通过生物信息学的方法分析IL-12相关基因在肝癌中的表达情况以及对癌症预后的价值。
1 资料与方法
1.1 数据来源 本研究所分析的数据来源于肿瘤基因组图谱计划(The Cancer Genome Atlas,TCGA)数据库中的肝癌样本(Liver Hepatocellular Carcinoma,LIHC)的数据[3]。LIHC数据包括了371例原发性肝癌组织样本和50例正常肝组织样本。其中肝癌患者包括男245例,女117例;21~40岁患者27例,41~60岁患者140例,61~80岁患者181例,81~100岁患者10例;肝癌Ⅰ期患者168例,Ⅱ期84例,Ⅲ期82例,Ⅳ期6例。因为部分患者缺失性别信息、年龄信息,或者无法准确进行癌症分期,所以没有纳入分组统计分析中。
1.2 研究方法 本研究使用Ualcan(http://ualcan.path.uab.edu)在线工具[4]分析肝癌组织和正常肝脏组织IL12A和IL12B的表达差异,对于存在差异表达的基因进行不同性别、年龄、癌症分期的分组表达分析,同时分析其甲基化水平的差异。对于有差异表达的基因,分析与之相关表达的基因,同时对共表达基因使用DAVID在线分析工具(https://david.ncifcrf.gov/)[5]做GO(Gene Ontology)富集分析、KEGG(Kyoto Encyclopedia of Genes and Genomes)通路分析。对于差异表达的基因,使用Kaplan-Meier生存分析法分析患者的生存时间及生存率,并绘制表达水平与预后生存曲线。
1.3 统计学方法 IL12A和IL12B基因的表达水平用四分位数进行表示,中间的四分位数就是该基因表达的中位数,基因表达数据在文章中以“中位数(四分位间距)”,即[M(P25,P75)]格式表示,在图形中以箱线图的形式表示,对于多组之间的比较采用秩和检验。对于GO富集分析和KEGG通路分析采用Fisher精确检验。对于不同表达水平的生存差异,采用Log-rank检验。P<0.05为差异具有统计学意义。在文中分别以*表示P<0.05,**表示P<0.01,***表示P<0.001。
2 结果
2.1 IL12A和IL12B在肝癌组织和正常肝脏组织的表达情况 基于TCGA数据库,IL12A基因在正常的肝脏组织中的转录本表达量(Transcript per million,TPM)为0.033(0.018,0.056),在肝癌组织中的转录本表达量为0.077(0.028,0.162);肝癌组织中IL12A基因的表达水平显著高于正常肝脏组织(P<0.001),见图1A。IL12B基因在正常的肝脏组织中的转录本表达量为0.000(0.000,0.010),在肝癌组织中的转录本表达量为0.010(0.000,0.029);IL12B基因在肝癌组织和正常肝脏组织的表达量没有显著差异(图1B)。因为没有检测到IL12B基因在肝癌组织和正常肝脏组织的差异表达,所以在后续的分析中主要以IL12A基因为主。
2.2 IL12A基因在不同分组肝癌患者中的表达情况 基于LIHC样本的数据,IL12A基因在男性患者肝癌组织的转录本表达量为0.075(0.029,0.147),在女性患者中的表达量为0.079(0.027,0.175);IL12A的表达水平在二者之间没有显著性差异(图2A)。IL12A在21~40年龄组的肝癌组织的表达量为0.110(0.048,0.184),在41~60年龄组的表达量为0.086(0.039,0.188),在61~80年龄组的表达量为0.068(0.023,0.147),在81~100年龄组的表达量为0.137(0.054,0.187);IL12A的表达仅在21~40年龄组与41~60年龄组之间存在显著差异(P<0.01),见图2B。IL12A在Ⅰ期肝癌组织的表达量为0.074(0.033,0.161),Ⅱ期肝癌组织的表达量为0.084(0.028,0.185),Ⅲ期肝癌组织的表达量为0.106(0.028,0.199),Ⅳ期肝癌组织的表达量为0.074(0.063,0.127);IL12A的表达分别在Ⅰ期与Ⅲ期(P<0.05)、Ⅱ期与Ⅳ期(P<0.01)、Ⅲ期与Ⅳ期(P<0.01)存在显著差异(图2C)。
2.3 IL12A在肝癌组织和正常肝脏组织的甲基化情况 基于LIHC样本中的数据,IL12A基因在正常的肝脏组织中的甲基化Beta值(Beta value)为0.037(0.035,0.040),在肝癌组织中的甲基化Beta值为0.030(0.032,0.035);肝癌组织中IL12A基因的甲基化水平显著低于正常肝脏组织(P<0.01),见图3。
A:不同性别肝癌患者IL12A基因的表达水平 B:不同年龄肝癌患者IL12A基因的表达水平 C:不同分期肝癌患者IL12A基因的表达水平
2.4 在肝癌组织中与IL12A共表达基因的GO富集分析 基于TCGA数据库,检索到1 914个与IL12A共表达基因,其中Pearson相关系数(Pearson Correlation Coefficient)≥0.4的共表达基因有376个。对于IL12A和这376个共表达的基因利用DAVID工具进行GO富集分析。通过GO富集分析,发现在生物过程方面,共表达基因主要富集在细胞成分组织、生殖过程、代谢过程、生物过程负调节、细胞增殖、免疫系统反应、应激反应等方面;在细胞组成方面共表达基因主要与膜封闭腔、蛋白复合物、细胞器、超分子配合物等组成有关;在分子功能方面,共表达基因主要富集在结合、转录调节活性、催化活性、分子载体活性、分子功能调节等方面(图4)。
2.5 在肝癌组织中与IL12A共表达基因的KEGG通路分析 对于IL12A和与其共表达的376个基因(相关系数≥0.4),使用DAVID工具进行KEGG通路分析。结果显示,共表达基因主要富集在接合体、细胞周期、DNA复制、RNA转运、真核生物中的核糖体生物发生、泛素介导的蛋白质水解等的相关通路方面。表达差异基因KEGG通路富集结果见表1。
2.6 IL12A 表达与肝癌预后的关系 基于LIHC样本中的数据,使用Kaplan-Meier生存分析法分析肝癌患者IL12A基因表达高低水平与生存时间及生存率之间的关系,并绘制肝癌患者预后生存曲线图(图5)。结果显示,IL12A基因高表达的肝癌患者的生存率明显低于IL12A基因低表达患者的生存率(P=0.009 1)。
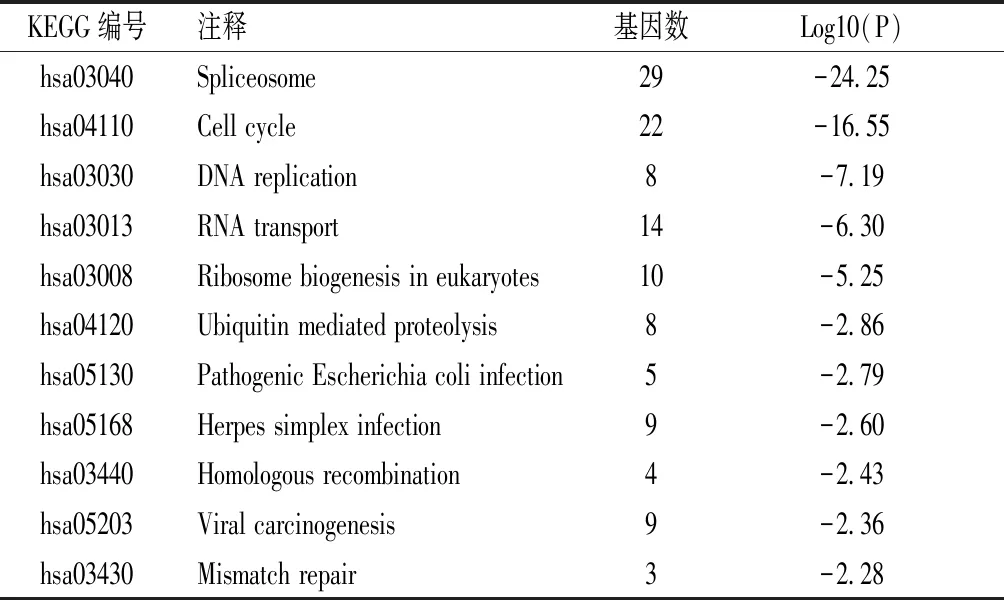
表1 IL12A与其共表达基因的KEGG通路分析结果
图5不同IL12A表达情况的肝癌患者生存曲线
3 讨论
本研究结果表明,在肝癌组织中IL12A基因的表达水平显著高于正常的肝脏组织,而IL12B基因在二者之间表达情况没有显著性差异。对于IL12A基因,其在肝癌组织中的表达情况与性别没有相关性;虽然在21~40岁年龄组与41~60岁年龄组之间,发现存在表达差异,但是并没有在其他年龄组别之间发现类似现象。在肝癌Ⅰ期、Ⅱ期、Ⅲ期之间发现IL12A的表达有差异,但是同Ⅳ期比较,并没有发现差异表达情况,这可能是由于Ⅳ期患者数目较少(仅为6例)的原因造成的。分析IL12A基因的甲基化水平,可以发现在肝癌组织中的甲基化水平显著低于正常肝脏组织的水平。目前的研究结果表明,DNA低甲基化是在肿瘤发生发展中的一种常见的表观遗传异常,DNA被甲基化通常会抑制基因的表达。本研究发现在肝癌组织IL12A的甲基化水平较正常肝脏组织低,而此时IL12A在肝癌组织中的表达水平则明显升高。
IL-12由35kDa(被称为p35)和40kDa(被称为p40)的两条肽链组成。通常情况下,在细胞中p40的量远超出p70的量,但是p40同源二聚体没有生物学活性;同时研究也表明单独的p35也不具有生物学活性,但p35却是合成p70的限速因子[6]。由此可见,在本研究中发现的IL12A在肝癌组织中的高表达对于肝癌病情的发生、发展有一定的影响。IL-12的生物学活性是通过T细胞和NK细胞上的IL-12受体所介导发挥的,其自身及其所诱导的细胞因子与其他细胞因子之间的相互作用是一个复杂的网络调控系统。IL-12独特的细胞效应主要是由于信号传导与转录激活因子-4(Signal transducers and activators of transcription 4, STAT4)的活化所产生的。STAT4可以调节IL-12与IL-23之间的平衡,并可以通过控制辅助性T细胞1和辅助性T细胞17的活性影响炎症疾病的发生与发展[7]。其他的研究结果也表明STAT家族中的另一个因子——STAT3也同IL-12一起在肝癌的发病、发展中起到作用。IL-12可诱导肝癌细胞发生自噬现象,这种自噬的机制可能与抑制STAT3信号通路有关[8]。
在癌症治疗后,患者的生存率受到多方面的因素影响,例如患者自身情况、肿瘤分期、治疗相关因素等,所以在分析肝癌发生、发展机制以及预后机理时要考虑到多条代谢通路的共同作用,同时要考虑到细胞因子之间相互作用和调节平衡,以及相应的应答水平。在本研究中,通过GO富集分析和KEGG通路分析发现IL12A共表达的基因主要参与了细胞增殖、代谢过程、免疫反应、应激反应、生物黏附、细胞杀伤等分子生物学过程,并参与了DNA复制、RNA转运、细胞周期调节、蛋白水解、错配修复等生物学通路。由此可见,肝细胞癌症的发生、发展是由多基因发生表达变化所引起的多方面生物过程和多条代谢通路的共同变化所导致的。
综上所述,IL12A基因在肝癌组织中表达量高,并且其与肝细胞癌症的发生、发展密切相关。因此,IL12A可以作为肝癌诊断筛选、预后效果预测的标志物之一。

