建立医疗器械唯一标识(UDI)实践与启示
陈静 王娟 赵燕燕

摘 要:自2019年8月起,国家药品监督管理局陆续发布了《医疗器械唯一标识系统规则》、《关于做好第一批实施医疗器械唯一标识工作有关事项的通告》、《关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告》。在国内销售、使用的医疗器械,将按照风险程度和监管需要分类实施医疗器械唯一标识(Unique Device Identification;UDI)。其中,部分有源植入类、无源植入类等高风险第三类医疗器械作为第一批实施品种,要求2021年1月1日起强制实施。本文在上述法规要求背景下,结合安图生物UDI试点实践经验,探讨生产企业实施医疗器械唯一标识实践要点,为我国医疗器械唯一标识的实施提供借鉴和思路。
关键词:医疗器械唯一标识(UDI);发码机构;GS1
Abstract:Since August 2019, National Medical Products Administration(NMPA) issued Rules for the Unique Device Identification System, Notice on Matters Relating to the Implementation of the First Trial of UDI, and the Announcement on Advancing the Pilot Spots in-depth & Implementation of the First Trial of UDI. Medical devices sold or used in domestic shall perform UDI by category according to their risk level and regulatory supervision needs. Among which, part of high risk Class III medical devices(active Implanted devices, non-active implanted devices etc.) as the first trial shall compulsory perform from January 1st, 2021. Under the background of the above-mentioned regulations and combined with the practical experience of Autobio, this article discusses the key points of UDI implementation for medical device manufacturers, so as to provide experience and ideas for UDI implementation work in China.
Key Words:Unique Device Identification(UDI);Code issuing agency;GS1
医疗器械唯一标识(Unique Device Identification,UDI)是标记在医疗器械本体或包装上,由一组数字、字母或者符号组成的代码。这组代码即医疗器械的身份证,用以对医疗器械唯一性识别。2013年美国FDA率先制定并推出UDI系统法规,指导并有力推动了UDI的实施。2017年欧盟颁布体外诊断医疗器械法规(IVDR)和医疗器械法规(MDR),对UDI相关要求和强制执行时间进行了明确规定。此后,韩国、澳大利亚、印度等国家也已经陆续开展UDI推行工作,实施UDI已成为全球议题。
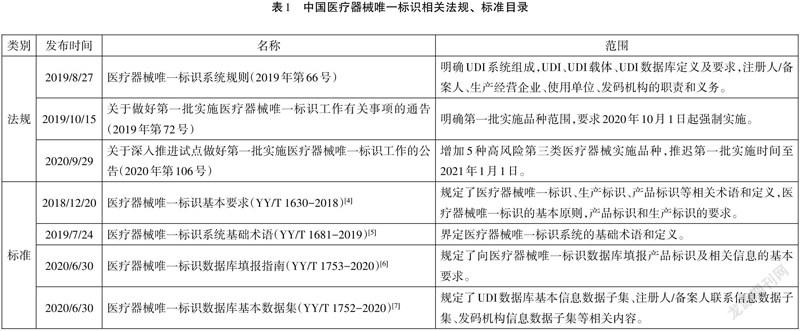
2019年8月,国家药品监督管理局发布《医疗器械唯一标识系统规则》(简称《规则》)[1],明确规定了注册人/备案人应开展产品赋码、数据上传和维护等工作的主体责任,同时也指出将分步推行医疗器械唯一标识制度。2019年10月、2020年9月相继发布的《关于做好第一批實施医疗器械唯一标识工作有关事项的通告》[2]、《关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告》[3],规定部分无源植入类、有源植入类等高风险第三类医疗器械(共9大类69个品种)作为第一批实施品种,2021年1月1日起强制实施。本文在此法规背景下,结合安图UDI试点实践经验,探讨注册人/备案人建立UDI实践要点,为我国UDI的实施提供借鉴和思路。
一、建立医疗器械唯一标识实践要点
1.掌握法规要求,明晰注册人/备案人职责。
学习、掌握UDI相关法规和标准(见表1)要求,理清注册人/备案人职责。
2.组建项目团队,分解注册人/备案人职责:
UDI项目的实施涉及法规、体系、设备、软件、服务等多个层面,是一项复杂的系统,需要多部门介入。注册人/备案人可根据自身实际情况,分解、落实职责至各个部门或人员,一般可包含质量、生产、储运、法规、客服及信息技术部等。
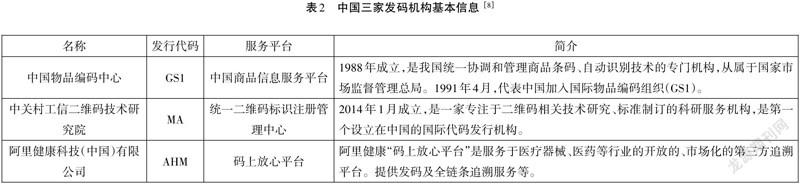
3.选择发码机构,申请厂商代码:
发码机构应当是中国境内的法人机构;应确保按照其标准创建的UDI的唯一性;应当将其编码标准上传至国家UDI数据库并动态维护。
目前符合上述要求的发码机构共3家(见表2)。注册人/备案人可根据产品销售范围、客户需求、发码机构提供的服务等,选择合适的发码机构。通过发码机构服务平台,注册申请厂商代码。
4.分配编码,创建唯一标识:
注册人/备案人应按照发码机构提供的编码标准,同时结合自身产品特点、市场需求等编制产品UDI。
以下以GS1标准为例,介绍产品UDI编码。
如表3所示,产品标识即应用标识符(01)后信息,唯一指向某注册人/备案人具体规格型号和包装的产品,此项为静态信息,要求注册人/备案人必选;生产标识即应用标识符(11)、(17)、(10)标识信息,分别指示产品生产日期、失效日期、批号,除此之外,GS1还包含有其他应用标识符,具体见《GB/T16986-2018商品条码 应用标识符》【11】,此部分为动态信息,注册人/备案人可根据监管和实际应用需求选择添加。
结合UDI的推行目的及使用单位应用需求,PI信息宜包含标签中的生产标识信息,如生产日期、批号、失效日期或序列号等。
根据企业自身管理需求,也可以增加其他信息。如通过企业内部信息的应用标识符(91-99)来表示灭菌日期或灭菌批号,区分生产线、班次等【12】。通过应用标识符(21)序列号结构化设计,在缩小追溯范围、实现防窜货目的的同时,还可增加其他生产信息。如微生物平板类产品,如想知道是年度第几批、哪个高压灭菌锅灭菌的,可使用(21)201101001,其中“2011”代表20年第11批,“01”代表1号灭菌锅,001代表从1号灭菌锅分装的第1个包装产品。
5.选定UDI载体
UDI载体包括一维码、二维码或射频标签等形式。注册人/备案人可根据UDI载体特点(见表4)、客户需求、发码机构建议及自身实际情况等,选择合适的UDI载体。
若UDI中只包含产品标识或少量生产标识信息,企业可选择一维码或者二维码。
若UDI中含有较多生产标识信息,可考虑选择二维码。因一维码易受产品包装尺寸限制而必须采用多行并联的方式,这种方式必须多次扫码才能获取完整的UDI信息,不可避免的会增加流通和医疗机构的负担。
当然,企业也可根据自身需求,选择使用射频标签。使用射频标签时,产品需要同时具备一维码或者二维码。
6.建立质量体系文件,规范UDI管理。
建立UDI质量体系文件,明确各部门职责,规范产品UDI编码原则、UDI载体要求,规范国家唯一标识数据库信息的上传、维护及更新;修订产品标签模板;修订产品检验标准,增加UDI检验项等。
7.结合企业实际情况,确定UDI实施方案:
医疗器械唯一标识唯一性指向单个规格型号产品的,UDI可只包含DI静态信息,企业实施起来会相对简单。
医疗器械唯一标识唯一性指向同批次产品或单个产品的,UDI应同时包含DI静态信息和PI动态信息,企业具体实施时会存在一定难度。根据企业实际情况,可能会引起物料(包装盒、标签等)变更、生产线改造、软件系统改造等,此类变更或改造的周期一般会比较长,企业亦结合实际情况提早准备。
8.国家UDI数据库填报:
企业须在产品上市销售前,登录国家药品监督管理局UDI数据库(https://udi.nmpa.gov.cn/),先行维护“企业基本信息”和“注册/备案信息”模块的数据。然后参考《国家药品监督管理局医疗器械唯一标识管理信息系统数据填报说明》,维护“产品标识信息”模块中最小销售单元产品标识、UDI编码体系名称、标识载体、产品名称、注册证编号或备案凭证编号、规格型号、储存条件、包装标识信息、注册人信息等数据。
当上述相关数据发生变化时,须于该产品上市销售前及时在国家UDI数据库中提交变更申请,更新数据;当最小销售单元产品标识变化时,应按照新增产品标识上传数据至国家UDI数据库。
企业实施UDI流程见图1。
二、启示
1.实施UDI管理,各相关方均可获益
UDI的实施,有助于企业提高信息化管理水平,建立有效的产品追溯体系;有助于经营企业建立现代化物流体系,降低运营成本;有助于医疗机构降低器械使用差错,保证患者用械安全;有助于构建医疗器械监管大数据,提升监管效能。
2.企业亦提前着手准备
UDI项目是一项复杂的工程,它涉及法规、体系、设备、软件、服务等多个层面,需要企业各部门通力合作来完成。结合企业实际情况,实施UDI可能会不同程度引起物料的变更、生产线的改造、软件系统的改造等,实施周期可能会比较长,企业亦提前着手准备。
3.关注国外市场UDI监管要求
有出口业务的企业,需同步关注、掌握国外市场监管要求及动向。比如,产品出口欧盟国家时,企业需掌握欧盟医疗器械法规(MDR)、体外诊断医疗器械法规(IVDR)对UDI的具体要求,掌握欧盟数据库Eudamed中UDI数据库模块的建设进度及填报要求,掌握欧盟对Basic UDI-DI的要求等。
参考文献:
[1]国家药品监督管理局. 国家药监局关于发布医疗器械唯一标识系统规则的公告(2019年 第66号)[EB/OL]. (2019-08-23) [2020-12-28]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20190827092601750.html.
[2]国家药品监督管理局.国家药监局关于做好第一批实施医疗器械唯一标识工作有关事项的通告(2019年第72号)[EB/OL]. (2019-10-12) [2020-12-28]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20191015160401461.html.
[3]國家药监局,国家卫生健康委,国家医保局. 国家药监局 国家卫生健康委 国家医保局关于深入推进试点做好第一批实施医疗器械唯一标识工作的公告(2020年 第106号)[EB/OL]. (2020-9-29) [2020-12-28]. https://udi.nmpa.gov.cn/toDetail.html?infoId=45&CatalogId=2
[4]国家药品监督管理局.YY/T1630-2018 医疗器械唯一标识基本要求[S].北京:中国标准出版社,2018:1-4.
[5]国家药品监督管理局.YY/T1681-2019医疗器械唯一标识系统基础术语[S].北京:中国标准出版社,2019.
[6]国家药品监督管理局.YY/T 1753-2020医疗器械唯一标识数据库填报指南[S].北京:中国标准出版社,2020.
[7]国家药品监督管理局.YY/T 1752-2020医疗器械唯一标识数据库基本数据集[S].北京:中国标准出版社,2020.
[8] 国家药品监督管理局. 医疗器械唯一标识数据库(发码机构及规则)[EB/OL]. [2020-12-18]. https://udi.nmpa.gov.cn/toAgencyRules.html.
[9]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. GB 12904-2008 商品条码 零售商品编码与条码表示[S].北京:中国标准出版社,2009-11-5.
[10]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. GB/T 16830-2008 商品条码 储运包装商品编码与条码表示[S].北京:中国标准出版社,2009-01-01.
[11]国家市场监督管理总局,中国国家标准化管理委员会. GB/T 16986-2018商品条码 应用标识符[S].北京:中国标准出版社,2018.
[12] 李君,刘政江. 建立医疗器械唯一标识(UDI) 编码规则的实践与思考[J]. 中国医药导刊,2019,21(9):529 532.
作者简介:陈静,女,工程师,研究方向:UDI 在医疗器械生产质量管理体系的推行和实施。

