丹参有效成分
——二氢丹参酮Ⅰ抑制胃癌的作用研究
钟雄东
珠海市人民医院普外科(珠海 519000)
基于我们通过网络药理学分析发现二氢丹参酮Ⅰ是丹参的主要成分之一,并预测发现二氢丹参酮Ⅰ能靶向胃癌的多个关键靶点。既往已经有部分研究证实二氢丹参酮Ⅰ对多种肿瘤细胞的生长具有抑制作用[1- 6],但其对胃癌的作用和具体机制仍未明确。本项目研究主要通过体内外实验明确二氢丹参酮Ⅰ对胃癌细胞增殖和凋亡的影响,以明确二氢丹参酮Ⅰ对胃癌的抗肿瘤作用。
1 材料与方法
1.1 实验试剂
二氢丹参酮I(dihydrotanshinoneⅠ,DHTS,纯度>98%)购于天津中新药业集团有限公司;DMEM培养基(Gibco),青链霉素(Gibco),Annexin V-FITC/PI双染细胞凋亡检测试剂盒,二甲基亚砜(DMSO)购自西格玛(美国密苏里州圣路易斯)。购买胎牛血清、青霉素和链霉素,天津昊阳生物制品有限公司(中国天津)。除非另有说明,其他试剂均从Sigma购买。将DHTS溶解于DMSO中并在- 20 ℃下储存,使用前用新鲜培养基稀释至所需浓度。
1.2 细胞培养
从中国科学院(上海,中国)型培养组的细胞库中获得人胃癌细胞株AGS、HCG27和人胃上皮细胞株GES- 1,并在5% 37 ℃的CO2浓度为10%胎牛血清和1%青霉素链霉素的DMEM培养基中培养。
1.3 CCK8细胞活性检测
使用Cell Counting Kit(CCK8)CCK- 8/WST- 8试剂盒(碧云天):消化细胞并制成单细胞悬浮液,以2 000个/孔的密度于96孔板中接种,每组设置5个复孔,加入不同浓度的DHTS处理24 h。检测前,每孔加入10 μL CCK- 8 试剂,37 ℃避光孵育2 h;然后将孵育后的培养基移到酶标板中,450 nm 处用BIO-RAD 酶标仪测定的吸光度。
1.4 平板克隆形成实验
细胞以200个/孔的细胞量接种于六孔板中,细胞贴壁后开始采用DHTS干预,每组设置3个复孔,37 ℃,5% CO2中培养。每隔2天在显微镜下观察克隆的大小,每隔3天换上新的培养液。处理14 d后,在荧光显微镜下拍照。随后吸去培养液,用PBS 小心洗涤一次,每孔加0.1 mL 10%甲醇溶液固定细胞30 s。吸去甲醇溶液,每孔加0.1 mL 结晶紫染液,室温中放置20 min。轻轻甩去染色液,用蒸馏水洗涤各孔,将培养板倒置于吸水纸上吸干水分。自然干燥或37 ℃烘干拍照计数。
1.5 流式细胞术检测凋亡细胞
使用凯基公司KGA1026试剂盒。用不含EDTA 的胰酶消化细胞,终止消化后,1 500 rpm,3 min离心,吸去上清,用PBS洗1遍,离心后用PBS重悬细胞,进行细胞计数。取1E+5 个细胞量的悬液,离心弃上清,加入500 μL Binding buffer 重悬细胞。加入5 μL Annexin V-APC,混匀后,再加入5 μL 7-AAD染液,混匀,室温,避光,反应5~15 min后置于冰上。1小时内进行流式细胞仪机检测。GFP的绿色荧光:FITC通道筛选GFP阳性细胞进行Annexin V-APC/7-AAD荧光检测。Annexin V-APC的红色荧光:激发波长633 nm,最大发射波长660 nm。7-AAD红色荧光:激发波长Ex=546 nm;发射波长Em=647 nm。
1.6 细胞内活性氧(ROS)水平的测定
细胞内的ROS水平通过Fuorogination探针CM-H2DCFDA测定。简言之,用不同浓度的DHTS加或不加NaC(500 μm)处理AGS细胞2 h或4 h。然后,用磷酸盐缓冲盐水(PBS)洗涤细胞两次,并在37 ℃下用H2DCFDA(30 μm)稀释30 min。孵育后,细胞被洗涤两次,再悬浮在新鲜的PBS中。使用Facstar-Fow细胞仪(Becton Dickinson,Franklin Lakes,New Jersey,美国)。
1.7 氧化应激检测
采用DHTS处理,测定了谷胱甘肽(GSH)/氧化二硫化物(GSSG)比值,以测定AGS细胞的氧化应激。在本研究中,总谷胱甘肽的浓度用酶法测定T-GSH、GSH和GSSG。通过5,5-二硫代双(2-硝基苯甲酸)GSSG还原酶回收试验测定了T-GSH。使用生成的5-硫代- 2-硝基苯甲酸(TNB)测定GSSG与DTNB的还原GSH反应。在410 nm处测量的信号被用来分析TNB的形成。通过从t-gsh中减去gssg计算降低的gsh水平。计算公式如下:
1.8 半胱天冬酶活性检测
caspase- 3、caspase- 8和caspase- 9活性根据制造商的说明(abcam)用荧光分析试剂盒进行测定。简单地说,收集细胞并用溶解缓冲液溶解。蛋白(20 μg)用半胱天冬酶孵育。3个底物ac-devd amc、caspase- 8底物ac-ledh amc或caspase- 9底物ac-ietdamc(50 μg),分别在37 ℃下保持2 h。然后将混合物转移到96孔中。黑色底的微孔板。在福雷森特平板阅读器(美国密理博公司)中分别记录了400 nm和505 nm无酵底物和劈裂底物的荧光。
1.9 裸鼠成瘤实验
小鼠实验符合暨南大学动物伦理委员会审核通过。裸鼠(上海斯莱克实验动物有限公司,Balb/c裸鼠,雄性,6周龄,每组5只),适应一周后进行注射:HCG27细胞消化离心后制成单细胞悬液,计数后取适量的细胞用PBS悬浮,在Balb/c裸鼠侧腹部皮下接种。每只接种2E+6个细胞,注射体积为100 μL。当小鼠成瘤后,采用DHTS溶于生理盐水,以5 mg/kg每天对小鼠瘤体进行瘤内注射,此后,每隔3天测量注射部位肿瘤的体积。21天后小鼠颈椎脱臼处死,取出肿瘤称重,4%多聚甲醛固定,待后续病理分析。采用免疫组化检查小鼠肿瘤组织中Ki67、Caspase- 3、Caspase- 8的表达水平,免疫组化由珠海市人民医院病理科完成。
1.10 统计学方法
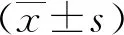
图1 CCK8检测DHTS对人胃癌细胞的抑制作用注:(A)DHTS的化学结构;(B-C)不同浓度DHTS对胃癌HCG27、AGS细胞的细胞活性的影响;(D)不同浓度DHTS对人胃上皮细胞株GES- 1的影响(与对照组相比较, **P<0.01, ***P<0.001)
2 结 果
2.1 二氢丹参酮Ⅰ对人胃癌细胞增殖能力的影响
DHTS的分子结构式如图1A所示。采用CCK8技术检测DHTS对人胃癌细胞株HCG27和AGS细胞活性的影响,随着DHTS剂量浓度增加(从0 μmol、5 μmol、10 μmol、20 μmol),DHTS对HCG27和AGS细胞的抑制显著增强(图1B-C)。而不同浓度的DHTS对人胃上皮细胞株GES- 1没有显著的抑制作用,如图1D所示。
2.2 二氢丹参酮Ⅰ对人胃癌细胞克隆形成能力的影响
采用平板克隆形成实验检测DHTS对胃癌细胞克隆形成能力的影响,采用DHTS 10 μmol对HCG27和AGS细胞进行干预2周后,与DMSO对照相比,显著抑制了HCG27和AGS细胞的克隆形成能力,见图2。
2.3 二氢丹参酮Ⅰ对细胞凋亡的影响
采用流式细胞术检测DHTS对胃癌细胞凋亡的影响,采用DHTS 10 μmol对HCG27和AGS细胞进行干预24 h后,与DMSO对照相比,DHTS组的细胞凋亡率高于DMSO组,差异有统计学意义(P<0.001),见图3。
2.4 二氢丹参酮Ⅰ促进AGS细胞氧化应激

图2 DHTS对人胃癌细胞克隆形成能力的影响注:(A-B)DHTS 10 μmol对HCG27和AGS细胞进行干预2周细胞克隆形成代表图;(C-D)DHTS 10 μmol处理HCG27和AGS细胞后克隆形成数统计对比(与DMSO组对比, ***P<0.001)

图3 DHTS对人胃癌细胞凋亡的影响注:(A-B)DHTS 10 μmol对HCG27和AGS细胞进行干预24 h流式细胞检测凋亡细胞比例;(C-D)DHTS 10 μmol处理HCG27和AGS细胞后细胞凋亡的统计比例(与DMSO组对比, ***P<0.001)。

图4 DHST对HCG27和AGS细胞氧化应激的影响注:(A-B)DHTS 10 μmol对HCG27细胞内活性氧的水平和GSH/GSSG的比例的影响;(C-D)DHTS 10 μmol对AGS细胞内活性氧的水平和GSH/GSSG的比例的影响(与Ctr组对比, **P<0.01, ***P<0.001;与DHTS组相比, #P<0.05)。
通过测定DHTS处理后的细胞内ROS水平和还原型谷胱甘肽(GSH)/氧化二硫(GSSG)比值,检测DHTS处理后的AGS细胞氧化应激。结果表明,孵化2 h和4 h,DHTS处理(10 μmol)均能提高HCG27和AGS细胞内活性氧的水平(P<0.05),DHTS(10 μmol)加NAC(活性氧ROS阻断剂)孵育2 h和4 h均能降低AGS细胞氧化应激(P<0.05),见图4A、C所示;此外,此外,10 μmol的DHTS能抑制HCG27和AGS细胞中GSH/GSSG的比例,而NAC能逆转对HCG27和AGS细胞中GSH/GSSG比例的抑制,见图4B、D。
2.5 二氢丹参酮Ⅰ在AGS细胞中激活caspase- 3和caspase- 8活性
为了研究DHTS诱导的细胞凋亡,用荧光分析法研究了细胞凋亡相关的天冬氨酸半胱氨酸酶。与caspase- 9相比,用DHTS(10 μmol)处理HCG27和AGS细胞可提高caspase- 3和caspase- 8的活性,活性氧抑制剂NAC抑制了DHTS对AGS细胞caspase- 3和caspase- 8的激活,而DHTS处理HCG27和AGS细胞后对caspase- 9活性没有的影响,见图5。
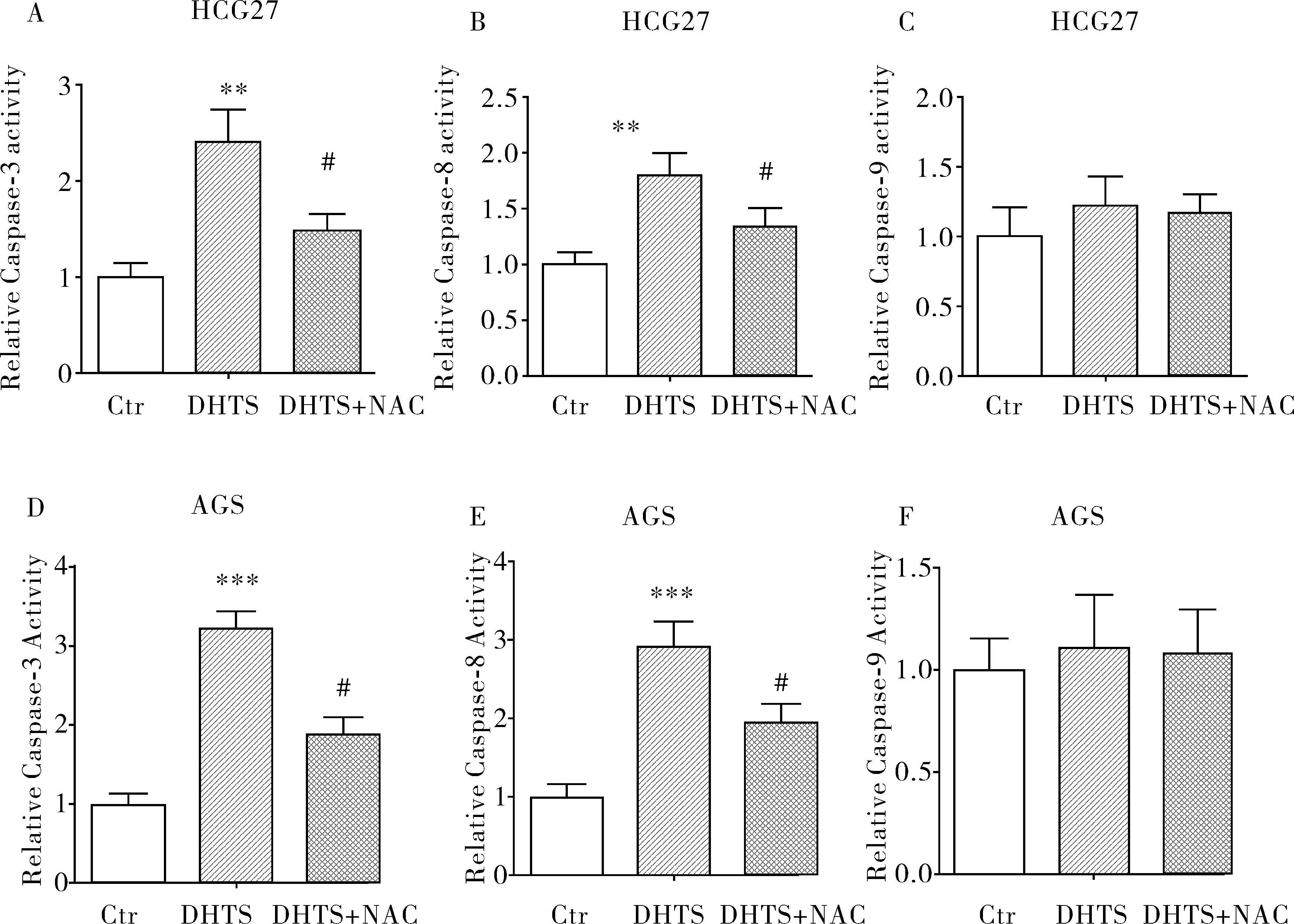
图5 DHTS对HCG27和AGS细胞caspace- 3、caspace- 8及caspace- 9酶活性的影响注:(A-C)检测DHTS处理后的AGS细胞内caspace- 3、caspace- 8以及caspace- 9的活性。(A-C)检测DHTS处理后的HCG27细胞内caspace- 3、caspace- 8以及caspace- 9的活性。 **P<0.01,实验组和对应对照组相比较; #P<0.05,与DHTS治疗组相比。
2.6 二氢丹参酮Ⅰ对裸鼠胃癌肿瘤的抑制作用
采用HCG27细胞构建裸鼠胃癌模型后,采用DHTS瘤内注射干预小鼠瘤体,在干预21 d的过程中,与对照组相比,DHTS抑制小鼠肿瘤瘤体体积的增加,差异有统计学意义(P<0.001),见图6A。两组小鼠在干预后21 d的体质量对比差异无统计学意义(P>0.05),见图6B。其中DHTS干预的小鼠瘤体中,其肿瘤细胞Ki67的表达水平较对照组下降,而Caspase- 3和Caspase- 8的表达水平上升,见图6C。

图6 DHTS对HCG27胃癌小鼠模型肿瘤的抑制作用注:A DHTS和对照组两组小鼠瘤体体积的对比;B DHTS和对照组两组小鼠的体质量对比;C 免疫组化检测DHTS处理后的小鼠瘤体;Ki67、Caspace- 3和caspace- 8的表达水平; ***P<0.001;ns,P>0.05。
3 讨 论
基于网络药理学分析我们发现二氢丹参酮Ⅰ是丹参的主要成分之一,并预测发现二氢丹参酮Ⅰ能靶向胃癌的多个关键靶点。既往已经有部分研究证实二氢丹参酮Ⅰ对多种肿瘤细胞的生长具有抑制作用,但其对胃癌的具体作用仍未明确。在本研究中,我们通过体内外实验证明了二氢丹参酮Ⅰ通过活性氧介导氧化应激诱导胃癌细胞凋亡。
二氢丹参酮Ⅰ是丹参提取物之中的一种天然物,一种从传统的亚洲功能性食品丹参中分离出来的天然化合物[7]。二氢丹参酮I分子量是278.30,分子结构式是:C18H14O3,其二级质谱碎片 m/z 261,246,233,218,205,190,179,169,141[8]。二氢丹参酮Ⅰ的结构见图1A所示。一直以来二氢丹参酮Ⅰ被广泛应用于治疗心脑血管疾病[4,9],疗效肯定。二氢丹参酮Ⅰ已被证明具有多种生物活性,包括抗炎活性[10]、化疗增敏作用[2]、抗肝纤维化作用[11]等。最近几年,二氢丹参酮Ⅰ被认为还具有抑制各种肿瘤的作用,例如抑制肝癌细胞增殖[1]、抗宫颈癌[12]、抗乳腺癌[13]等。然而,其在胃癌的作用仍未完全明确。
活性氧(ROS)是由多种氧化还原代谢反应产生的,在包括癌细胞凋亡在内的许多生理和病理过程中起着重要作用。在本研究中我们看到,二氢丹参酮Ⅰ处理胃癌细胞HCG27 和 AGS后,细胞内活性氧含量增加(见图4)。越来越多的证据表明活性氧介导的氧化应激与胃细胞凋亡的诱导有关[14]。在细胞凋亡过程中,活性氧的产生导致外线粒体膜通透化,导致线粒体细胞色素c释放到胞质中[15]。各种报道表明,ROS在细胞凋亡中起着中枢调节作用[16- 17]。近年来,研究表明ROS在细胞凋亡中起中心调节作用[16- 17]。此外,ROS也能通过调节磷酸化和活化MAPK途径下调抗凋亡蛋白水平以及上调促凋亡蛋白的表达,从而导致细胞死亡(凋亡)[16- 17]。我们的实验研究表明ROS参与DHTS诱导的胃癌细胞凋亡。
细胞凋亡的定义首先由Elmore等学者提出的[18]。细胞凋亡被称为程序性细胞死亡,可引起多种细胞变化,表现为细胞和细胞核的收缩,以及核染色质的凝聚、膜泡和少核小体DNA碎片,主要特征表现为细胞固缩、细胞膜出血、核和DNA碎裂,从而导致细胞功能障碍[19]。一系列始于细胞内和细胞间的细胞信号调控凋亡,包括caspases和bcl- 2家族蛋白。线粒体通过多种凋亡蛋白介导细胞凋亡,如细胞色素c,其主要功能是控制细胞代谢和凋亡,以及诱导caspase级联反应[20]。Caspases是一组半胱氨酸蛋白酶,以及caspases作为凋亡过程的主要执行酶。我们的实验展示了DHTS诱导caspase- 3和- 8活性显著升高,caspase- 9活性则不明显(见图5和图6C),经过DHTS处理的HCG27和AGS细胞的caspase- 3和- 8活性被NAC(一种活性氧的抑制剂)部分地抑制(见图5),这表明DHTS的促凋亡作用依赖于ROS。
裸鼠胃癌模型,采用DHTS瘤内注射干预小鼠瘤体,在干预21 d的过程中,与对照组相比,DHTS显著抑制小鼠肿瘤瘤体体积的增加,差异有统计学意义(P<0.001),见图6A所示。结果表明DHTS能够明显抑制小鼠瘤体生长,但是两组小鼠在干预后21 d的体质量对比差异无统计学意义(P>0.05),见图6B所示。其中DHTS干预的小鼠瘤体中,其肿瘤细胞Ki67的表达水平较对照组显著下降,而Caspase- 3和Caspase- 8的表达水平明显上升,这说明了DHTS抑制小鼠瘤体生长是通过诱导瘤体细胞凋亡所导致的。

