功能性低聚糖作用于肠道菌群抑制肥胖的研究进展
张成楠 李秀婷 *
(1 北京食品营养与人类健康高精尖创新中心 北京工商大学 北京 100048
2 北京工商大学食品学院 北京 100048)
肥胖是一种超过正常生理需要的脂肪积累造成健康损害的身体状态,其主要由于能量的摄入与消耗不平衡所致[1]。世界卫生组织(World health organization,WHO)定义成年人身体质量指数 (Body mass index,BMI)≥25为超重,而 BMI≥30为肥胖[2]。据WHO统计,2016年世界39%的成年人处于超重状态,而13%的成年人处于肥胖状态[2]。随着经济高速发展和人民生活水平的日益提高,我国居民肥胖问题越来越凸显。由国家心血管病中心发布的《中国心血管病报告2016》调查显示,2011年20岁及以上人群超重及肥胖达到42.3%,其中中心型肥胖率达到44.0%[3]。长期处于肥胖的状态,不仅影响人们的生活质量,增加心血管疾病、糖尿病等,而且还有导致癌症的患病风险。然而,由于肥胖的病理尚不完全清楚,迄今为止,药物治疗肥胖效果并不理想[4]。利用天然生物活性物质治疗肥胖,即可以有效避免药物治疗带来的副作用,也特别适合于体重处于超重却未到肥胖(25 kg/m2≤BMI≤29 kg/m2)的人群,已成为近年来的研究热点。
功能性低聚糖又称为功能性寡糖,是由2~10个单糖通过糖苷键连接而成的低分子质量的非消化性碳水化合物,具有可以选择性地刺激特定肠道微生物的生长、活性而有益于宿主健康的特性[5-6]。常见的功能性低聚糖包括低聚果糖、低聚木糖、低聚半乳糖等,其大多具有良好水溶性,且具有酸稳定性和热稳定性较好,无不良风味,黏度和甜度低等特点[7]。有研究证实,肠道菌群组成与代谢物水平的改变在肥胖的发生与发展中起到重要的作用[4,8],而功能性低聚糖主要通过改善肠道菌群的生态平衡及产生短链脂肪酸 (Short chain fatty acids,SCFAs)等代谢产物来减轻肥胖症状[9-14]。本文主要就功能性低聚糖通过影响肠道菌群,从而抑制肥胖的研究进行探讨。
1 肠道菌群与肥胖的关系
人体肠道中有大量共生生活的微生物,Li[15]构建了一个高质量人类肠道微生物基因集数据库(Integrated gene catalog,IGC)。健康人群体内的肠道菌群处于动态平衡状态,肠道中有益微生物具有帮助人体消化吸收、制造人体必需的维生素与氨基酸、参与构建免疫系统、避免病原菌的侵害等作用;一旦生态平衡失调,如一些致病菌的快速繁殖,可能会极易引发肥胖[16]。Backhed[17]利用小鼠实验证明了肠道菌群与肥胖的关系:与普通小鼠相比,饲喂相同鼠粮的无菌小鼠体重较轻,而重新建立无菌小鼠体内肠道菌群后,其脂肪量和胰岛素耐受性显著增加。Cani[18]研究证明失调的肠道菌群通过引发慢性低炎症反应促进胰岛素耐受性和2型糖尿病的发展。随着研究的深入,肠道菌群及其代谢物与肥胖的关系逐步明确:(1)肠道菌群可以通过降解食物中非消化性多糖,增加肠道单糖和SCFAs的吸收,从而使宿主从饮食中获得更多能量,促进脂肪和肝脏组织中脂肪的堆积[8]。(2)肠道菌群中的革兰氏阴性细菌细胞壁的成分脂多糖(Lipopolysaccharide,LPS)可以与免疫细胞表面的受体结合,激活免疫系统,促进炎症细胞因子的释放,引起炎症反应[18]。(3)肠道菌群可以增加肠道通透性,导致大量LPS等进入机体内,引发炎症反应,加重肥胖[19]。(4)肠道菌群可以调节肠道上皮细胞、脂肪细胞及内分泌细胞,促进或抑制食欲相关激素与信号因子的释放,增加肠道食物的吸收[4]。(5)肠道菌群分泌的三甲胺裂解酶(Trimethylamine-lyase,TMA-lyase)可以将食源性的胆碱裂解产生三甲胺,三甲胺进一步在肝脏中被氧化生成氧化三甲胺(Trimethylamine-n-oxide,TMAO),诱发肝脏炎症反应,促进肥胖的发生与发展[8]。
2 功能性低聚糖抑制肥胖的机理研究
2.1 功能性低聚糖改变肠道菌群结构
功能性低聚糖改变肠道微生物组成 (表1)。相比于瘦型小鼠,肥胖小鼠肠道内细菌中的厚壁菌门 (Firmicutes)丰度较高,而拟杆菌门(Bacteroidetes)丰度较低。Ley[20]研究发现肥胖人群比消瘦人群肠道内厚壁菌门细菌更多而拟杆菌门细菌更少,通过低热量饮食控制体重后,肥胖人群肠道内拟杆菌门细菌增加而厚壁菌门减少。低聚果糖可以有效改善肥胖小鼠肠道内细菌厚壁菌门与拟杆菌门的比例,提高双歧杆菌属(Bifidobacterium)、乳杆菌属(Lactobacillus)的丰度[9,12]。大豆低聚糖、低聚木糖、低聚异麦芽糖以及低聚半乳糖均可改善肠道菌群结构,并增加双歧杆菌属和乳杆菌属的数量[21-25]。然而,有些研究表明肥胖人群与消瘦人群肠道微生物丰度并无显著性差别[26-27]。
2.2 肠道菌群代谢功能性低聚糖产生的SCFAs影响甘油三酯及胆固醇代谢
功能性低聚糖无法被人体直接消化吸收,但可以被肠道微生物代谢产生SCFAs[34]。肠道微生物代谢产生的SCFAs包括6种饱和脂肪族有机酸,其中乙酸、丙酸和丁酸占95%[35]。健康人群结肠和粪便中乙酸、丙酸及丁酸的物质的量浓度比大约为 60∶20∶20[36]。功能性低聚糖如菊粉、低聚果糖、低聚木糖可以改变肠道菌群代谢产生的SCFAs的浓度和比例。相比于饲喂普通鼠粮的大鼠,饲喂含有6%低聚木糖鼠粮的大鼠盲肠SCFAs含量提高274.62%;而饲喂含有5%~20%菊粉鼠粮的大鼠盲肠SCFAs的含量增加25.88%~83.53%[37-38]。值得注意的是在这些研究中,SCFAs浓度与功能性低聚糖浓度并不呈线性关系[36]。
SCFAs可以降低肠道内环境pH,促进耐酸有益菌如双歧杆菌、乳酸杆菌的生长,抑制pH敏感型致病菌如大肠杆菌和产气荚膜杆菌的生长,同时进入宿主体内影响甘油三酯及胆固醇代谢从而减少肥胖症状[36]。肠道菌群产生的SCFAs大部分被结肠上皮细胞吸收成为营养能源物质或进入血液循环,只有 5%通过粪便排泄损失[16,38]。SCFAs可以激活脂肪酸氧化,抑制肝脏中脂肪酸合成,最终导致体重降低[39];同时,SCFAs可以增加胆汁酸排泄与肝脏摄取血液中的胆固醇,调节胆汁酸代谢[39]。虽然SCFAs抑制肥胖的作用已有一些证实,但SCFAs在功能性低聚糖抑制肥胖中的作用尚不明确。
2.3 功能性低聚糖通过改善肠道屏蔽功能抑制肥胖
LPS是革兰氏阴性细菌细胞壁的特有成分,亦称内毒素,在细菌死亡溶解后释放出来[40]。肠道菌群产生的LPS通过小肠膜的紧密连接处进入肠上皮细胞,与甘油三酯、胆固醇等形成乳糜微粒进入淋巴循环,最终进入血液循环[16]。LPS通过与巨噬细胞等免疫细胞脂多糖受体CD14(lipopolysaccharide receptor CD14)等的结合,促进促炎细胞因子的释放,诱发低度炎症反应,导致肥胖[8,41]。Cani等[14,18]证明饲喂小鼠高脂鼠粮4周可以显著升高血液中LPS浓度2~5倍,同时增加血液中促炎细胞因子如肿瘤坏死因子α(Tumor necrosis factor-α,TNF-α)、白介素 1α(Interleukin-1α,IL-1α)、白介素-1β(Interleukin-1β,IL-1β)以及白介素-6(Interleukin-6,IL-6)的浓度。肥胖小鼠血液中LPS浓度的升高归因于肠道通透性的提高[19]。肥胖小鼠小肠中闭合蛋白(Occludin)以及紧密连接蛋白如ZO-1(Zonula occluden 1)表达及分布位置的改变会造成细胞旁路通透性的变化,最终导致肠道通透性的提高[12,19,42]。低聚果糖、低聚木糖可以显著上调肥胖小鼠小肠Occludin和ZO-1的mRNA表达并调节其分布位置,改善肠道屏障功能,降低血液中LPS浓度,抑制肥胖症状[12,43-44](图1)。

响影的群菌道肠对糖聚低性能功1表ial icrob m gut on arides oligosacch functional of effects he T 1 le ab T献文考参响影群菌道肠量剂糖聚低性能功型模验试糖聚低性能功[12]直)-coccoides m( Clostridiu菌梭球拟,)s acillu( Lactob属菌杆,乳)m acteriu ob( Bifid属菌杆歧双0.5g/kg/d)/6 L 7B(C5鼠小糖果聚低①高提度丰)rectale acterium( Eub菌杆真肠[9]属菌杆拟,)( Proteobacteria门菌形变,)m( Bifidobacteriu属菌杆歧双),( Bacteroidetes门菌杆拟/d只0.3g/)/6 L 7B(C5鼠小属菌球小见罕,)( Prevotella属菌氏普,)as on( Butyricim属菌弧酸丁,esiella, Barn)( Bacteroides kerk(A菌曼克艾,icrobia errucom),V erella( Tann属菌纳坦,tterella, Parasu)lum doligranu( Sub高提度丰)hila ip cin u m ansia m营互,, Moryella)aerofilum(An属菌杆细,)s ncu( Anaerotru属菌状棍氧厌,)icutes( Firm门菌壁厚低降度丰roteobacteria, Deltap, Anaerostipes ryantia, Marvinb)( Syntrophococcus属菌球29], 28-[23高提度丰)s( Enterococcu属菌球肠,)( Lactobacillus属菌杆乳),acterium ob( Bifid属菌杆歧双g/kg/d 2 1~)/c B L(BA鼠小糖木聚低0][3高提度丰)( Roseburia属菌氏斯,罗)revotella es/P( Bacteroid属菌氏普/属菌杆拟/10%度纯%62)/6 L 7B(C5鼠小1][3高提度丰)( Lactobacillus属菌杆乳,)acterium ob( Bifid属菌杆歧双%10)/6 L 7B(C5鼠小2][3壁厚,高提度丰)acteria( Actinob门菌线放,)acteria( Proteob门菌形变,)etes( Bacteroid门菌杆拟g/kg/d 0m 30② )(SD鼠大降下度丰)tes icu( Firm门菌1][2肠,)( Enterobacter属菌杆肠,高提度丰)s( Lactobacillu属菌杆乳,)acterium ob( Bifid属菌杆歧双4g/kg)(SD鼠大糖乳半降下度丰)( Enterococcus属菌球3][3属菌杆乳,降下度丰)erfringens p m( Clostridiu菌梭膜荚气产,)coli( Escherichia菌希埃肠大1.5g/kg)/c B L(BA鼠小高提度丰)s acillu( Lactob 2][2高提度丰)( Bifidobacterium属菌杆歧双,)s acillu( Lactob属菌杆乳g/k L 5m鼠小糖聚低豆大4][2肠,)( Enterobacter属菌杆肠,高提度丰)s( Lactobacillu属菌杆乳,)acterium ob( Bifid属菌杆歧双g/kg.0 1 0.5~)/c B L(BA鼠小糖芽麦异聚低降下度丰)( Enterococcus属菌球。ley aw D: Sprague-SD;②照对为组胖肥以准标化变度丰:①注
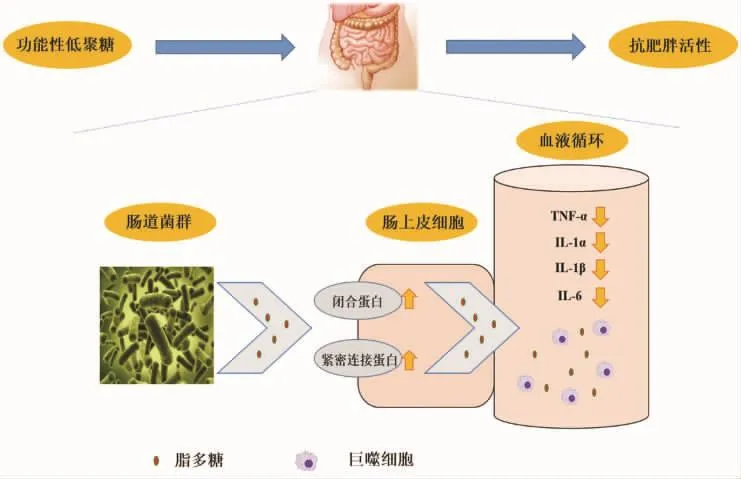
图1 功能性低聚糖通过改善肠道屏蔽功能抑制肥胖Fig.1 Functional oligosaccharides inhibit the development of obesity by improving intestinal permeability
2.4 功能性低聚糖通过上调食欲相关激素与信号因子减少肥胖症状
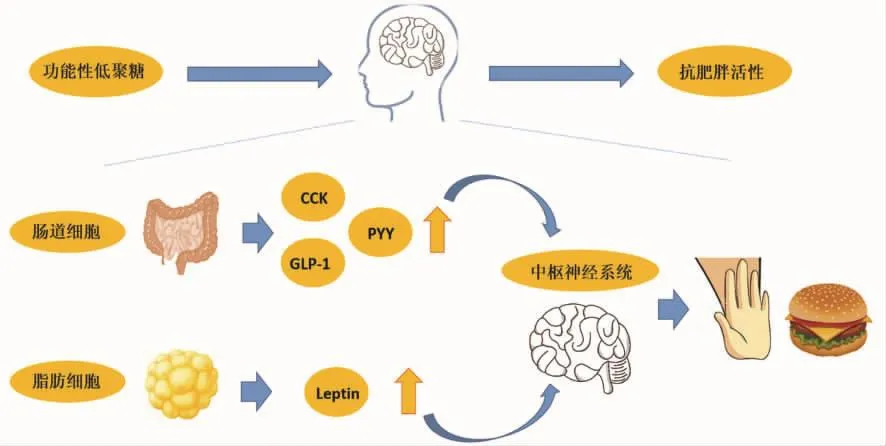
图2 功能性低聚糖通过上调食欲相关激素减少肥胖症状Fig.2 Functional oligosaccharides inhibit the development of obesity by upregulating appetite-related hormones
哺乳动物体内,中枢神经系统通过识别从消化道、脂肪细胞以及胰岛β细胞等组织发出的生物信号来控制进食以及相应的新陈代谢[45-46]。在小肠吸收摄入氨基酸、脂肪酸、葡萄糖等营养物质后,肠道内I细胞、L细胞等分泌肠促胰酶肽(Cholecystokinin,CCK)、胰 高 血 糖 素 样 肽 -1(Glucagon-like peptide-1,GLP-1)、酪酪肽(Peptide YY,PYY)等反馈中枢神经系统进而降低食欲、减少胃酸分泌、延迟胃排空[45-46]。GLP-1还具有抑制胰高血糖素分泌,促进胰岛素合成等功能[47]。脂肪组织作为内分泌器官,通过分泌瘦蛋白(Leptin)、脂联素(Adiponectin)等增加外周组织胰岛素敏感性,降低血液中甘油三酯和胆固醇水平[46]。肠道微生物代谢功能性低聚糖产生的SCFAs可以上调食欲相关激素与信号因子的分泌水平减少肥胖症状[4](图2)。在膳食中添加低聚果糖可以显著降低健康人群的食物和能量摄入,控制食欲,增加血液中GLP-1水平[48-51]。通过饲喂肥胖小鼠和大鼠低聚果糖可以显著上调GLP-1、GLP-2、Leptin以及下调胃饥饿素(Ghrelin)水平[9-14]。Everard[9]研究发现低聚果糖通过显著增加结肠L细胞数量以及提高血液中GLP-1水平。Cani[11]研究发现低聚果糖通过上调神经源性分化蛋白(NeuroD)和神经源素 3(Neurogenin 3,NGN3)的mRNA,激活 L 细胞的分化,从而增加L细胞的数量,最终升高血液中GLP-1水平。
3 展望
尽管肥胖已成为世界范围的流行性疾病,但由于个体差异以及肥胖病理尚不明晰,现有的治疗方法并不十分理想。功能性低聚糖具有良好的抑制肥胖功能,但其内在机制尚不完全清楚。现代分析技术与代谢组学理论的快速发展为揭示功能性低聚糖抑制肥胖的内在机理打下了一定的基础。研究功能性低聚糖抑制肥胖的机理,不仅可以为肥胖的治疗指明道路和确定靶点,而且可以降低肥胖治疗的支付成本,并为提升我国食品及农产品资源的生物转化和高值化利用提供新的思路。

