玉米黄素调控肥胖小鼠肝脏脂质及能量代谢作用
刘美宏 刘回民 谢佳函 徐 倩 王娇娇 吴 熙 潘 聪 郑明珠 刘景圣 *
(1 吉林农业大学食品科学与工程学院 长春 130118
2 小麦与玉米深加工国家工程实验室 长春 130118
3 吉林农业大学生命科学学院 长春 130118)
过去的40年中,全球肥胖人数激增对人类健康构成极大威胁[1]。肥胖是II型糖尿病、高血压、动脉硬化等代谢疾病的主要诱因,是体内脂肪细胞积聚过多而导致的一种病理状态。抑制脂肪生成,防止肥胖的天然组分开发成为研究热点[2]。玉米黄素是玉米中黄色素的主要成分,是叶黄素的同分异构体,属于类胡萝卜素的一种,在自然界中广泛存在。在食品中以黄玉米、蛋黄和枸杞等含量最多,人体无法自身合成,必须通过食物或补充剂获得。玉米黄素分子结构含有11个共轭双键,具有较强的抗氧化活性[3]。人类多种代谢疾病均与体内氧化应激有关,玉米黄素能够有效预防视网膜黄斑变性、癌症、心脑血管疾病[4],调节免疫功能,改善体内炎性反应及氧化应激水平[5]。
相比于β-胡萝卜素、虾青素、番茄红素等类胡萝卜素,玉米黄素降脂作用的研究甚少。Li等[6]利用玉米黄素对3T3-L1前脂肪细胞的增殖分化进行干预,发现玉米黄素可显著抑制3T3-L1前脂肪细胞的增殖和脂肪细胞脂质累积。李红艳等[7-8]研究发现玉米黄素具有保护高脂诱发鹌鹑血管脂质过氧化损伤的作用。本研究中添加玉米黄素干预高脂饮食诱导C57BL/6J肥胖小鼠,检测玉米黄素对肥胖小鼠体内脂质累积及肝脏组织脂质代谢相关因子表达的影响,明确玉米黄素对肥胖的防治效果,为进一步开发富含玉米黄素的功能性食品提供理论参考。
1 材料与方法
1.1 试验材料
C57BL/6J小鼠,雄性,60只,体重17~20 g,SPF级,购自辽宁长生生物技术有限公司,许可证号:SCXK(辽)2015-0001。高脂饲料(生长繁殖饲料33%,酪蛋白粉20%,氢化椰子油22%,豆油17%)由吉林省中医药科学院提供。
玉米黄素,动物实验用纯度为75%(其它杂质为叶黄素),购自深圳格瑞博生物科技有限公司。
1.2 试剂与仪器
TRIzol试剂、反转录试剂盒PrimeScript II 1stStrand cDNA Synthesis Kit、荧光染料SYBR Premix Ex Taq TM (Tli RNaseH Plus) 均 购 自TAKARA公司,引物由长春海灵生物科贸有限公司负责设计并送TAKARA进行合成,兔抗AMPK、p-AMPK和β-actin单克隆抗体均购自CST。BCA蛋白浓度测定试剂盒,碧云天生物科技公司。其它试剂均为国产分析纯。
Allegra X-30R高速离心机,美国Beckman公司;-80℃超低温冰箱,美国Thermo公司;荧光倒置显微镜,德国Carl Zeiss公司;电子分析天平,德国Sartorius公司;TissuePrep快速组织细胞破碎仪,拜普诺(北京)贸易有限公司;PCR仪,德国Eppendorf公司;Agilent Stratagene Mx3000P 荧光定量PCR仪,美国安捷伦公司;凝胶电泳仪、半干转膜仪,美国伯乐公司;凝胶成像分析系统,美国GE公司。
1.3 方法
1.3.1 给药剂量 参照Sajilata等[9]研究,推荐玉米黄素人均日摄入量为2 mg/kg,本试验剂量设置为人体推荐量的10和20倍,故拟采用20和40 mg/kg剂量玉米黄素进行后续试验。
1.3.2 动物分组及饲养 60只小鼠根据Excel随机数法随机分为4组,分笼喂养,对照组(15只)使用正常的生长饲料,其余3个模型组(45只)使用高脂饮食饲料(脂肪比重大于26%),每周称重。4周后根据体重增长情况,对模型组小鼠进行筛选,选择体重超重的继续喂养,体重无显著变化的(具有高脂抗性)筛除。每组小鼠数量设置为12只。将合格的模型小鼠随机分为3组,分别为模型组,玉米黄素高剂量组,玉米黄素低剂量组,高、低剂量组分别按每日40和20 mg/kg灌胃玉米黄素(溶剂为0.5%羧甲基纤维素钠溶液,CMC-Na),模型和正常组每日按10 mL/kg灌胃0.5%CMCNa,每日1次,连续灌胃4周,期间继续分别给予正常和高脂饲料。每天观察小鼠生长状态,定时称重[10-11]。
1.3.3 取材及指标检测方法 给予玉米黄素干预4周即高脂饮食8周后,C57BL/6小鼠禁食12 h,眼静脉取血后,取附睾、肠系膜和肾周脂肪以及肝脏组织,称重,记录。取肝左叶组织,直接用10%甲醛固定,病理切片的制作和HE染色按照常规技术,光学显微镜观察评价和图片采集,观察肝脏细胞形态学变化。剩余组织均液氮速冻,-80℃超低温冰箱冻存。
1.3.4 玉米黄素对肝脏脂代谢及能量代谢相关因子表达的影响 肝脏组织经快速组织匀浆器破碎,利用TRIzol试剂提取肝脏总RNA,将高质量的RNA反转录为cDNA,利用SYBR荧光染料法检测脂代谢相关因子C/EBPα、SREBP1-c、ACC和CD36的mRNA相对表达量。在Agilent Stratagene Mx3000P荧光定量PCR仪上进行扩增,反应条件为95℃预变性30 s;40个循环:95℃变性10 s,60℃退火30 s,72℃延伸30 s;扩增结束建立PCR 产物的熔解曲线:95℃,1 min;55℃,30 s;95℃,30 s。以 β-actin 为内参对照,采用 2-ΔΔCt相对定量法计算各组基因表达情况。基因引物序列见表1。
1.3.5 玉米黄素对AMPK信号通路的影响 取适量肝脏组织加入蛋白裂解液,低温研磨提取总蛋白,利用BCA蛋白浓度测定试剂盒定量,取25 μg变性蛋白经SDS-PAGE电泳后转0.45 μm孔径 PVDF膜,5%BSA室温封闭1 h后加入待测一抗(1∶1 000),4℃孵育过夜;加入相应的二抗(1∶2 000),室温孵育 1 h,用 ECL发光显色,凝胶成像分析系统检测蛋白的表达,Quantity one软件分析试验结果。
1.4 统计分析
数据应用SPSS 19.0统计软件进行数据分析处理,各数值用±s表示。多样本间比较采用Oneway ANOVA检验,以P<0.05表示差异有统计学意义。
2 结果与分析
2.1 玉米黄素干预对实验动物体重影响
由表2可知,各组小鼠初始体重无显著性差异,造模4周后称重,模型组C57BL/6J小鼠体重比对照组显著(P<0.05)增加,成功建立高脂饮食诱导肥胖动物模型。选取合格模型小鼠用于后续玉米黄素干预试验,试验结束后玉米黄素低剂量组小鼠体重增加量显著降低。结果表明玉米黄素干预饮食诱导肥胖小鼠能够在一定程度上降低其体重增加量,减缓其肥胖进程。

表1 引物序列Table1 Primer sequences
表2 玉米黄素对高脂饲料诱导肥胖小鼠体重影响(±s,n=12)Table2 The effect of zeaxanthin on body wight of diet-induced obese mice(±s,n=12)
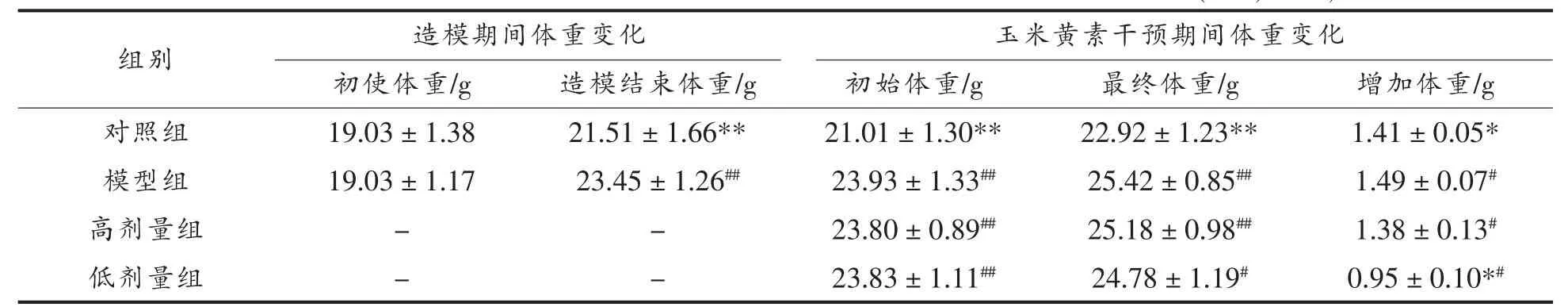
表2 玉米黄素对高脂饲料诱导肥胖小鼠体重影响(±s,n=12)Table2 The effect of zeaxanthin on body wight of diet-induced obese mice(±s,n=12)
注:# .与正常对照组比较差异显著(P<0.05);## .与正常对照组比较差异极显著(P<0.01);*.与高脂模型组比较差异显著(P<0.05);**.与高脂模型组比较差异极显著(P<0.01)。下同。
组别 造模期间体重变化 玉米黄素干预期间体重变化初使体重/g 造模结束体重/g 初始体重/g 最终体重/g 增加体重/g对照组 19.03±1.38 21.51±1.66** 21.01±1.30** 22.92±1.23** 1.41±0.05*模型组 19.03±1.17 23.45±1.26## 23.93±1.33## 25.42±0.85## 1.49±0.07# 高剂量组 - - 23.80±0.89## 25.18±0.98## 1.38±0.13# 低剂量组 - - 23.83±1.11## 24.78±1.19# 0.95±0.10*#
2.2 玉米黄素对腹腔脂肪和肝脏组织质量的影响
肥胖会引起体内脏器质量变化,从而影响机体代谢[12]。对脂肪和肝脏组织进行分离并称重测定,与对照组相比,模型组小鼠脂肪总质量和肝脏质量均显著升高(P<0.01 或 P<0.05);与模型组相比,玉米黄素具有降低脂肪组织总质量的趋势,显著降低肝脏组织质量,认为玉米黄素减缓体重增加与减缓脂肪组织增生和抑制肝脏组织质量增加有关。
2.3 玉米黄素对小鼠肝脏组织状态的影响
由肝脏组织HE染色结果可知,对照组肝组织偏暗红色,有光泽,肝细胞形态正常;模型组肝组织颜色红色偏淡,肝细胞周围有少许白色斑点状脂肪空泡出现,肝脏表现出轻微脂肪变性;玉米黄素高低剂量组肝脏颜色介于对照组和模型组之间,且肝细胞周围脂肪空泡现象较模型组有所减少。提示玉米黄素干预可以在一定程度上保护高脂饮食诱导的肝脏脂肪变性。
2.4 玉米黄素对肝脏脂质代谢与能量代谢相关基因表达的影响
高脂饮食使得肝脏组织中成脂转录相关因子C/EBPα、SREBP1-c和脂质代谢因子 ACC、CD36的mRNA表达水平升高,20 mg/kg玉米黄素干预能够显著降低成脂转录因子C/EBPα,脂肪合键酶ACC和脂肪酸转运蛋白CD36的表达,40 mg/kg玉米黄素干预能够显著降低SREBP1-c、ACC和CD36的表达。与对照组相比,高脂饮食显著降低能量代谢相关基因PGC-1α、UCP1和SIRT1的基因表达水平;相比于模型组,20和40 mg/kg玉米黄素干预能够显著提高UCP1的表达,但对PGC-1α和SIRT1基因水平无显著性影响。

图1 各处理组肝脏组织病理学变化(HE,200X)Fig.1 The histopathology of liver changed in each group (HE,200X)
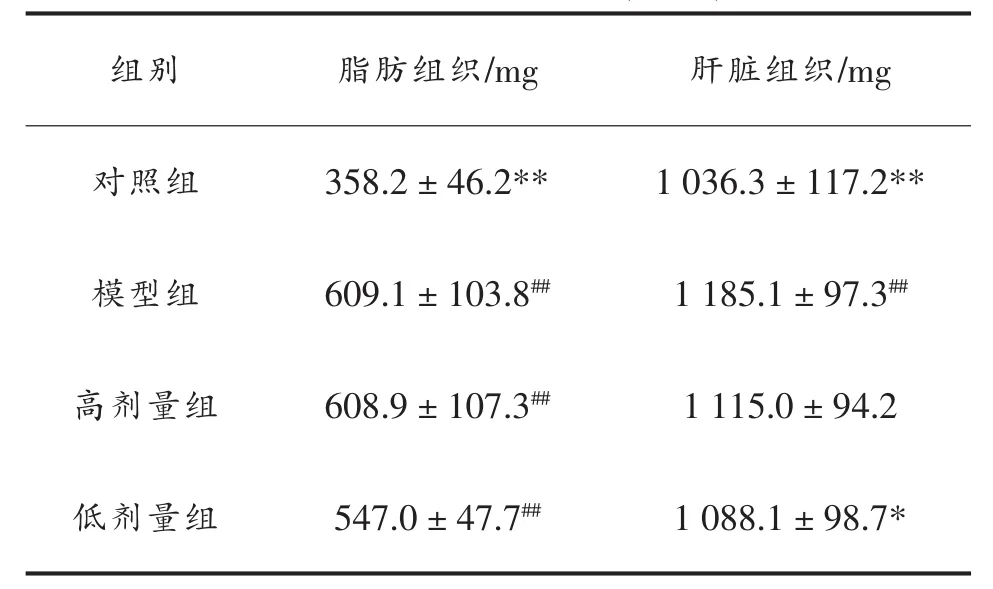
表3 玉米黄素对小鼠腹腔脂肪和肝脏组织质量及Lee’s 指数的影响(n=12)Table3 The effect of zeaxanthin on fat and liver mass and Lee’s index(n=12)

图2 玉米黄素对肝脏组织脂质代谢相关基因的影响 (n=5)Fig.2 Effects of zeaxanthin on mRNA expression involved in lipid metabolism in liver(n=5)
2.5 米黄素对AMPK信号通路相关蛋白的影响
如图4所示,与正常饮食对照组相比,高脂饮食能够显著降低AMPK磷酸化蛋白的比例,说明该信号通路受到一定程度的抑制;与模型组相比,经低剂量玉米黄素干预4周,小鼠肝脏组织p-AMPK蛋白表达量显著升高。

图3 玉米黄素对肝脏组织能量代谢相关基因的影响 (n=5)Fig.3 Effects of zeaxanthin on mRNA expression involved in energy metabolism in liver (n=5)
3 讨论与结论
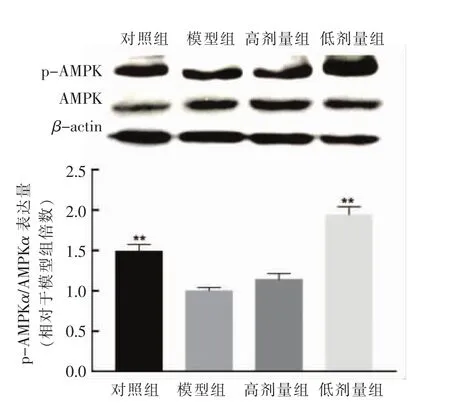
图4 玉米黄素对肝脏组织AMPK信号通路相关蛋白的影响(n=3)Fig.4 Effects of zeaxanthin on protein expression involved in AMPK pathway in liver (n=3)
饮食干预减缓肥胖进程已经得到越来越多的关注[15-16]。天然类胡萝卜素作为一种功能活性物质,具有较强的抗氧化活性[17],在降脂减肥方面也引起了一定的关注。高脂饮食是目前大多数人形成肥胖的主要原因,主要表现为促使机体体重增加。最近研究表明,机体肥胖状态与体内氧化应激水平密切相关[18],提示玉米黄素可能通过改善体内氧化应激水平发挥调节脂质代谢的作用。研究普遍认为,更高的作用剂量对应着更好的降脂效果,但也有一些研究[19-20]表明,低剂量干预物比高剂量降脂作用明显。本研究使用20和40 mg/kg的饲喂剂量,低剂量(20 mg/kg)玉米黄素对高脂饮食诱导肥胖小鼠的肝脏脂质代谢基因表达调控效果相对显著。Hao Han等[21]研究显示玉米黄素的同分异构体叶黄素能够有效改善高脂饮食诱导肥胖小鼠体内的氧化应激,调控脂质代谢,此外还能够显著抑制肥胖小鼠体重及内脏脂肪组织质量,且低剂量效果较好,但血清中,大多数生化指标中剂量组(50 mg/kg)不及低、高两剂量效果好。Jaswir等[22]研究显示叶黄素在低浓度时具有抗氧化效果,而高浓度则表现出促氧化效果。Ali El-Agamey[23]和Klaudia Jomova[24]等研究认为高浓度类胡萝卜素会降低其抗氧化效果,甚至具有促氧化作用。本研究中观察到低剂量组降脂效果优于高剂量组,推测原因之一可能与剂量范围有关,更高的作用剂量值得进一步研究;原因之二可能与玉米黄素本身的抗氧化与促氧化平衡有关,而体内氧化应激水平与机体肥胖状态有着紧密的关系。一些研究表明,相对高剂量的类胡萝卜素可由抗氧化剂转变为促氧化剂[25-27],当玉米黄素在磷脂膜上的浓度超过其临界浓度,会产生局部聚集并导致其猝灭单线态氧效果降低[28],进而影响其对机体氧化应激的保护作用。因此探寻玉米黄素最佳剂量以达到最优降脂效果值得深入研究。
国内外关于玉米黄素降脂功能研究甚少,李红艳利用鹌鹑模型从血管脂质过氧化保护方面,孙晓芳[29]利用昆明小鼠模型降低高脂血症小鼠的血脂方面分别论证了玉米黄素的降脂活性,均认为玉米黄素具有良好的降脂功能且呈剂量依赖型。而本研究与前人研究结果存在部分差异,可能原因是玉米黄素原料、剂量、饲喂周期、饲喂方式以及动物模型、造模方法不同所致,尤其是样品纯度和造模方式的差异,前人研究采用高脂建模与玉米黄素干预同步进行,而本研究采用先建立肥胖模型,再饮食干预的方式。本试验中样品纯度>75%,其它杂质成分经HPLC检测确定为叶黄素(纯度约17%),叶黄素为玉米黄素的同分异构体,且二者常共存于食物中,均具有较强的抗氧化活性,这与其生理功能密切相关。报道研究[30],二者淬灭单线态氧的能力相似。此外,目前我国食品行业中大部分工业中间体产品的纯度在70%左右。因此,本试验结果具有一定的实践参考价值。
肝脏是机体重要的代谢器官,主要参与内源性脂肪的合成与转运[31-32]。肝脏本不能储存脂肪,但如果脂质代谢动态失衡,则会导致肝脏摄取游离脂肪酸增加,游离脂肪酸内源性合成增加以及甘油三酯运转障碍等,最终导致甘油三酯堆积在肝脏细胞中,导致肝脏脂肪变性[33]。C/EBPα、SREBP1-c、ACC和CD36是参与肝脏脂质代谢的重要因子[34-35]。C/EBPα和SREBP1-c是脂肪代谢合成路径重要的转录因子,其靶基因包括控制脂肪合成的关键酶ACC和体内分布十分广泛的膜糖蛋白脂肪酸转位酶CD36,共同调控肝脏对脂肪酸的摄取[36]。玉米黄素对肝脏脂质累积的保护作用可能与降低肝脏脂质生成与转运相关因子C/EBPα、SREBP1-c、ACC和CD36的基因表达水平有关。相比于模型组,高、低剂量组对脂代谢相关基因转录水平的影响差异不大,但在降脂效果却体现了一定的差异,这与基因表达的翻译调控及翻译后蛋白修饰有一定关系[37],基因的表型受到环境及饮食等多种因素的影响,有研究报道[38]利用核糖体图谱分析技术检测心脏和肝脏基因,在翻译水平存在的差异性表达量是在转录水平检测到的两倍,并发现许多在人类心脏和肝脏中表达的基因主要在翻译水平受到调控。本研究中只对肝脏脂代谢相关基因的转录水平进行了检测,接下来有必要针对其蛋白水平进行研究。PGC-1α和UCP1与脂肪细胞内线粒体生物合成和脂肪酸氧化代谢有关,能够促进白色脂肪组织棕色化,提高能量代谢水平[39],SIRT1能够与成脂关键因子PPARγ启动子区域结合,从而抑制其活性及脂质形成[40]。基因水平显示玉米黄素干预能够在一定程度上提高肥胖机体的能量代谢水平,但具体的代谢水平差异需要进一步研究。AMPK信号通路在能量代谢中起着非常重要的作用,在肝脏中,AMPK的活化可以抑制葡萄糖和脂质的合成,促进脂质氧化及线粒体的生物合成[41]。
本研究中,肥胖动物模型建立成功后,添加20 mg/kg剂量玉米黄素干预能够在一定程度上降低小鼠肥胖进程,激活AMPK信号通路以调节肝脏脂质和能量代谢相关因子的表达。为玉米黄素作为功能性食品成分的进一步开发利用奠定了理论基础。

