鲍鱼内脏蛋白肽的理化性质及其抗氧化活性
李 婷 翁武银,2*
(1 集美大学食品与生物工程学院 福建厦门 361021
2 厦门市海洋功能食品重点实验室 福建厦门 361021)
在正常生理状态下机体都具备抗氧化防御系统,可以维持体内自由基的代谢平衡。当自由基失去动态平衡后,易造成机体功能紊乱与病变。虽然BHT、BHA、TBHQ等人工合成抗氧化剂具有良好的抗氧化活性,但它们对机体具有潜在毒副作用而受到消费者的抵触[1]。多肽类的天然抗氧化剂不仅可以为机体提供营养,还有助于预防氧化应激和慢性炎症引起的机体损伤,作为功能性食品和营养品的原料极具潜力[2]。
鲍鱼内脏富含蛋白和多糖,其提取物和酶解物均有良好的抗氧化活性[3-4]。叶燕军等[5]也报道鲍鱼内脏酶解物经不同超滤膜截留后,可获得不同抗氧化活性成分。通常,蛋白肽的抗氧化活性取决于它的分子质量、氨基酸组成和氨基酸序列[6]。由于蛋白肽经过胃、肠道各种酶作用后一级结构可能会发生变化,进而影响它的抗氧化活性[7],因此有必要通过体内抗氧化试验进行验证。
本研究考察了鲍鱼内脏蛋白肽(AVP)的理化性质及其体外抗氧化活性,探究AVP对D-半乳糖致衰老小鼠的抗氧化作用,旨在为鲍鱼内脏蛋白肽功能性产品的开发提供参考。
1 材料与方法
1.1 材料与试剂
鲍鱼内脏蛋白肽(AVP),厦门市百肽生物科技有限公司;还原型谷胱甘肽(GSH),上海捷瑞生物工程有限公司;1,1-二苯基-2-2三硝基苯肼(DPPH),日本和光纯药工业株式会社;亚油酸、硫酸亚铁,美国Sigma公司;多元素混合标准溶液,国家有色金属及电子材料分析测试中心。4月龄雌性小鼠(20 g±2 g),上海史莱克实验动物有限公司;D-半乳糖,上海阿拉丁生化科技股份有限公司;丙二醛(MDA)和超氧化物歧化酶(SOD)测试盒,南京建成生物工程研究所。
1.2 仪器与设备
UV-8000A紫外分光光度计,上海元析仪器有限公司;Agilent 1200高效液相色谱仪,美国Agilent公司;Optima 7000 DV电感耦合等离子发射光谱仪(ICP-OES),美国 Agilent公司。
1.3 基本成分的测定
粗蛋白质、粗脂肪、水分和灰分的含量按照国标法测定;粗多糖含量采用苯酚硫酸法[8]测定。
1.4 矿物质的测定
样品经550℃灰化、0.2%HNO3溶解、经0.45 μm滤膜过滤后,矿物质含量利用ICP-OES进行测定[9]。各元素含量依据最适吸收波长下所得出的标准曲线进行定量分析。
1.5 分子质量的测定
利用凝胶渗透色谱(GPC)[8]测定分子质量分布的情况。色谱柱为TSKgel G2000 SWXLL(300 mm×7.8 mm),流动相为乙腈/双蒸水/TFA(45∶55∶0.1,V/V/V)。在柱温 30℃、流速 0.5 mL/min、紫外检测波长214 nm的条件下,以细胞色素C(12 327 u)、抑肽酶(6 533 u)、氧化型谷胱甘肽(613 u)、Gly-Gly-Gly(189 u)和 Gly(75 u)作为标准品。
1.6 氨基酸的测定[10]
样品利用6 mol/L HCl溶解后,在110℃下水解消化22 h,通过旋转蒸发去除酸后,在利用0.02 mol/L HCl溶解,过0.22 μm滤膜,利用高效液相色谱仪测定结构氨基酸组成。另一方面,鲍鱼蛋白肽水溶液通过三氟乙酸和磺基水杨酸除蛋白后,再利用 0.02 mol/L HCl溶解,过0.22 μm滤膜,利用高效液相色谱仪测定游离氨基酸。
1.7 体外抗氧化活性的测定
1.7.1 羟自由基清除能力 参照Gu等[11]报道的方法并稍作修改。在1 mL样品中依次加入0.3 mL 8 mmol/L FeSO4、0.25 mL 20 mmol/L H2O2和1 mL 3 mmol/L水杨酸溶液,混匀后在 37℃水浴保温30 min,经流水冷却后,加入0.45 mL蒸馏水,测定510 nm下的吸光值,记为As,同样,以1 mL蒸馏水替代水杨酸作为样品对照值,记为A,空白组则以蒸馏水替代样品,记为A0。根据以下公式计算羟自由基清除率:
羟自由基清除率(%)=[1-(As-A)/A0]×100%
1.7.2 DPPH自由基清除能力 根据Hsu等[12]报道的方法稍作修改。在2 mL样品中加入2 mL 0.2 mmol/L DPPH乙醇溶液,于暗处室温下静置反应30 min,测定在517 nm下的吸光值,记为As,以2 mL乙醇替代DPPH乙醇溶液作为样品对照值,记为A,空白组则以蒸馏水替代样品,记为A0。根据以下公式计算DPPH自由基清除率:
DPPH 自由基清除率(%)=[1-(As-A)/A0]×100%
1.7.3 还原能力 根据Tsai等[13]报道的方法稍作修改。在1 mL样品中依次加入1 mL 0.2 mol/L磷酸盐缓冲液(pH 6.6)和1 mL 1%铁氰化钾溶液,在50℃水浴下反应20 min后,加入1 mL 10%三氯乙酸,离心(4 000 r/min,10 min),在 2 mL 的上清液中依次加入2 mL蒸馏水和0.4 mL 0.1%Fe-Cl3,静置10 min后,在波长700 nm下测定吸光值。
1.7.4 亚油酸氧化抑制活性[14]在0.5 mL样品中依次加入2.0 mL 0.2 mol/L磷酸盐缓冲液(pH 7.0)和2.5 mL 50 mmol/L亚油酸乳化液,混匀放在37℃下避光反应9 d。期间每隔24 h用硫氰酸铵法测定亚油酸的自动氧化。也就是,在0.1 mL亚油酸反应液中依次加入4.7 mL 75%乙醇溶液、0.1 mL 30%硫酸氰胺溶液和0.1 mL 20 mmol/L FeCl2溶液,混匀后于室温下静置3 min,测在波长500 nm下测定吸光值。以蒸馏水替代样品作为空白,以维生素C替代样品作为阳性对照。
1.8 体内抗氧化活性的测定
1.8.1 动物的氧化损伤模型及灌胃[15]60只雌性健康小鼠适应性饲养1周后,随机分成6组,每组10只。除正常组外,其余小鼠注射500 mg/(kg·d)D-半乳糖,连续造模6 w后,正常组(NOR)和模型(MOD)灌服生理盐水;GSH 对照组(GSH)和低剂量组 (AVP-L)、中剂量组 (AVP-M) 及高剂量(AVP-H) 分别灌胃 125 mg/(kg·d) GSH和 125 mg/(kg·d)、250 mg/(kg·d)、500 mg/(kg·d) AVP。在给受试样品的同时,GSH对照组和各剂量组继续给予相同剂量的D-半乳糖注射,持续4 w。
1.8.2 血液和脏器组织的生化指标 末次灌胃结束后并禁食12 h,眼球采血后加入0.2%肝素钠-生理盐水,通过离心(4℃,3 000 r/min,10 min),上清利用试剂盒检测SOD活力和MDA含量。
小鼠颈椎脱臼处死取其肝脏,加入0.2 mol/L磷酸盐缓冲液制备成10%匀浆液,通过离心(4℃,3 000 r/min,10 min),上清利用试剂盒测定SOD活力和MDA含量。
1.8.3 肝组织切片 小鼠肝脏利用10%甲醛溶液固定、包埋后,切片成厚度为4 μm的肝组织切片,依次经苏木精染料和伊红染料(HE)染色、梯度酒精和二甲苯脱水、透明后封片观察。
1.9 统计分析
试验结果以(x±s)表示,采用 SPSS 19.0单因素方差分析 (ANOVA)和显著性检验方法为Duncan多重比较,显著性分析取95%置信度(P<0.05)。
2 结果
2.1 基本成分
AVP中蛋白、碳水化合物和脂肪的含量分别为 65.07%±1.71%、5.11%±0.35%和0.58%±0.11%(表1),表明AVP可能还存在一小部分糖肽。此外,AVP的灰分含量高达6.60%±0.26%,因此对蛋白肽的矿物质组成进行测定,结果如表1所示。AVP中P元素含量最高,其次是Mg元素。另一方面,鲍鱼蛋白肽的微量元素主要以Fe和Zn元素为主,其它元素含量较低或未检测到。
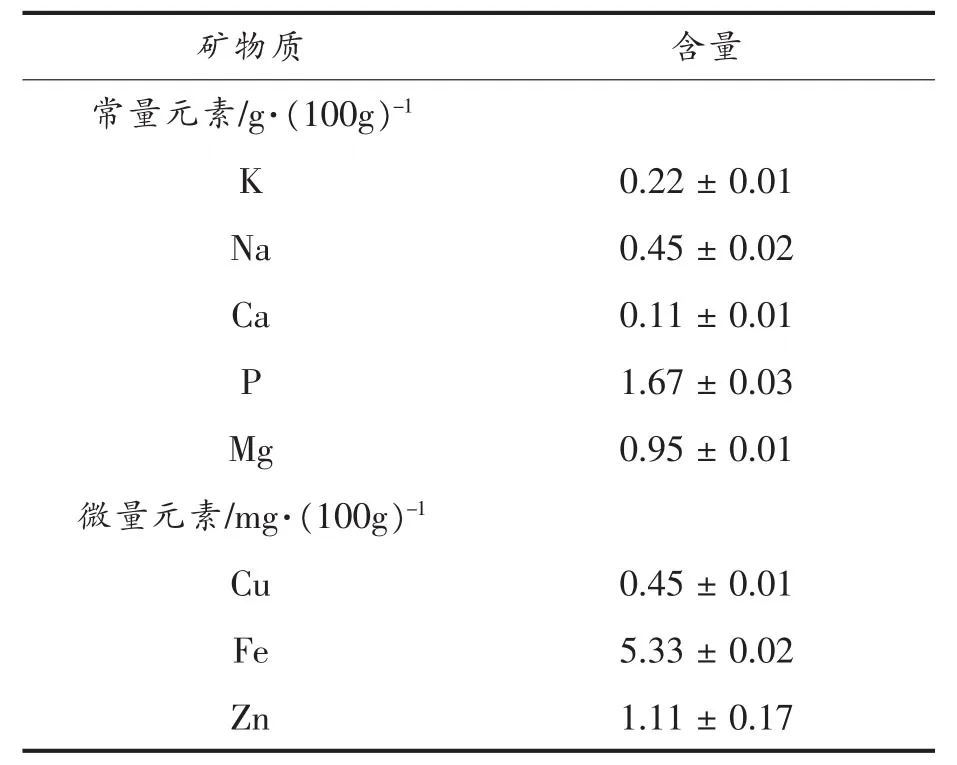
表1 鲍鱼内脏蛋白肽的矿物质组成Table1 Mineral composition of abalone visceral peptide
2.2 分子质量分布
AVP的分子质量主要集中分布在340 u附近,其中分子质量分布为 180~500 u组分含量占74.57% (图1),这表明该蛋白肽主要由2~4个氨基酸残基组成的寡肽。
2.3 氨基酸组成
AVP的结构氨基酸含量为68.40 g/100 g,而游离氨基酸只有7.10 g/100 g(表2),表明AVP主要是由寡肽组成。在AVP的结构氨基酸中,含量最高的是 Leu,其次为 Arg、Ala、Lys和 Glu。此外,疏水性氨基酸和支链氨基酸在总氨基酸中的占比分别高达49.77%和22.92%。

图1 鲍鱼内脏蛋白肽的HPLC色谱图Fig.1 HPLC chromatograms of abalone visceral peptide
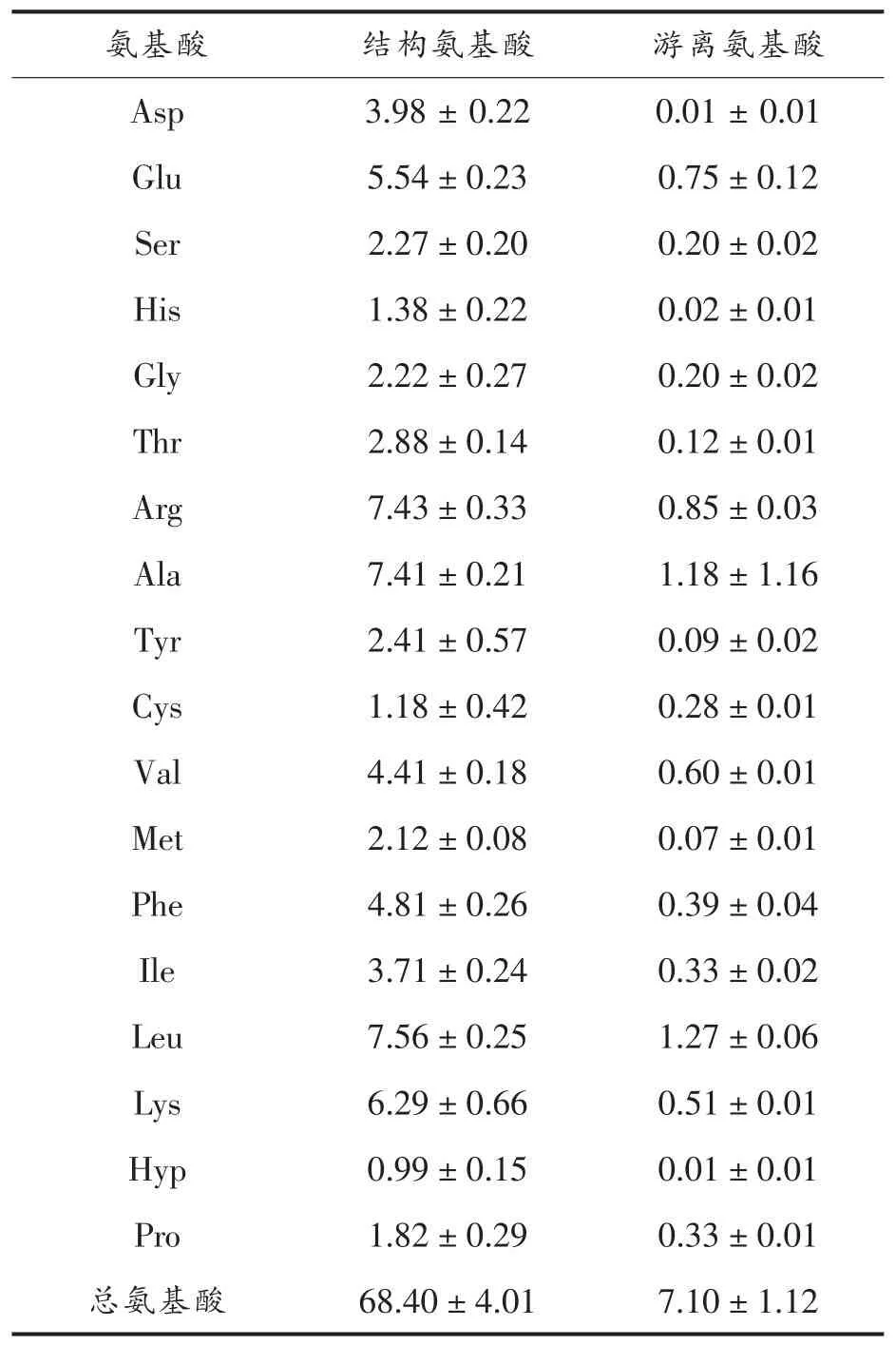
表2 鲍鱼内脏蛋白肽的氨基酸组成(g/100g)Table2 Amino acid composition of abalone visceral peptide (g/100g)
2.4 体外抗氧化活性
当蛋白肽质量浓度低于5 mg/mL时,AVP的自由基清除活性及还原能力与质量浓度之间存在明显的线性关系(图2)。AVP对羟自由基清除能力的EC50为1.54 mg/mL±0.04 mg/mL,比GSH(EC50=2.13 mg/mL ± 0.04 mg/mL) 还低 (图2a)。AVP浓度对DPPH自由基清除能力的影响趋势(图2b)类似于羟自由基的清除效果。然而,AVP对DPPH自由基清除能力的EC50(1.51 mg/mL±0.09 mg/mL)却高于 GSH(EC50=0.32 mg/mL±0.08 mg/mL)。当AVP质量浓度达到7 mg/mL时,还原能力在A500nm波长下的吸光值可以达到1.8(图2c)。添加0.2 mg/mL AVP的亚油酸在37℃下放置7 d,其吸光值明显低于空白组,表明AVP可以抑制亚油酸的自氧化(图2d)。AVP抑制亚油酸自氧化的能力伴随AVP浓度的提高而增加。当亚油酸中AVP质量浓度为1.6 mg/mL时,其吸光值低于添加2 mg/mL维生素C,表明AVP抑制亚油酸自氧化的能力优于维生素C。
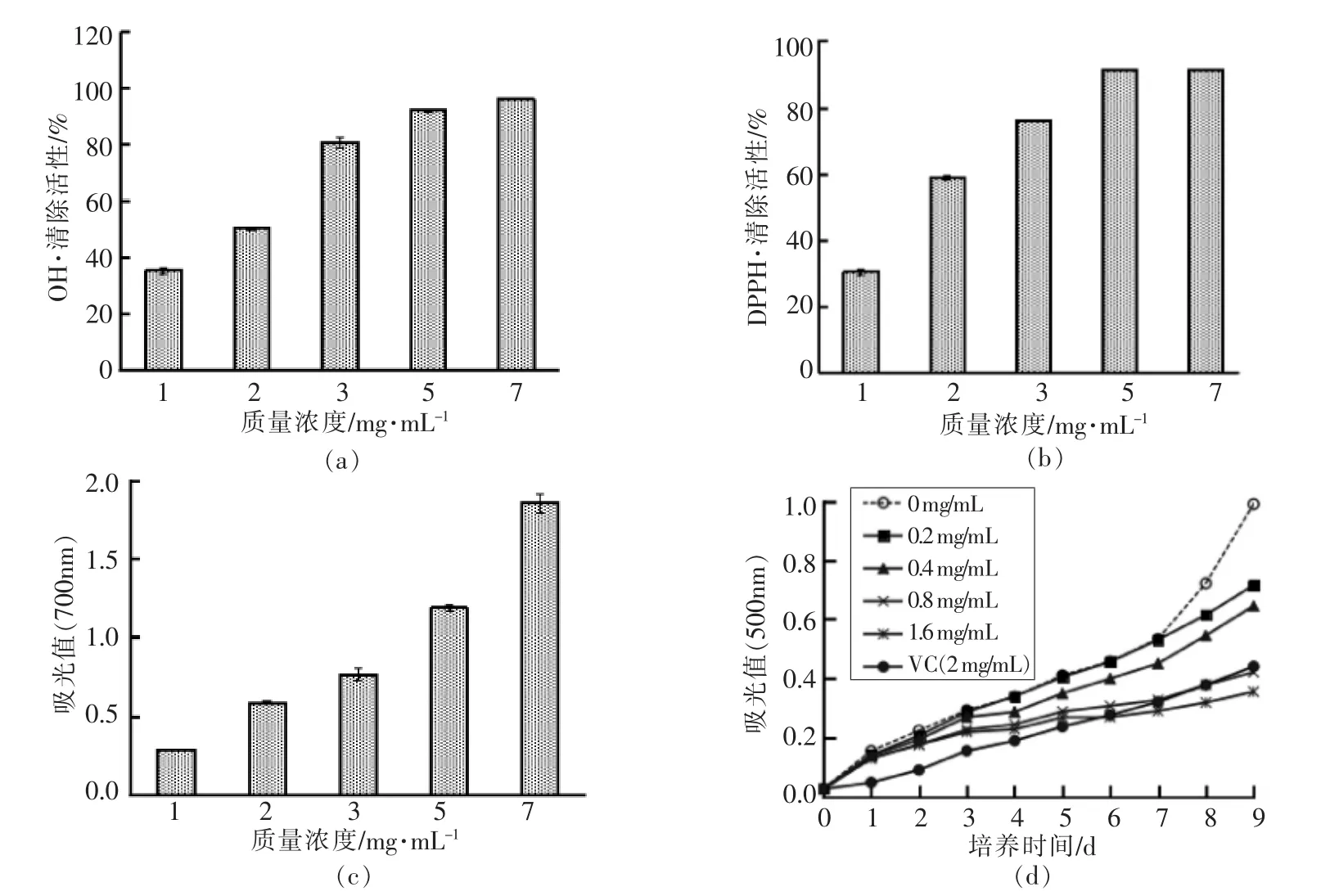
图2 鲍鱼内脏蛋白肽对羟自由基、DPPH自由基的清除能力、还原能力和亚油酸的抑制效果Fig.2 Hydroxyl (a),DPPH radical-scavenging ability (b),reducting power (c) and lipid peroxidation inhibitory effect (d) of abalone visceral peptide
2.5 体内抗氧化活性
2.5.1 血清和肝脏的生化指标 在考察AVP对D-半乳糖诱导氧化损伤小鼠影响的试验期间,各剂量组AVP对小鼠肝脏指数都无明显影响(数据未显示),说明AVP具有食用安全性。表3显示了AVP对氧化损伤小鼠血清、肝脏的MDA和SOD活性的影响。相对于NOR组,MOD组小鼠血清中的MDA含量出现极显著增加 (P<0.01)。经灌食AVP后,小鼠血清中的MDA含量出现下降,AVPM和AVP-H组中的血清MDA含量甚至比GSH阳性对照组低。MOD组小鼠血清中的SOD活性明显低于NOR组(P<0.05),灌食 GSH后小鼠血清中的SOD活性得到提高并接近NOR组。AVP组小鼠血清中的SOD活性都显著高于NOR组(P<0.05),但剂量对小鼠血清SOD活性没有明显的影响。另一方面,小鼠经D-半乳糖诱导氧化损伤后肝脏中的MDA含量没有出现明显的变化,而且除了AVP-H组出现一定程度的下降,其它给样组也没有发生显著变化。然而,MOD组小鼠肝脏SOD活性显著低于NOR组(P<0.01)。经灌喂AVP后,低剂量组小鼠肝脏SOD活性接近GSH组,而中剂量组和高剂量组小鼠肝脏SOD活性均显著高于NOR组(P<0.05)。这些结果表明AVP可以提高D-半乳糖致衰老小鼠血清和肝脏中的SOD活性,进而降低血清中MDA的含量。

表3 鲍鱼内脏蛋白肽对小鼠肝脏和血清中MDA含量、SOD活性的影响(n=10)Table3 Effect of abalone visceral peptide on MDA leveland SOD activity in serum and liver of mice (n=10)
2.5.2 肝脏组织病理学的观察 图3显示了小鼠肝脏组织切片的结果。NOR组小鼠的肝脏组织结构完整,肝细胞分界清晰,细胞核大而圆,胞质丰富,而MOD组的肝索紊乱,肝细胞肿胀疏松,肝窦消失和呈现少许出血点。这说明小鼠经D-半乳糖氧化损伤后,呈现出细胞衰老特有的现象,证明衰老模型成功建立。经灌食GSH后,发现小鼠肝脏细胞结构已趋于正常,胞质均匀,肝小叶细胞界限清晰。另一方面,AVP各剂量组的作用效果与GSH相当,但没有发现明显的量效依赖性。这些结果说明AVP同GSH一样具有修复D-半乳糖致衰老小鼠肝细胞受损的功能。
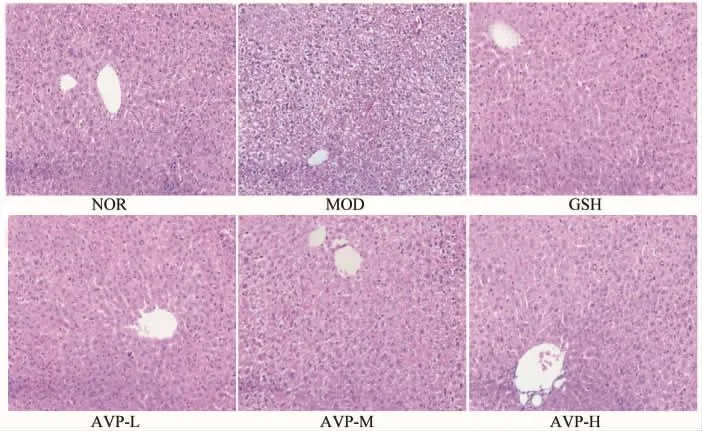
图3 小鼠肝脏组织切片 (苏木精-伊红染色,200×)Fig.3 Histopathological images of mice liver slices (stained with hematoxylin and eosin,200×)
3 讨论
机体内过剩的自由基通常会导致生命体发生氧化损伤,而抗氧化肽不仅具有抑制脂质过氧化、清除自由基的能力[16],还具有较高的营养价值和其它保健功能。本研究使用的蛋白肽是来源于鲍鱼内脏,通过酶解和膜分离等技术精制得到的。鲍鱼内脏蛋白肽(AVP)的分子质量主要分布在180~500 u(图1),而且富含Leu为主的疏水性氨基酸(表2)。有研究表明,蛋白肽的抗氧化能力与分子质量和氨基酸组成紧密相关[6],当分子质量小于500 u时,抗氧化能力越强[17]。蛋白肽中Leu含量越高,肽的抗氧化活性越强[18]。而且,疏水性氨基酸形成的疏水肽比亲水肽具有更强的自由基清除活性[19]。体外抗氧化试验结果也证明了AVP不仅具有良好还原能力,而且其羟自由基清除能力和抑制脂质过氧化能力分别优于GSH和维生素C(图2)。因此,小分子寡肽AVP将具有优越的抗氧化生物活性功能。
D-半乳糖氧化损伤模型是研究体内抗氧化功能中比较成熟的造模方法,常结合 SOD等体内抗氧化酶的活性和MDA等脂质过氧化物含量的变化对体内抗氧化进行评价[15,20]。在本研究中,小鼠经D-半乳糖氧化损伤后血清中的MDA含量出现明显的增加,SOD活性明显下降,而且小鼠肝细胞肿胀,肝索消失,肝血窦内呈现出血点等现象,表明D-半乳糖诱导造模成功。D-半乳糖致衰老的小鼠经灌食AVP后,发现小鼠血清和肝脏中的SOD活性均得到提高,而血清中MDA含量出现明显下降(表3),肝脏组织的损伤明显得到修复(图3),部分效果甚至超过GSH。有研究报道,支链氨基酸可以缓解氧化应激造成的氧化损伤[21],寡肽的抗氧化活性比蛋白质和氨基酸更强[22],而且二肽、三肽可以直接被小肠吸收,其吸收代谢速度比游离氨基酸还快[23]。因此,富含支链氨基酸的AVP经过胃肠道时可能不需要消化就被吸收,结果使AVP在体内也发挥良好的抗氧化活性功能。
4 结论
鲍鱼内脏蛋白肽 (AVP)是以低分子质量(180~500 u)为主的寡肽,富含疏水性氨基酸和支链氨基酸,含有少量的多糖和矿物质元素。体外抗氧化活性的结果表明,AVP具有良好的清除自由基活性、还原能力和抑制亚油酸自动氧化能力。另一方面,通过D-半乳糖氧化损伤模型,发现AVP可以提高D-半乳糖致衰小鼠血清和肝脏中SOD活性,降低血清的MDA含量,减缓肝脏组织氧化损伤。因此,AVP不仅可以提供营养物质,还具备良好的体内外抗氧化活性,在抗氧化抗衰老功能性食品或营养品的开发和运用上将具有很大的潜能。

