热处理条件对南极磷虾酶活性的影响
王凯欣,欧阳杰,沈 建,谈佳玉,马田田
(1 上海海洋大学食品学院,上海 200120;2 中国水产科学研究院渔业机械仪器研究所,上海 200092)
南极磷虾(Antarctickrill)是一种生活在南极洲水域的磷虾,单种资源数量位居地球生物前列,物种生长周期短,资源量丰富,在有序合理的开发下,能够创造出巨大而有效的经济价值[1- 3]。中国在2009年开始南极磷虾捕捞,然而相对国外渔业发达国家,存在技术落后、船载精深加工能力低等问题。目前中国正在研究南极磷虾船载设备的快速分离与加工技术,磷虾捕获后在船上直接进行虾粉制品加工[4],南极磷虾粉作为主要产品之一,其工艺流程为:原料→蒸煮→离心脱水→一次干燥→二次干燥→粉碎→包装→成品[5- 7]。南极海域寒冷、严酷的生存环境形成了南极磷虾酶独特的酶学特性,体内存在着独特、高效的酶活体系[8],较高的酶活性导致产品品质受到不同程度的破坏和损失,成为现阶段加工过程中的主要难点之一。在虾粉加工的初始蒸煮阶段进行有效灭酶,成为提高品质必要的处理步骤。
南极磷虾体内存在着较高活性的酶系,该酶系具有迅速降解南极磷虾体内营养物质的能力[9],这种现象对南极磷虾的加工生产有着一定的影响。目前,国内外尚未有针对蒸煮阶段热处理条件对南极磷虾酶的影响的研究,相关研究主要集中在分离纯化和酶学性质等方面,如向宇等[10]研究了南极磷虾胰蛋白酶的分离纯化、酶学性质及其生物活性;陈怡炫等[11]研究蛋白酶抑制剂的开发等。
通过正交试验设计的方法,研究蒸煮阶段加热温度、加热时间、颗粒大小对磷虾多酚氧化酶、蛋白酶、脂肪酶的影响,旨在探究热处理条件与南极磷虾酶活性之间的变化规律,以期得到高效的蒸煮灭酶条件,降低由于酶活较高而导致品质受损的风险,为南极磷虾粉船载加工设备的热处理条件提供参考。
1 材料与方法
1.1 材料与仪器
南极磷虾,2018年捕捞,贮藏于-20℃冷库中备用,购于中国水产有限公司;L- 脯氨酸、酪氨酸、福林试剂,生化试剂,国药集团化学试剂有限公司;邻苯二酚、干酪素(化学纯试剂),国药集团化学试剂有限公司;磷酸二氢钠二水、十二水合磷酸氢二钠、三氯乙酸、碳酸钠、盐酸、异丙醇、95 %乙醇(分析纯试剂),国药集团化学试剂有限公司; Tris、阿拉伯胶、对硝基苯酚、硝基苯酚棕榈酸酯(分析纯试剂),上海阿拉丁生化科技股份有限公司。
UV- 2204PC紫外可见分光光度仪,上海精密仪器有限公司;GTR16- 2 高速台式冷冻离心机,北京时代北利离心机有限公司;DK- S22型电热恒温水浴锅,上海精宏实验设备有限公司;QV- 1530蒸煮锅,浙江爱仕达电器股份有限公司;FSH- 2A可调高速匀浆机,方科仪器有限公司;HT- 9815热电偶温度计,鸿泰仪表有限公司。
1.2 原材料处理
取冷冻南极磷虾进行常温流水解冻,解冻完全后在0 ℃冰箱中沥干水分备用。采用蒸汽加热与隔水加热相组合的方式,称取磷虾50 g整虾放置于小烧杯中,将热电偶温度计探头浸没在磷虾中,达到目标温度后迅速取出,置于恒温水浴锅中在同样温度保温加热;热加工处理结束后按虾与缓冲液的比例为1∶5(g/mL)加入事先预冷的磷酸缓冲液,在高速匀浆机中匀浆后于0 ℃冰箱中静置4 h;将匀浆液于0 ℃下10 000 r/min冷冻离心30 min,离心后取上清液即为粗酶液。
1.3 测定方法
1.3.1 多酚氧化酶活性测定
采用L- 脯氨酸- 儿茶酚分光光度法[12- 14],以儿茶酚为底物,将2.2 mL、pH 7.2预冷的0.1 mol/L磷酸缓冲液,0.2 mL、0.5 mol/L的L- 脯氨酸和儿茶酚依次加入比色皿中,最后加入0.2 mL酶液,迅速摇匀,37 ℃条件下水浴10 min,在波长530 nm处比色[15- 16]。多酚氧化酶活力定义[17]:在37 ℃、pH 7.2、波长530 nm条件下,以吸光度每分钟改变0.001为一个酶活力单位U。
1.3.2 蛋白酶活性测定
参照国标SB/T 10317—1999[17]及杨英等[19]的方法略微修改,每管内加入1 mL酶液、2 mL预热的1 %酪蛋白溶液,在37 ℃恒温水浴中保温10 min,取出后立即加入2 mL三氯乙酸,迅速摇匀,静置使残余蛋白质沉淀后离心(10 000 r/min)15 min,取上清液于另外测定管内,每管加入1 mL上清液、5 mL碳酸钠溶液、1 mL福林试剂,摇匀置于水浴保温发色20 min后于660 nm进行吸光值测定[19]。蛋白酶活力定义[21]:在37 ℃测定条件下,每分钟水解酪蛋白产生1 μg酪氨酸定义为1个蛋白酶活力单位U。
1.3.3 脂肪酶活性测定
参照HUBERT[22]的方法略微修改,称取3 mg硝基苯酚棕榈酸酯(p- NPP)溶于1 mL异丙醇中作为底物溶液,用pH 8.0、0.05 mol/L的Tris- HCL缓冲液配制成5%质量浓度的阿拉伯胶作为缓冲液;取100 μL底物溶液和2.6 mL缓冲液混合均匀后,加入1 mL、0.05 mol/L、pH 8.0的Tris- HCL溶液,混合均匀,37 ℃恒温水浴中预热2 min;加入300 μL酶液,在37 ℃恒温水浴中反应15 min,立即加入95%乙醇终止反应,10 000 r/min离心3 min后于410 nm处测定吸光值。脂肪酶活力单位定义:在37 ℃测定条件下,样品水解硝基苯酚棕榈酸酯(p- NPP)每分钟生成1 μmol对硝基苯酚所需要的酶量,以U表示。
1.4 试验方法设计
1.4.1 热处理条件对南极磷虾酶的影响
取整虾蒸煮,在不同加热温度(75 ℃、85 ℃、95 ℃)的加热条件下,观察多酚氧化酶、蛋白酶和脂肪酶与加热时间的变化规律。
1.4.2 单因素试验设计
(1)加热温度对南极磷虾酶的影响。固定加热时间为2.5 min,整虾蒸煮,加热温度设置为35 ℃,45 ℃,55 ℃,65 ℃,75 ℃,85 ℃,95 ℃,探究加热温度对南极磷虾酶活性的影响。
(2)加热时间对南极磷虾酶的影响。固定加热温度为85 ℃,整虾蒸煮,加热时间设置为0.5、1.5、2.5、3.5、4.5和5 min,探究加热时间对南极磷虾酶活性的影响。
(3)颗粒度大小对南极磷虾酶的影响。固定加热温度为85 ℃,加热时间为2.5 min,南极磷虾颗粒规格(指圆柱形颗粒纵长)设置为3、2、1、0.8、0.6、0.4和0.2 cm,探究颗粒规格对南极磷虾酶活性的影响。
1.4.3 正交试验设计
对比单因素试验中的加热温度、加热时间和颗粒规格对南极磷虾多酚氧化酶、蛋白酶和脂肪酶活性的影响,选择最优水平范围,设计正交试验。
2 结果与讨论
2.1 不同加热温度、加热时间对南极磷虾酶的影响
由图1可知,南极磷虾酶活性在3个不同加热温度下,均随着加热时间的增加而降低,且温度越高酶活性越低,但3个温度在5 min内均不能使南极磷虾酶完全失活,这与向宇[9]研究的温度对南极磷虾酶促反应速率的影响结果相似。由多酚氧化酶的变化曲线可知,热处理条件为85 ℃、2.5 min和85 ℃、3.5 min时的多酚氧化酶活性均低于加热时间为95 ℃、0.5 min和95 ℃、1.5 min时的活性。由此可知,85 ℃较长时间的热处理条件灭酶效果优于95 ℃较短时间的条件。蛋白酶在85 ℃时灭酶程度接近于95 ℃时的灭酶条件。脂肪酶在95 ℃时呈现出不规律的变化趋势,这可能是由于高温导致脂肪酶的变性。因此,85 ℃的加热温度优于95 ℃,同时考虑到高温对磷虾成分的影响,设置85 ℃的加热条件较适宜。
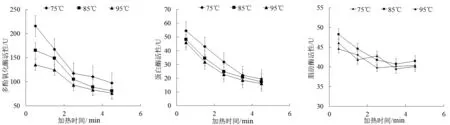
图1 加热温度、加热时间对多酚氧化酶、蛋白酶和脂肪酶的影响Fig.1 Effects of heating temperature and heating time on polyphenol oxidase,protease and lipase
2.2 单因素试验结果
2.2.1 热处理过程中加热温度对南极磷虾酶的影响
由图2可知,在35 ℃~55 ℃内,多酚氧化酶活性随着加热温度的升高而升高,55 ℃时活性最大,温度高于55 ℃时多酚氧化酶与加热温度之间呈现连续下降的关系。
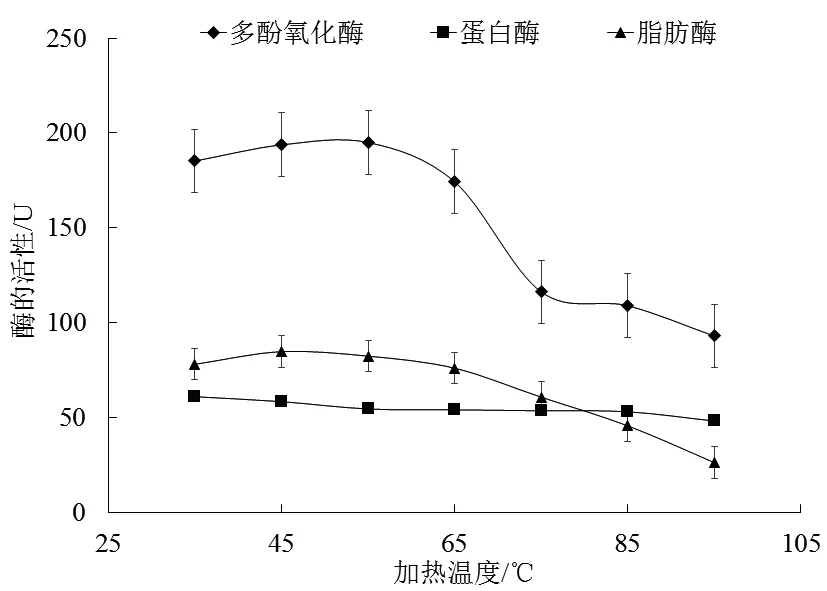
图2 加热温度对南极磷虾酶的影响Fig.2 Effects of heating temperature on Antarctic krill enzyme
蛋白酶活性在35 ℃~ 45 ℃范围随着温度的升高而升高,当温度达到45 ℃后不断降低。陈怡炫[11]在南极磷虾蛋白酶研究中也发现此趋势。在整个加热温度变化的影响下,脂肪酶活性变化较小,只有小范围的波动。综合考虑3种酶受温度影响的变化,确定正交试验的加热温度水平为75 ℃、85 ℃、95 ℃。庄志凯[23]在研究凡纳滨对虾虾头内源酶酶学性质时发现,虾体内脂肪酶在达到60 ℃之后就会变性失活,导致酶活力降低。
2.2.2 热处理过程中加热时间对南极磷虾酶的影响
由图3可知,南极磷虾酶活性随着时间的增加而不断降低。
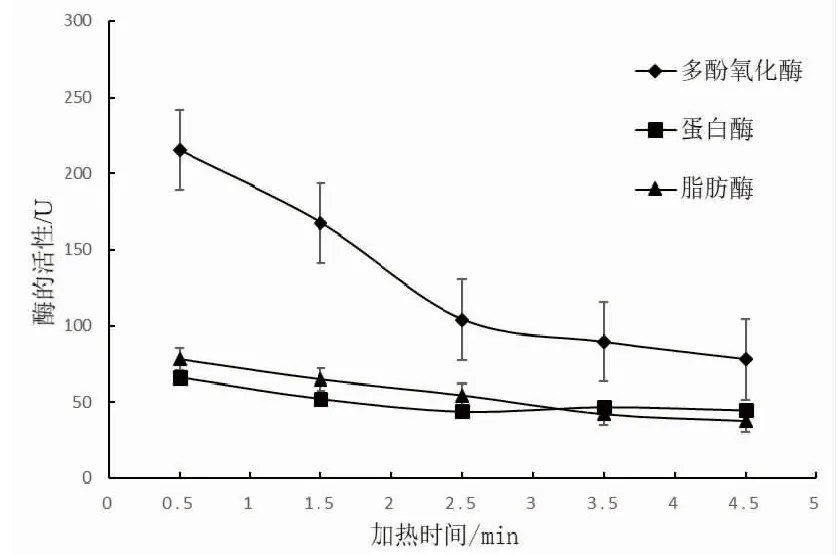
图3 加热时间对南极磷虾酶的影响Fig.3 Effects of heating time on Antarctic krill enzyme
脂肪酶的活性随时间变化的规律不明显,呈现此现象的原因可能是:南极磷虾体内的脂肪酶含量较少,活性较低,导致加热时间的变化对脂肪酶酶活影响不明显;随着加热时间的延长,南极磷虾体内的脂肪发生了氧化分解,此时脂肪酶的活性并不会对脂肪含量产生较大的作用。有研究表明,脂肪酶在较高温度下酶活性下降缓慢,可能与酶对温度的适应性有关[24]。这种适应性导致当热处理温度为85 ℃时,随着时间的增加脂肪酶变化呈现较小波动。据此设计正交试验的加热时间因素水平为2.5 min、3.5 min、4.5 min。
2.2.3 热处理过程中颗粒规格对南极磷虾酶的影响
由图4可知,当颗粒规格为0.4 cm时,多酚氧化酶、蛋白酶和脂肪酶3种酶活性均达到较低的水平。
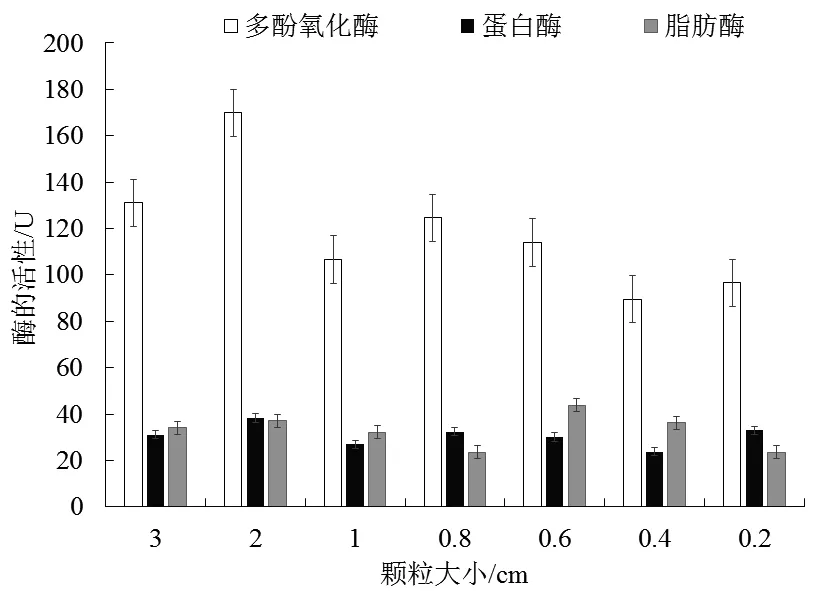
图4 颗粒大小对南极磷虾酶的影响Fig.4 Effects of particle size on Antarctic krill enzyme
从图中可以看出,当颗粒规格小于1 cm时,南极磷虾酶的活性低于颗粒规格大于1 cm时的活性。此现象说明在热加工处理中,采用不同程度的切割措施(如刮板式加热对磷虾进行破碎)有助于降低南极磷虾体内酶活性。这可能是因为随着颗粒规格的降低,南极磷虾虾肉直接暴露在高温下的接触面积不断扩大,含有较多酶活性的部位直接受到高温的作用,导致其酶活降低。这与马田田[25]通过增加物料受热面积来影响南极磷虾营养成分的结果相似。综合考虑,正交试验设计的颗粒规格水平设为0.4 cm、0.6 cm和1 cm。
2.3 正交试验设计分析
在前期单因素试验结果的基础上,试验包括3个因素,每个因素包括3个水平(表1),采用L9(34)正交设计试验,确定每种酶高效灭酶的热处理条件。
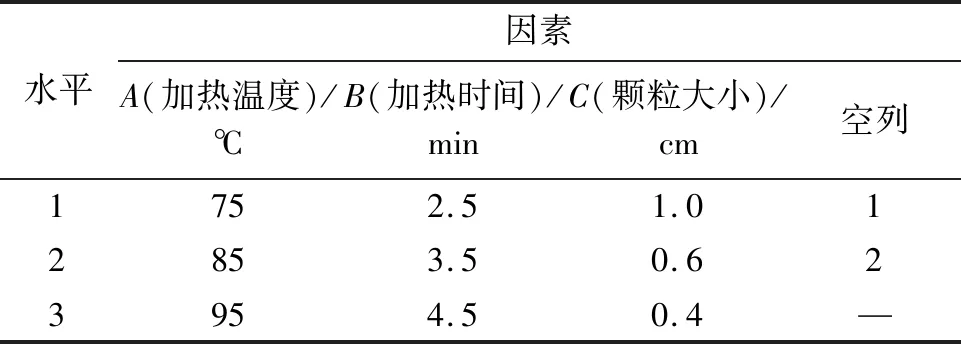
表1 正交试验因素与水平Tab.1 Orthogonal test factors and levels
由正交试验结果表1~3显示,方案A2B1C3为多酚氧化酶正交试验的最优水平组合,该方案不包含在正交表排出的试验方案中,应与正交表中最优试验方案A3B1C3作对比验证试验。每组方案设20个重复,得到A2B1C3灭酶效率为(71.32±0.10)%,A3B1C3方案灭酶效率达到(72.92±0.10)%。两组试验方案灭酶效率相差较小,在提高效率、降低能耗的综合考虑下,确定最佳正交方案应为A2B1C3。张琥[26]在马铃薯灭酶工艺优化试验中表明马铃薯片中多酚氧化酶相对活性低于35%时,基本不会引起酶促褐变反应。同理可得,A1B2C2为蛋白酶正交试验的最优水平组合,A1B1C3为脂肪酶正交试验的最优水平组合,方差分析表明A、B、C因素对脂肪酶灭活均无显著影响。
2.4 最佳灭酶条件
通过3组正交试验结果分析(表4),颗粒规格对多酚氧化酶、蛋白酶的酶活性影响均显著,加热时间对多酚氧化酶的酶活性影响显著,加热温度对南极磷虾酶活性的影响均不显著。因多酚氧化酶活性显著性大于蛋白酶和脂肪酶的酶活性,在颗粒度0.6 cm与0.4 cm差异较小的情况下,选择以多酚氧化酶灭酶颗粒度0.4 cm;加热时间和加热温度在2.5 min与3.5 min、75℃与85℃之间,考虑到对多酚氧化酶的显著性以及节约能耗、提高生产效率等因素,选择2.5 min、85℃较适宜,得到南极磷虾酶最佳灭酶条件为加热温度85℃、加热时间2.5 min、颗粒规格0.4 cm。在此条件下进行试验,每组设20个重复,得到多酚氧化酶、蛋白酶和脂肪酶的平均灭酶效率分别为(71.32±0.10)%、(68.42±0.10)%和(65.19±0.10)%,可明显改善南极磷虾酶在加工过程中的影响。本文加工中抑制酶活性的方法主要采用物理方法,因化学抑制剂通常易引起食品安全问题,但也有如杭虞杰[27]等采用大豆胰蛋白酶抑制剂对南极磷虾类胰蛋白酶的抑制动力学的研究,未来有望将化学与物理方法相结合进行研究,会有较好的前景。
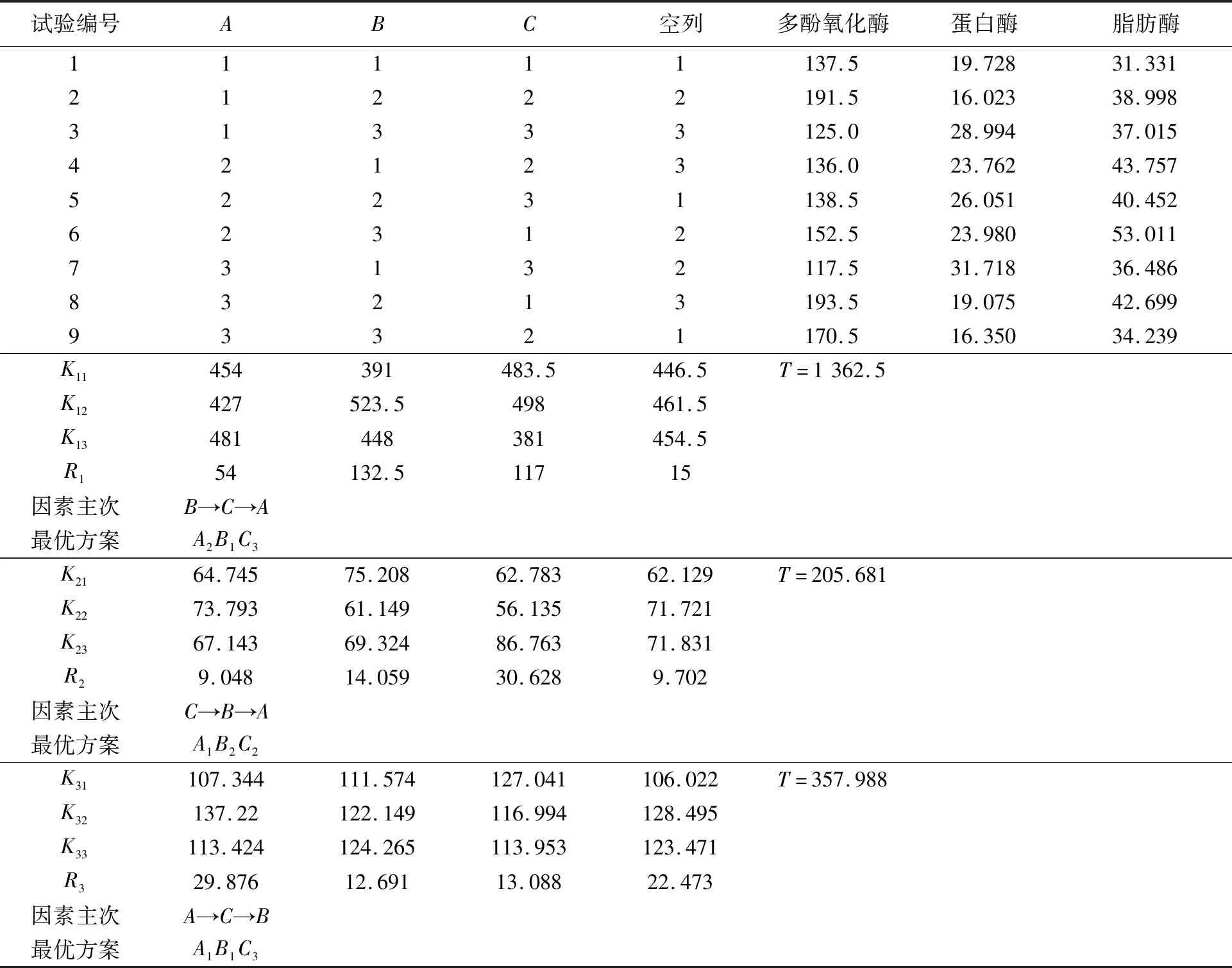
表2 南极磷虾酶正交试验结果Tab.2 Orthogonal test results of Antarctic krill enzyme

表3 正交试验方差分析Tab.3 Analysis of variance of orthogonal test
注:表中“*”表示具有显著性;下标1表示多酚氧化酶;下标2表示蛋白酶;下标3表示多酚氧化酶

表4 南极磷虾酶正交试验分析比较Tab.4 Comparison of orthogonal test analysis of Antarctic krill enzyme
3 结论
热处理条件对多酚氧化酶影响显著,对蛋白酶次之,对脂肪酶影响不显著。南极磷虾酶的总体活性随着加热温度的升高,呈现先升高后逐渐下降的趋势;随着加热时间的增长呈现不断下降的趋势;颗粒规格小于1 cm时的总体酶活普遍低于颗粒规格大于1 cm时的总体酶活。通过正交试验得到南极磷虾酶的最佳灭酶条件为加热温度85 ℃、加热时间2.5 min、颗粒规格0.4 cm,使用此热处理条件进行蒸煮试验,可明显降低南极磷虾酶在加工过程中的影响,为南极磷虾粉加工过程蒸煮阶段热处理条件的设置提供参考。

