金黄色葡萄球菌LukS-PV-GFP融合蛋白的载体构建及表达纯化
汪自然,常文娇,戴媛媛,马筱玲
金黄色葡萄球菌LukS-PV和LukF-PV共同组成杀白细胞素(Panton-Valentine leukocidin,PVL),二者在分叶核中性粒细胞(polymorphonuclear neutrophils,PMNs)上形成聚合体,通过膜穿孔机制引发细胞裂解和凋亡[1-2]。前期研究[3-6]表明,LukS-PV单组分对于白血病细胞具有诱导凋亡和分化的双重作用,因而LukS-PV有望成为一种新的白血病治疗药物,具有深入研究的价值。绿色荧光蛋白(green fluorescent protein, GFP)是由Shimomura et al[7]于1962年从多管水母中纯化得到的能够自发出绿色荧光的蛋白,GFP作为一种理想的标签蛋白,能够用于蛋白功能定位研究。该研究通过构建LukS-PV基因与GFP基因融合表达载体,并进行表达纯化及鉴定,为进一步研究LukS-PV的功能定位和相互作用奠定了基础。
1 材料与方法
1.1 材料
1.1.1质粒与菌株 pet28a-N6H-GFP质粒由中国科学技术大学臧建业教授惠赠;大肠杆菌DH5α、BL21、金黄色葡萄球菌铜23均由本实验室保存。
1.1.2主要试剂 T载体pMD-18T、DNA Taq酶、限制性内切酶BamHⅠ、XhoⅠ,DNA Ligation Kit购于日本takara公司;DNA胶回收试剂盒和快速质粒小提试剂盒购于北京天根公司;蛋白纯化试剂盒购于美国Novagen公司;BCA试剂盒购于上海碧云天公司;抗His单克隆抗体和抗GFP单克隆抗体购于美国CST公司;羊抗兔IgG抗体购于武汉abclonal公司。
1.2 方法
1.2.1LukS-PV的基因扩增与基因克隆 煮沸法提取金黄色葡萄球菌铜23的DNA作为PCR模板,具体提取方法见参考文献[8]。根据LukS-PV序列设计引物,送安徽通用生物技术公司合成。上游5′ -ACGGGATCCGAATCTAAAGCTGATAACAATATTGA G-3′,下游5′-ACCCTCGAGTCAATTATGTCCTTTCAC TTTAATTTC-3′(上下游引物分别引入限制性内切酶BamH I和Xho I酶切位点)。PCR具体的反应条件为:预变性94 ℃、 5 min,变性94 ℃、30 s,退火51 ℃、30 s,延伸72 ℃、45 s,共30个循环,72 ℃延伸8 min。PCR回收产物4 μl、pMD-18T载体1 μl、solutionI 5 μl于4 ℃过夜连接。次日将连接产物使用热激法(42 ℃、90 s)转化入DH5α菌中,使用氨苄青霉素筛选单克隆,置于37 ℃温箱培养过夜,挑取单个菌落,摇菌提质粒,双酶切后送安徽通用生物技术公司测序。
1.2.2LukS-PV-GFP重组融合质粒的构建与鉴定 测序鉴定正确后,使用限制性核酸内切酶BamH I、Xho I同时对pMD-18T-LukS-PV和pet28a-N6H-GFP质粒37 ℃、2 h进行双酶切。分别回收pMD-18T-LukS-PV的目的片段和表达载体pet28a-N6H-GFP的载体片段,测定DNA浓度后按目的片段和载体片段5:1于4 ℃连接过夜,次日将连接产物转化至感受态DH5α菌中,均匀涂布于卡那霉素LB 平板上,置于37 ℃温箱过夜,挑取单个菌落,摇菌提质粒,进行双酶切鉴定和DNA测序。最后将鉴定无误的质粒转化入大肠杆菌BL21中保存备用。
1.2.3重组融合蛋白的诱导表达与纯化 取保存的菌液涂布于卡那平板活化后,挑取单菌落加入LB培养基中,按1 ∶1 000加入卡那霉素,37 ℃过夜培养后转至100 ml的LB培养基至对数生长期,即A600约为0.6~0.8时,留取一管菌液作诱导前对照,加入IPTG使终浓度达到1 mmol/L,诱导条件为37 ℃、200 r/min,分别在1、2、3、4、5、6 h取样,使用10%SDS-PAGE电泳分析各时间点的重组融合蛋白表达量。诱导5 h后离心收集细菌,弃去培养基,20 ml PBS重悬细菌沉淀后将重悬菌液超声破碎,离心后上清液使用His树脂蛋白纯化试剂盒,纯化蛋白并测定蛋白浓度。分别取诱导前细菌、诱导5 h细菌、诱导6 h细菌、诱导5 h细菌超声破碎离心后的上清液、诱导5 h细菌超声破碎离心后的沉淀、纯化后的LukS-PV-GFP蛋白加入上样缓冲液100 ℃、10 min变性后使用12% SDS-PAGE电泳分析表达量。
1.2.4重组融合蛋白表达宿主的荧光检测 含有LukS-PV-GFP重组质粒的BL21菌活化后,分别取诱导前和IPTG诱导5 h菌液,取样涂片,将玻片置于荧光显微镜下观察是否能够自发荧光。
1.2.5重组融合蛋白的Western blot检测 分别取诱导前、纯化后蛋白样品,加入上样缓冲液后100 ℃、10 min变性,使用10%的SDS-PAGE电泳分离后,转至NC膜,转膜条件为200 mA、90 min。NC膜经5%脱脂牛奶封闭2 h后,分别与His单克隆抗体(一抗,1 ∶1 000)、GFP单克隆抗体(一抗,1 ∶1 000)4 ℃孵育过夜。次日洗去一抗,加入羊抗兔IgG抗体(二抗)孵育2 h,洗去二抗,加入显色剂后显色。
2 结果
2.1 LukS-PV的基因扩增与鉴定分析PCR扩增后产物经1%琼脂糖凝胶电泳分析,大约在867 bp处有一条较为明亮的条带,与预计相符(图1A)。重组质粒经过BamHⅠ与XhoⅠ双酶切后显示出目的基因片段约867 bp(图1B)。酶切产物经正反向DNA测序分析,所得序列与NCBI数据库中序列完全一致。见图2、3。
2.2 重组蛋白的诱导表达分别取诱导前和诱导1、2、3、4、5、6 h 的蛋白做SDS-PAGE电泳(图4A),结果显示诱导前无重组融合蛋白表达,经过IPTG诱导后在63 ku左右出现明显的蛋白条带,大小与预测相符,且5 h时重组融合蛋白表达量最高,可以用于后续蛋白纯化。诱导前细菌、诱导5 h细菌、诱导6 h细胞、诱导5 h细菌超声破碎离心后的上清液、诱导5 h细菌超声破碎离心后的沉淀、纯化后的LukS-PV-GFP蛋白经12%的SDS-PAGE凝胶电泳检测显示(图4B),超声破碎后,上清中可见明显表达条带,表明其为可溶性表达。纯化后蛋白条带浓厚,杂带较少,BCA法测定纯化后蛋白产物浓度为1.2 mg/ml。
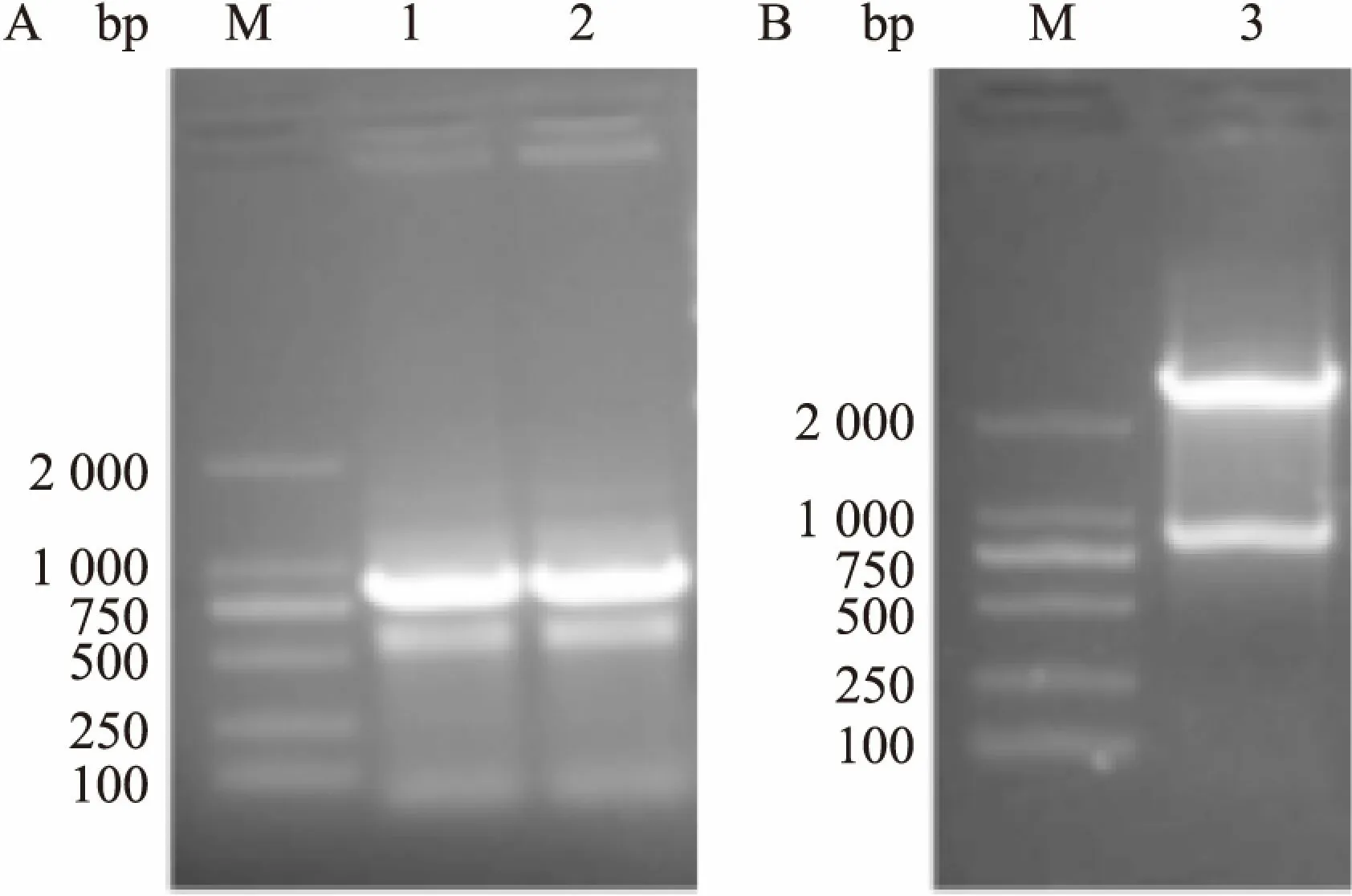
图1 LukS-PV的PCR扩增与重组质粒的双酶切鉴定电泳
A: LukS-PV的PCR扩增图;B: 重组质粒BamH Ⅰ、Xho Ⅰ双酶切电泳图;M: DNA Marker;1、2: PCR产物;3: 双酶切产物
2.3 重组质粒LukS-PV-GFP在大肠杆菌BL21中的表达与检测含有LukS-PV-GFP质粒的BL21菌,IPTG诱导前无绿色荧光。经IPTG诱导5 h后,取菌液涂片,可以在荧光显微镜下观察到明显散发绿光的单个细菌(图5)。取1.5 ml菌液离心,可见绿色菌体沉淀,且纯化后的蛋白溶液也为绿色。
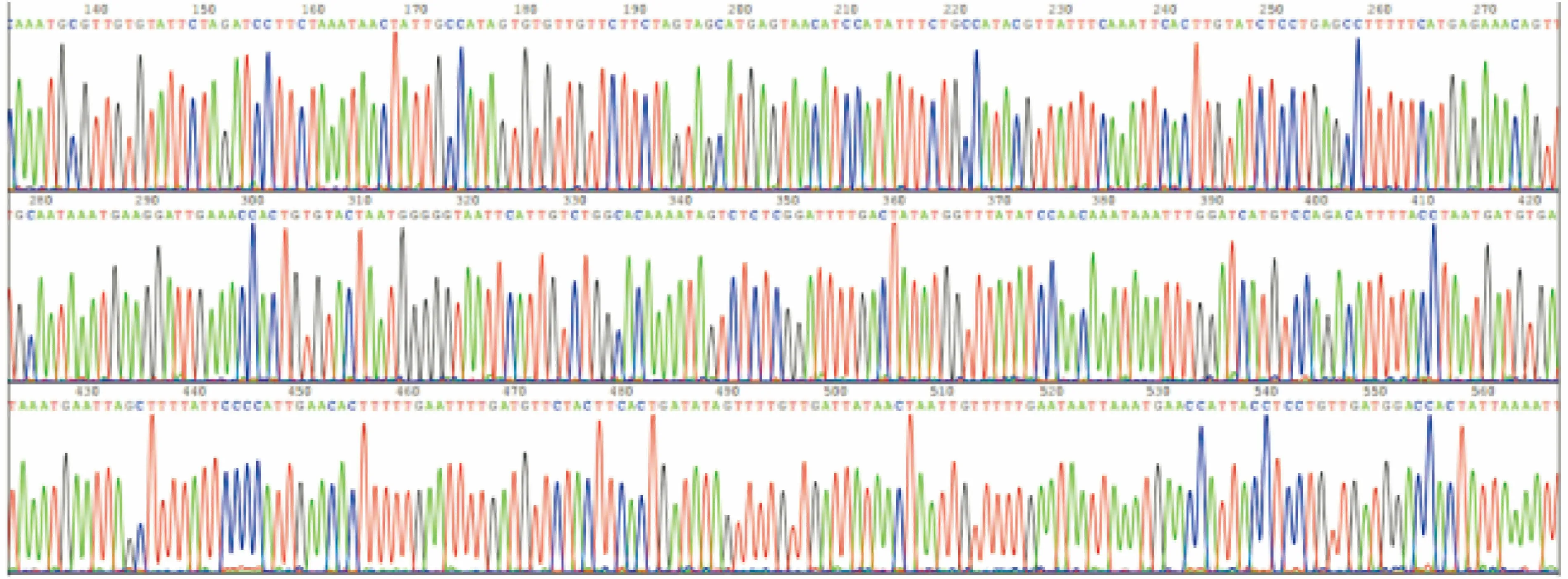
图2 双酶切产物部分测序图
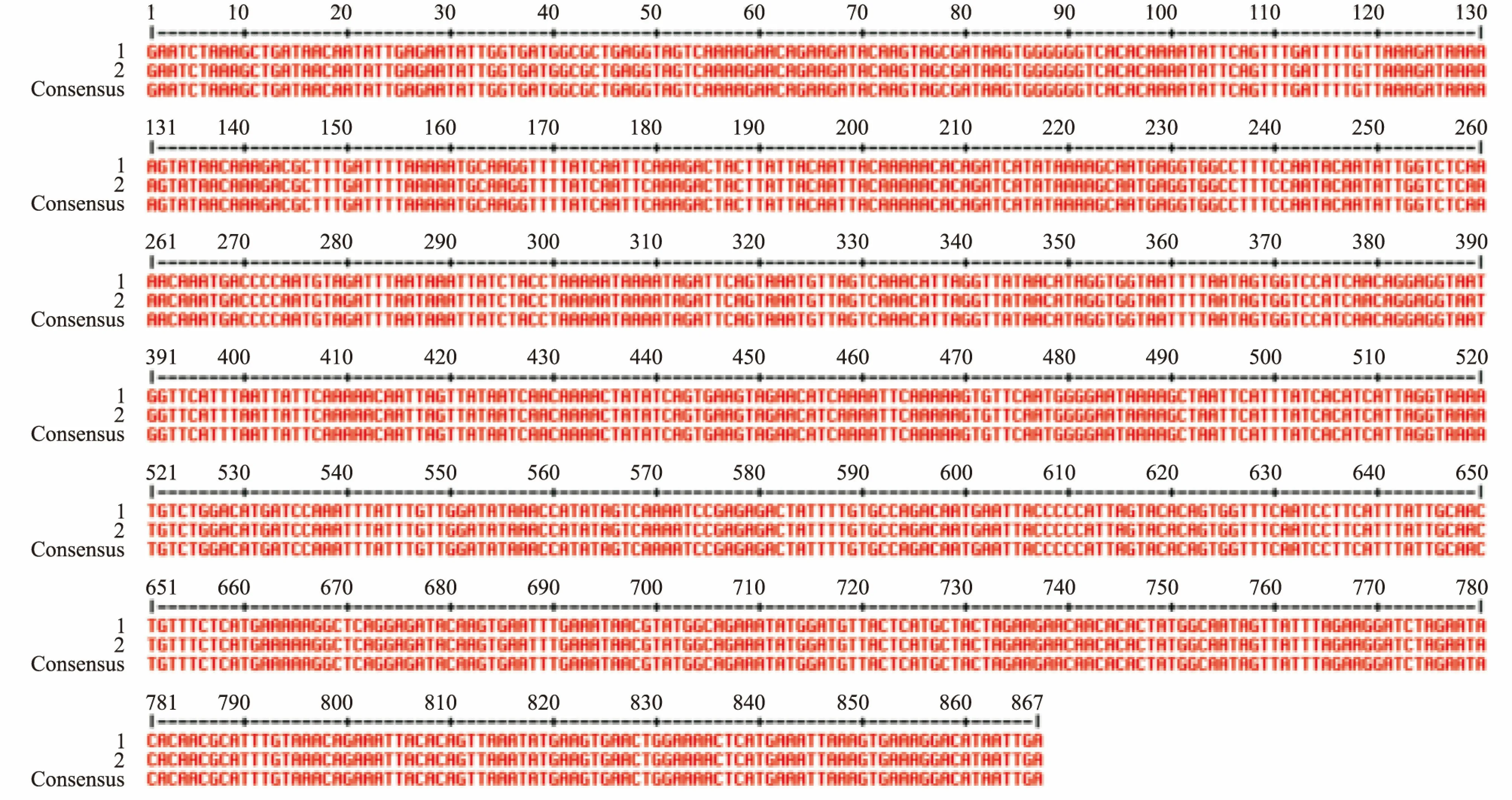
图3 测序结果与Gene Bank中LukS-PV基因序列比对
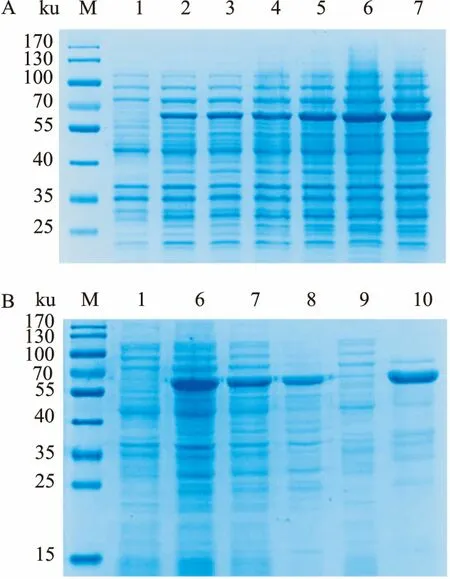
图4 LukS-PV-GFP表达产物SDS-PAGE分析
A:LukS-PV-GFP-BL21诱导不同时间点产物SDS-PAGE分析图;B: LukS-PV-GFP-BL21纯化产物SDS-PAGE分析图;M:蛋白Marker;1:诱导前;2:诱导1 h;3:诱导2 h;4:诱导3 h;5:诱导4 h;6:诱导5 h;7:诱导6 h;8:超声破碎后上清液;9:超声破碎后沉淀;10:纯化后的LukS-PV-GFP蛋白
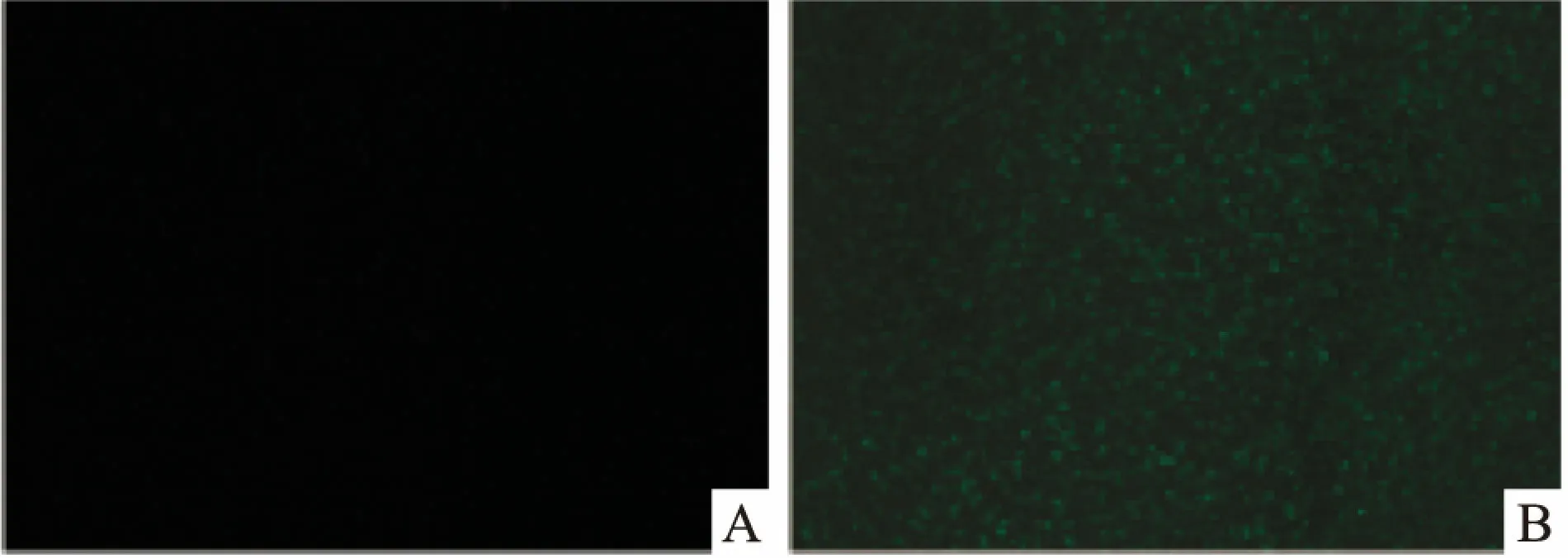
图5 重组质粒在BL21大肠杆菌荧光显微镜下图像 ×100A:诱导前;B:诱导5 h后
2.4 重组融合蛋白的Western blot鉴定Western blot检测显示,未加入IPTG诱导时无相应的条带,经IPTG诱导后纯化的重组融合蛋白分别使用抗His单克隆抗体(图6A)和抗GFP单克隆抗体(图6B)鉴定,在约63 ku左右位置均出现明显条带,与预期相符,表明重组融合蛋白表达成功。
3 讨论
LukS-PV是金黄色葡萄球菌分泌的PVL中的一个亚单位,课题组前期实验表明,LukS-PV可诱导人髓系白血病细胞、乳腺癌细胞、肝癌细胞、肺癌细胞凋亡,具有抗肿瘤作用,具有深入研究的价值。GFP无需底物、辅助因子的参与即可自发出绿色荧光,易于观察,且表达的荧光蛋白不会对宿主本身产生毒性[9]。因此,GFP已成为生物化学分子生物学领域的重要标记分子。
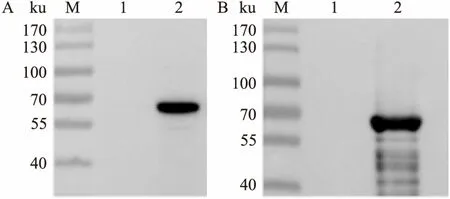
图6 纯化重组融合蛋白的Western blot鉴定
A:使用抗His单克隆抗体鉴定;B:使用抗GFP单克隆抗体鉴定;M:蛋白Marker;1:诱导前;2:纯化后重组融合蛋白
大肠杆菌系统对许多蛋白耐受能力较强,能高效稳定表达出目的蛋白,已广泛应用于外源蛋白的表达及纯化[10]。外源蛋白在大肠杆菌中表达分为主要存在于上清液中的可溶性表达和主要存在于沉淀中的包涵体表达。高玉录 等[11]将LukS-PV基因克隆到Rosetta(DE3) plys宿主菌中,SDS-PAGE电泳显示重组蛋白主要存在于包涵体内,上清液表达较少。常文娇 等[12]通过去除LukS-PV基因的引导肽,降低了引导肽对蛋白表达的影响,促进了LukS-PV的可溶性表达。本研究以此为基础,构建了LukS-PV与GFP的重组融合蛋白,电泳显示重组融合蛋白主要存在于上清液中,无需进行变复性处理,对蛋白的生物学活性影响较小。含有重组质粒的大肠杆菌BL21诱导前无荧光,经IPTG诱导后可以在荧光显微镜下自发出绿色荧光,纯化后蛋白浓度和纯度均较高,表明了融合蛋白在大肠杆菌系统中得到了高效稳定的表达。
使用GFP作为分子标签是目前研究蛋白质亚定位、动态变化和表达量改变的有效方法[13]。GFP与目的蛋白融合形成荧光标记分子,可以研究目标蛋白的动态变化和与其他蛋白相互作用。本实验构建LukS-PV基因与GFP基因融合表达载体后导入大肠杆菌中表达并进行纯化,实现了对LukS-PV精确定位和动态观察,为进一步研究LukS-PV的功能定位和相互作用奠定了基础。

