DHRS2蛋白对结直肠癌细胞化疗敏感性的影响
李济民,杨 芳,袁伟奇,王 昊,罗以勤
结直肠癌(colorectal cancer, CRC)是临床常见的一种消化道恶性肿瘤,在全球其致死率位居恶性肿瘤第二位[1]。目前,奥沙利铂(oxaliplatin)作为治疗结直肠癌患者的一线用药,可以明显改善晚期或转移性结直肠癌患者总生存期。然而,在治疗过程中,患者对奥沙利铂的获得性耐药日益严重成为肿瘤治疗失败的主要原因[2]。因此,研究其耐药机制已成为治疗结直肠癌耐药的关键因素。该研究通过体外诱导建立奥沙利铂耐药细胞模型,并利用串联质谱标签法(tandem mass tag, TMT)分析结直肠癌细胞耐药前后蛋白表达差异。本实验选取出表达差异显著的短链脱氢还原酶超家族2 (dehydrogenase/reductase SDR family member 2, DHRS2)蛋白作为后续研究对象,利用小干扰RNA(siRNA)技术下调DHRS2的表达,研究其对结直肠癌耐药细胞的耐药性的影响,以期探索克服肿瘤细胞耐药的有效途径。
1 材料与方法
1.1 主要材料人结肠癌细胞HCT116细胞株购于中国科学院上海生命科学研究院;奥沙利铂耐药株HCT116/OXA(用奥沙利铂诱导产生)由本实验室自建;CCK-8试剂购自日本同仁公司;奥沙利铂购自美国Sigma公司;蛋白裂解液IP、5×蛋白上样缓冲液和BCA试剂盒均购自上海碧云天生物技术有限公司;切除修复交叉互补基因1(excision repair cross-complementation group 1,ERCC1)、DHRS2、P53和β-actin抗体均购于武汉Proteintech公司;辣根过氧化物酶(HRP)偶联的抗兔及抗鼠IgG购于美国Jackson ImmunoResearch公司;ECL化学发光底物购自美国Thermo公司;DHRS2和P53基因干扰序列均由上海吉玛公司设计合成。
1.2 方法
1.2.1细胞培养 HCT116和HCT116/OXA细胞用RPMI-1640培养基(含双抗)、10%胎牛血清,在37 ℃、5%CO2的培养箱中培养。
1.2.2CCK-8法检测细胞存活率 取对数生长期的HCT116和HCT116/OXA细胞,消化后以1×104/ml密度接种于96孔培养板,过夜贴壁后用连续浓度奥沙利铂处理。培养48 h后, 每孔加入10 μl CCK-8试剂,37 ℃,孵育1 h后,利用酶标仪测定450 nm处的吸光度值。每组设6个复孔,阴性对照组(NC组)加入等量的培养基,同时设置不含细胞和培养基的空白孔。据此计算细胞生存率。
1.2.3细胞转染 取对数生长期细胞,消化后接种培养于6孔板中,待细胞汇合至60%~70%进行转染。将siRNA溶解于Opti-MEM培养基中, 同时另取Lipofectamine 2000加入Opti-MEM培养基中, 室温孵育5 min, 然后将两者轻轻混合, 室温静置20 min。期间将6孔板细胞培养基更换为不含胎牛血清培养基,并将上述转染混合物加入各组细胞, 置于细胞培养箱中培养。4~6 h后,将培养基更换为完全培养基继续培养48 h,提取细胞蛋白测定转染效率并进行后续实验分析。
1.2.4蛋白提取和蛋白质印迹检测 用预冷PBS清洗细胞3遍,每孔加入80 μl左右蛋白裂解液,冰上裂解15 min后,用细胞刮将细胞从6孔板底部刮离,使细胞和裂解液充分混匀。在裂解15 min后,4 ℃、12 000 r/min离心20 min,收集上清液,即为总蛋白溶液,用BCA法测定其蛋白浓度。等质量蛋白样品经10% SDS-PAGE电泳分离后,经300 mA、90 min湿转至PVDF膜上,5%脱脂奶粉室温封闭2 h, 分别加入以1 ∶1 000稀释的DHRS2、ERCC1、P53和β-actin抗体孵育过夜。经TBST洗涤后,加入HRP标记的特异性的羊抗兔或羊抗鼠的二抗以1 ∶5 000室温孵育2 h,TBST洗涤3次,每次10 min,最后用ECL化学发光试剂显影。
1.2.5TMT定量蛋白组学 由杭州景杰生物科技有限公司完成。
1.2.5.1 TMT标记及HPLC分级 将培养的HCT116和HCT116/OXA细胞进行收集,后加入蛋白裂解液后进行超声裂解。4 ℃、12 000 r/min离心20 min,转移上清液至新的离心管。利用BCA法进行蛋白浓度测定。胰酶酶解的肽段用Strata X C18(Phenomenex)除盐后真空冷冻干燥。用0.5 mol/L TEAB溶解肽段,然后根据TMT试剂盒说明标记肽段。肽段用高pH反向HPLC分级,色谱柱为Agilent 300Extend C18。
1.2.5.2 质谱分析 肽段经由超高效液相系统分离后被注入NSI离子源中进行电离然后进Q ExactiveTM质谱进行分析。离子源电压设置为2.1 kV,肽段母离子及其二级碎片都使用高分辨的Orbitrap进行检测和分析。二级质谱数据使用Maxquant (v1.5.2.8)进行检索。
1.2.5.3 生物信息学分析 将蛋白质组学的数据进行分析处理后,以1.5倍为变化阈值 (Fold change≥1.5或≤0.67) ,P<0.05为标准。
2 结果
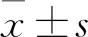
2.1 HCT116/OXA耐药细胞模型验证CCK-8检测结果显示,HCT116和HCT116/OXA细胞在不同浓度奥沙利铂处理48 h后,根据公式计算得出HCT116和HCT116/OXA细胞的IC50分别为(21±1.1)μg/ml和(59±0.98)μg/ml,差异有统计学意义(t=44.68,P<0.01),见图1A。Western blot结果表明,铂类耐药相关蛋白ERCC1在HCT116/OXA细胞中显著升高(图1B)。
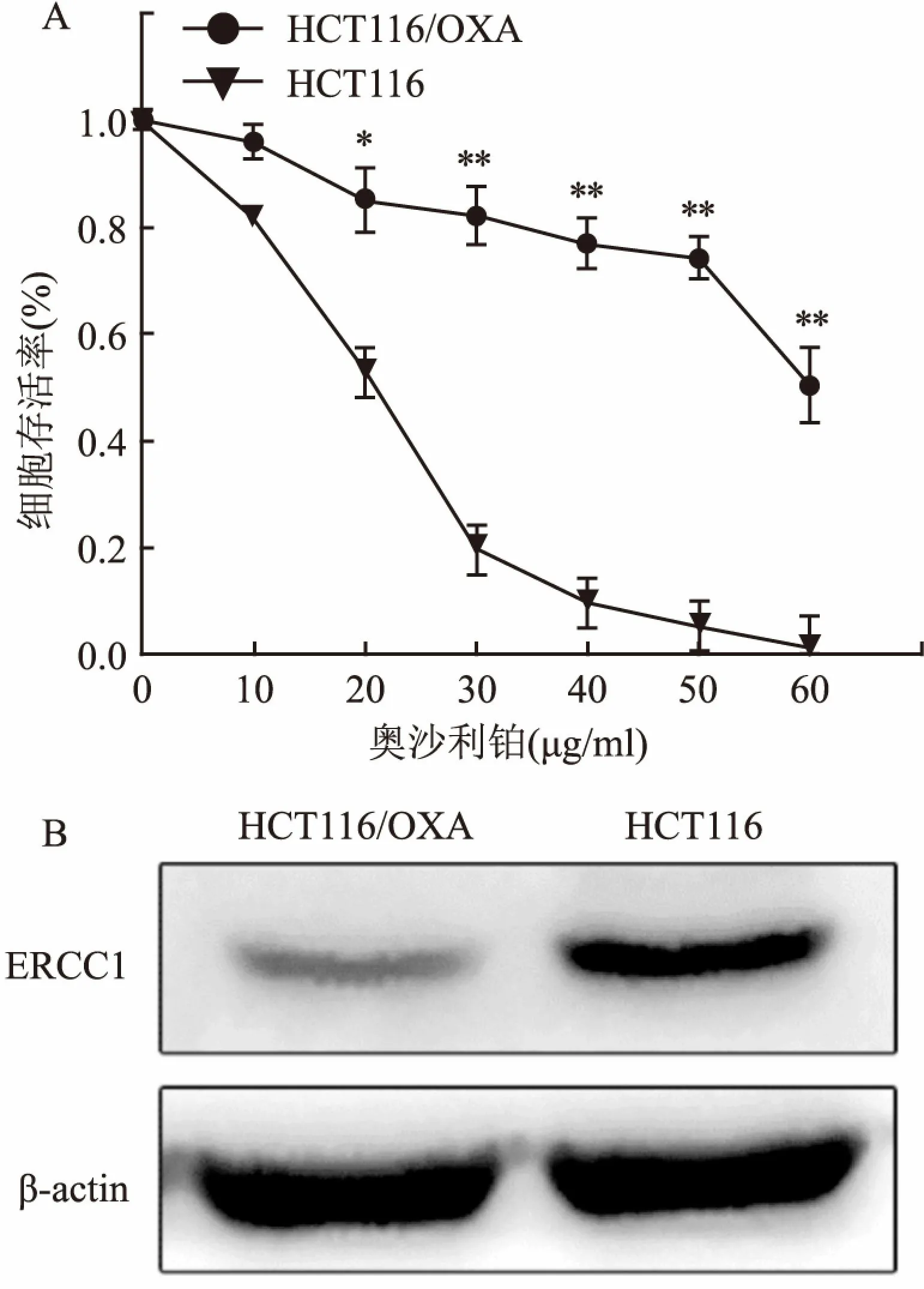
图1 HCT116/OXA耐药细胞模型验证
A:HCT116和HCT116/OXA对奥沙利铂敏感性;与HCT116比较:*P<0.05,**P<0.01;B:Western blot检测ERCC1在HCT116和HCT116/OXA中表达
2.2 蛋白质谱结果表明DHRS2在HCT116/OXA显著升高本实验共鉴定了5 345个蛋白质,其中4 599个蛋白质包含定量信息。本实验以变化阈值为1.5,P<0.05为标准对鉴定出的蛋白进行了筛选,其中有64种蛋白在HCT116/OXA细胞中上调,其中红色代表高表达,绿色代表低表达(图2)。实验结果表明DHRS2蛋白在耐药细胞株HCT116/OXA显著上升,提示其可能参与调节耐药细胞株HCT116/OXA对奥沙利铂的敏感性。
2.3 Western blot 验证DHRS2蛋白上调为进一步验证DHRS2蛋白在HCT116与HCT116/OXA细胞表达情况,实验采用Western blot方法,结果表明DHRS2蛋白在HCT116/OXA细胞较HCT116细胞显著升高(t=30.48,P<0.001),见图3。
2.4 干扰DHRS2表达后HCT116/OXA细胞对奥沙利铂耐药性下降为了进一步证明DHRS2的表达与结直肠癌奥沙利铂耐药之间的相互关系,本实验在耐药细胞HCT116/OXA转染特异性siRNA,并检测其对奥沙利铂耐药性变化。2条siRNA转染HCT116/OXA后,使DHRS2表达水平分别下调至NC组(0.35±0.05)和(0.32±0.08),差异有统计学意义(F=149.3,P<0.05),见图4A。同时,CCK-8结果表明,HCT116/OXA在干扰DHRS2表达后可显著提高细胞对奥沙利铂的敏感性,差异有统计学意见(P<0.01),见图4B。
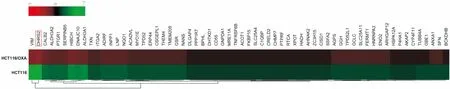
图2 HCT116/OXA细胞上调差异表达蛋白的热图
图3 Western blot 验证DHRS2在HCT116/OXA细胞表达上调A:HCT116;B:HCT116/OXA;与HCT116比较:***P<0.001
2.5 沉默DHRS2增加HCT116/OXA奥沙利铂治疗敏感性的机制Western blot结果表明,在HCT116/OXA细胞中干扰DHRS2后,P53和ERCC1表达下调(图5A)。进一步研究显示,在HCT116/OXA细胞中干扰P53后,ERCC1表达显著下调(图5B)。综上,实验结果表明了沉默DHRS2可通过P53依赖的方式下调ERCC1表达,从而增加HCT116/OXA细胞对奥沙利铂的敏感性。
3 讨论
结直肠癌发病率高,因早期诊断率低,患者在就诊时大都处于中晚期,从而导致结直肠癌患者5年生存率仅有10%左右[1]。化疗药物耐药的出现是结直肠癌高死亡率的一个重要原因,了解导致个体化疗药物耐药的机制有助于确定新的药物靶点和药物研发,从而改善癌症治疗。奥沙利铂作为第三代铂类化疗药,主要是通过形成铂-DNA复合物,破坏DNA正常结构从而抑制DNA复制和转录诱导肿瘤细胞凋亡[3]。研究认为DNA损伤主要是通过核苷酸切除修复途径(nucleotide excision repair,NER)修复,ERCC1作为核苷酸切除修复途径中的关键基因,在奥沙利铂耐药过程中起到了非常重要的作用[4]。

图4 干扰DHRS2对耐药株细胞HCT116/OXA化疗敏感性的影响
A:DHRS2- siRNA转染HCT116/OXA后DHRS2的表达;1:si-NC;2:si-DHRS2-1;3:si-DHRS2-2;B:干扰DHRS2的表达可提高耐药细胞HCT116/OXA对奥沙利铂的敏感性;与si-NC比较:*P<0.05,**P<0.01
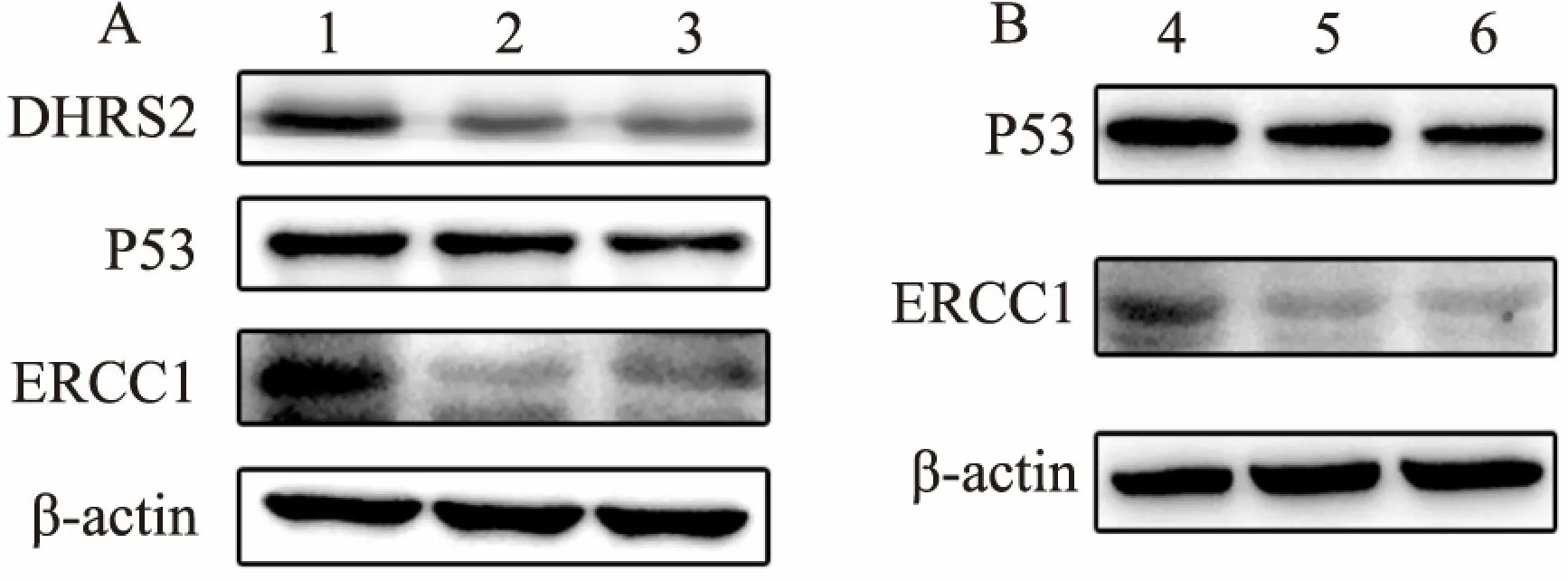
图5 沉默DHRS2通过P53依赖方式抑制ERCC1表达
A:Western blot检测干扰DHRS2后P53、ERCC1表达变化;B:Western blot检测干扰P53后,ERCC1表达情况;1:si-NC; 2:si-DHRS2-1; 3:si-DHRS2-2;4:si-NC;5:si-p53-1;6:si-p53-2
DHRS2蛋白属于短链脱氢还原酶超家族(superfamily of short-chain dehydrogenases/reductases,SDR),其基因位于人类染色体 14q11 上,编码一种NAD/NADP依赖的氧化还原酶[5]。最近多项研究表明DHRS2参与多种肿瘤进程。例如,DHRS2在食管鳞癌中高表达,沉默DHRS2后促进食管鳞癌细胞凋亡以及抑制其迁移侵袭能力[6]。此外,在急性髓细胞白血病和胃癌中DHRS2的表达与耐药相关[7-8]。然而,DHRS2蛋白是否参与结直肠癌细胞耐药尚未见文献报道。该研究利用TMT定量蛋白组学技术筛选结直肠癌耐药细胞株HCT116/OXA与其亲本HCT116蛋白表达差异,结果显示DHRS2在耐药株HCT116/OXA显著上调,提示DHRS2可能参与HCT116/OXA对奥沙利铂的耐药。CCK-8结果表明,沉默DHRS2可增加耐药株HCT116/OXA细胞对奥沙利铂敏感性。
DHRS2通过和MDM2结合降低了MDM2介导的P53降解,从而稳定并活化P53[9]。P53作为一个转录因子,在被激活后可影响下游一系列基因表达变化。研究[10]显示, 细胞在暴露于DNA损伤的药物后,p53会表达上调, 表明它可能参与促进DNA修复。并有文献[11]报道P53可通过与ERCC1启动子结合,增强其表达从而抑制顺铂引起的DNA损伤。因此,本课题组推测沉默DHRS2是否是通过下调HCT116/OXA细胞内P53表达进而影响ERCC1的表达,从而提高耐药株HCT116/OXA对奥沙利铂的敏感性。为此,该实验检测了在HCT116/OXA细胞内干扰DHRS2后P53和ERCC1的表达。结果显示,干扰DHRS2后,HCT116/OXA细胞内P53和ERCC1内蛋白表达水平明显下调。且干扰P53后,ERCC1蛋白水平下调。上述结果表明,沉默DHRS2可通过P53下调ERCC1表达,从而增强耐药株HCT116/OXA对奥沙利铂化疗敏感性。
综上,该实验表明DHRS2在结直肠癌耐药细胞株HCT116/OXA上调,同时沉默DHRS2可促进奥沙利铂的化疗敏感性。初步探索其中的机制,有可能是DHRS2通过抑制P53表达从而下调ERCC1表达实现的。研究结果可为探究DHRS2影响结直肠癌恶性生物学行为提供一个新的理论依据, 为逆转结直肠癌奥沙利铂耐药提供新的靶点研究策略。

