半乳糖凝集素-1对LTA诱导巨噬细胞NLRP3炎症小体的抑制及机制探讨
陈方方,王木子,吕允相,刘荣玉
炎症小体是细胞在感染或应激情况参与机体先天免疫防御的一种分子平台,在协助机体抵御病原体感染和组织损伤中发挥重要作用[1]。目前已发现的炎性小体主要有4种,即NLRP1、NLRP3、IPAF和AIM2。研究[1]认为NLRP3炎症小体是目前最具有特征的炎症小体,是由NLRP3、ASC(PYCARD)和Caspase-1组成。NLRP3炎性小体通过识别病原相关分子模式(pathogen-associated molecular patterns,PAMP)或者宿主来源的危险信号分子模式(damage associated molecular patterns,DAMP)招募和激活促炎症蛋白酶Caspase-1;活化的Caspase-1切割IL-1β和IL-18的前体,产生相应的成熟细胞因子IL-1β和IL-18,诱导炎症发生。因此,基于 NLRP3 炎症小体的抗炎药物开发及作用机制的研究对于炎症相关疾病的防治具有重要意义。
半乳糖凝集素-1(galectin-1,Gal-1)是动物半乳糖凝集素家族中的一员,可通过识别β-半乳糖来发挥广泛的抗炎及免疫调节作用[2],近年来研究[3]发现,在先天性免疫反应中,Gal-1通过抑制促炎症细胞因子的合成,抑制中性粒细胞运输,靶向抑制嗜酸性粒细胞迁移并促进其凋亡,抑制肥大细胞脱颗粒,并且可以通过控制L-精氨酸的代谢及减少NO的产生诱导骨髓巨噬细胞向M2型分化,从而发挥抗炎作用。Gal-1在巨噬细胞炎症中具有广泛的抗炎作用,但具体的分子机制仍不明了。因此,该研究拟通过探讨重组鼠源性半乳糖凝集素-1(recomblant mouse galectin-1,rmGal-1)干预对金黄色葡萄球菌脂磷壁酸(lipoteichoic acid,LTA)刺激Raw264.7 巨噬细胞炎症反应模型的影响,研究外源性Gal-1对NLRP3 炎症小体活化的调节和相关机制,为进一步了解其药理学机制提供实验依据。
1 材料与方法
1.1 材料
1.1.1细胞系 小鼠单核巨噬细胞系Raw264.7购于上海细胞库。
1.1.2主要试剂及仪器 DMEM培养基、胎牛血清、小牛血清购于美国Invitrogen公司;LTA购于美国Sigma公司;rmGal-1试剂购于北京sino biological公司;P-p65、p65和NLRP3 单克隆抗体购于美国Cell Signaling 公司;ASC、Galectin-1、Caspase-1单克隆抗体购于美国Santa Cruz Biotechnology 公司;JSH-23(NF-κB)购于美国MedChemExpress公司;辣根过氧化物酶(HRP) 标记的 GAPDH一抗购于四川康城公司;HRP标记的羊抗兔和兔抗鼠二抗购于美国Santa Cruz Biotechnology公司;细胞培养箱购于美国Thermo公司;细胞培养板购于美国Corning公司;LSM510激光共聚焦显微镜购于德国ZEISS公司;蛋白电泳转移系统购于美国Bio-Rad公司。
1.2 方法
1.2.1细胞培养Raw264.7 细胞用含5% 胎牛血清、5%小牛血清、100 U/L青霉素和100 μg/ml链霉素的DMEM培养于37 ℃、5%CO2培养箱内,观察细胞整体情况1~2 d,根据细胞数目、形态及培养基颜色进行细胞换液,当细胞汇合度达到90%时,用胰蛋白酶消化传代培养,取对数生长期细胞进行试验。
1.2.2四甲基偶氮唑盐微量酶反应比色[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]法检测rmGal-1作用下Raw 264.7细胞活力 取对数生长期Raw264.7细胞,调节细胞悬液的浓度为5×104个/ml,接种于96孔板内(100 μl/孔),恒温培养箱中孵育24 h后,待细胞完全贴壁,分别加入0、0.04、0.4、4 μg/ml的rmGal-1(100 μl/孔)处理72 h,每个浓度设5个复孔,在终止前4 h,每孔加10 μl MTT,MTT干预结束后去上清液,再加100 μl 二甲基亚砜(Dimethyl sulfoxide,DMSO),震荡混匀10 min,用酶标仪在490 nm处测定吸光度(optical density,OD)值,计算细胞存活率=(OD实验组-OD实验对照组)/OD对照组×100%。
1.2.3建立LTA刺激巨噬细胞的炎症反应模型 将对数生长期的Raw264.7按1×106/ml 的密度分别接种12孔板,培养过夜至24 h。设置时间梯度0、1、3、6 h,每组设置3个复孔,用LTA(2.5 μg/ml)干预细胞3 h后提取细胞蛋白。
1.2.4rmGal-1干预LTA刺激下的巨噬细胞 同样将对数生长期的Raw264.7按1×106/ml的密度分别接种12孔板中。将实验分为四组;即空白对照组(Control组)、炎症模型组(LTA组)、药物对照组(rmGal-1组)、干预组(LTA+rmGal-1组)。预先用rmGal-1(0.4 μg/ml)预处理72 h,再加入LTA共孵育3 h后提取细胞蛋白。
1.2.5JSH-23干预LTA刺激下的巨噬细胞 将对数生长期的Raw264.7按1×106/ml的密度接种于12孔板,培养过夜至24 h。将实验分为四组:即空白对照组(Control组)、炎症模型组(LTA组)、药物对照组(JSH-23组)、干预组(LTA+JSH-23组),每组设置3个复孔。加入30 μmol/mL JSH-23预处理1 h后加入LTA共孵育3 h后提取细胞蛋白。
1.2.6激光共聚焦观察P-p65及NLRP3炎症小体的表达水平 用洗洁精处理过的玻片放入超声仪内超声,再用超纯水冲洗,放在75%酒精里浸泡,使用时拿出酒精内的玻片过火灼烧,放入板内,多聚赖氨酸包被过夜,再用PBS洗3次,放入温箱3~4 h,玻片烘干。将对数生长期的Raw264.7按1×106/ml的密度接种于12孔板,培养过夜至24 h,分别加入rmGal-1(0.4 μg/ml)预处理72 h或JSH-23预处理(30 μmol/ml)1 h,再加入LTA共处理3 h。4%多聚甲醛固定30 min后,羊血清封闭30 min,吸弃血清后一抗37 ℃室温孵育1 h后4 ℃过夜,加入荧光二抗室温孵育1 h后,4,6-联脒-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)染核15 min,甘油封片,透明指甲油固定封片的四角,4 ℃冰箱保存用于拍照。激光共聚焦显微镜下取6个视野拍照,观察细胞形态及胞内荧光强度。
1.2.7蛋白提取和Western blot法检测相关蛋白表达 收获细胞,提取蛋白后电泳、转膜,5%脱脂牛奶室温封闭,相应的一抗4 ℃孵育过夜(稀释比例为P-p65:1 ∶1 000;p65:1 ∶1 000;NLRP3:1 ∶2 000;ASC:1 ∶200;Caspase-1:1 ∶200;Gal-1:1 ∶100;Pro-Caspase-1:1 ∶500),洗涤后室温孵育HRP标记二抗1 h,最后ECL试剂盒中A液和B液等体积混匀后均匀加至膜上,化学发光成像 ChemiScope显影,Image J软件分析条带灰度值。
2 结果
2.1 rmGal-1对Raw264.7 细胞活力的影响0、0.04、0.4、4 μg/ml终浓度的rmGal-1与Raw264.7细胞共孵育72 h,MTT法测得各组细胞活力相对百分比,结果均用(%)表示。在0 μg/ml时,细胞活力是(97.23±3.07);浓度为0.04 μg/ml时,检测细胞活力结果是(81.76±9.10);0.4 μg/ml浓度梯度时,细胞活力是(80.89±7.63);浓度为4 μg/ml时细胞活力下降到(20.06±5.26);与对照组(0 μg/ml)相比,rmGal-1浓度在0.04 μg/ml及0.4 μg/ml对细胞活力无明显影响,差异无统计学意义(P>0.05),而在4 μg/ml时显著影响细胞活力(F=112.78,P<0.01)。rmGal-1是一种重组鼠源性蛋白,在不明显影响Raw264.7 细胞活力的情况下,根据MTT法测得的实验结果,选择0.4 μg/ml为实验浓度。
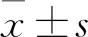
2.2 LTA诱导Raw246.7巨噬细胞中NF-κB-NLRP3通路活化并促进内源性Gal-1高表达LTA(2.5 μg/ml)刺激巨噬细胞1、3、6 h,Western blot法分析P-p65、NLRP3、Gal-1分子的蛋白表达水平。结果显示,LTA刺激Raw246.7巨噬细胞活化NF-κB-NLRP3通路呈时间依赖性。在LTA刺激下,随时间延长,内源性Gal-1的表达水平显著增高(F=3.56,P<0.05),且P-p65、NLRP3及Gal-1的表达水平在刺激3 h后达到高峰(图1)。因此,后续实验LTA刺激Raw264.7的最佳时间为3 h。
2.3 rmGal-1和JSH-23预处理后对Raw264.7 巨噬细胞中NF-κB及NLRP3炎症小体表达的影响免疫荧光结果显示,LTA刺激Raw264.7细胞3 h后,细胞质内绿色荧光NLRP3及P-p65表达水平较对照组明显增强(图2)。为了进一步验证该结果,该实验采用Western blot对细胞内NLRP3和P-p65蛋白表达水平进行了检测。结果表明:与对照组相比,LTA组细胞内NLRP3及P-p65表达水平显著升高,差异具有显著的统计学意义(P<0.01)(图3)。此外,用rmGal-1预处理72 h后,与LTA共孵育3 h,免疫荧光结果显示LTA和rmGal-1共孵育组绿色荧光NLRP3及P-p65的表达明显低于LTA组(图2)。这表明rmGal-1抑制了NLRP3及P-p65在细胞
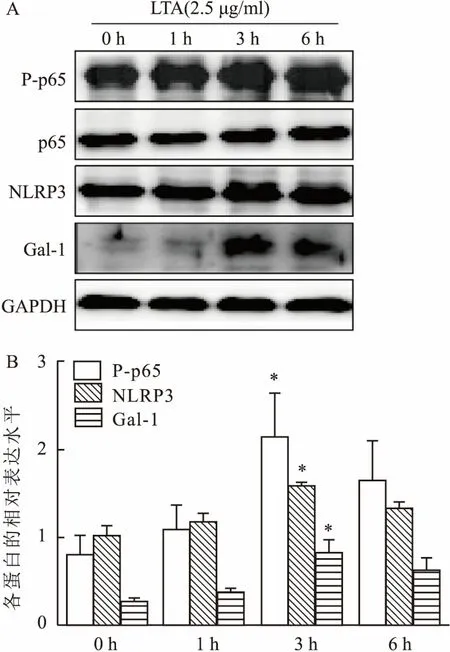
图1 LTA刺激Raw264.7巨噬细胞后细胞内P-p65、 NLRP3和Gal-1的蛋白表达及蛋白水平的半定量分析
A:各蛋白的蛋白表达;B:各蛋白的蛋白半定量分析;与空白对照组比较:*P<0.05,**P<0.01
内的表达。Western blot检测结果显示,与LTA组相比,LTA+rmGal-1组细胞内NLRP3及P-p65的表达水平显著降低。差异具有统计学意义(F=8.37,P<0.05或F=4.77,P<0.01)(图3)。这进一步证明了rmGal-1可以抑制NLRP3及P-p65在细胞内的表达。与此同时,该实验用NF-κB抑制剂(JSH-23)预处理1 h后,与LTA共孵育3 h作为阳性对照,免疫荧光和Western blot结果一致,显示与LTA组相比,JSH-23+LTA组细胞内NLRP3及P-p65的表达水平显著降低,差异具有统计学意义(F=8.15,P<0.01;F=5.69,P<0.01)(图2、3)。NF-κB抑制剂阳性对照处理结果同rmGal-1处理后一致。
3 讨论
该实验把小鼠巨噬细胞系Raw264.7作为研究对象,分别用rmGal-1和NF-κB抑制剂JSH-23干预金黄色葡萄球菌LTA刺激Raw264.7细胞的炎症模型。研究结果显示,在LTA刺激Raw264.7细胞3 h后,内源性Gal-1及NLRP3炎症小体表达显著上调;rmGal-1预处理后显著抑制P-p65、NLRP3、ASC及Caspase-1表达。同样地,JSH-23预处理后,P-p65、NLRP3、ASC及Caspase-1的表达水平显著下调。
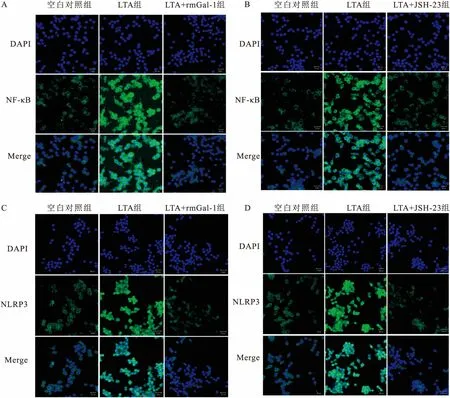
图2 免疫荧光法测rmGal-1和JSH-23处理后各组Raw264.7细胞中P-p65及NLRP3炎症小体的表达 ×200
A:加rmGla-1处理后各组P-p65表达;B:加抑制剂(JSH-23)处理后各组P-p65表达;C:加药(rmGla-1)处理后各组NLRP3表达;D:加抑制剂(JSH-23)处理后NLRP3表达;DAPI所染的细胞核呈蓝色,绿色荧光为P-p65和NLRP3在细胞内的表达
巨噬细胞作为主要的固有免疫细胞,具有抗原提呈,清除病原体和促进细胞凋亡的功能[4]。研究[4-5]表明,轻度哮喘患者肺泡巨噬细胞数量明显增多,吞噬功能增强,提示肺泡巨噬细胞可能参与哮喘的发病。金黄色葡萄球菌作为常见的人类定植细菌,与哮喘等过敏性疾病的发病有关[6];LTA作为金黄色葡萄球菌的主要成份,可以被巨噬细胞表面Toll样受体2(Toll like receptor-1, TLR2)识别诱导炎症发生[7]。研究[8]表明在大肠杆菌感染的小鼠脓毒血症的动物模型中NLRP3炎症小体表达上调,此外还有研究[9]显示LTA可激活牛乳腺泡细胞TLR2/NF-κB/NLRP3信号通路诱发乳腺炎。粪肠球菌LTA刺激巨噬细胞系Raw264.7建立的牙周炎的模型里显示[10],LTA可诱导Raw264.7细胞内NLRP3炎症小体的活化,而且该作用可能与ROS和NF-κB信号通路激活有关。与之前的研究结果相一致,该研究表明金黄色葡萄球菌LTA刺激Raw264.7细胞后,细胞内NLRP3、ASC及Caspase-1的表达水平显著升高。这表明LTA激活了Raw264.7细胞内NLRP3炎症小体的表达和组装。该研究也证明,LTA刺激Raw264.7细胞后,细胞内P-p65表达水平也显著升高,这表明LTA同时激活了NF-κB信号通路。这进一步证实了LTA可能通过激活NF-κB来上调NLRP3的表达[9-10]。
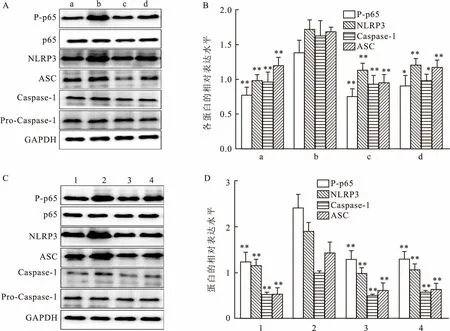
图3 rmGal-1和JSH-23处理后对NF-κB/NLRP3炎症小体通路蛋白表达的影响及蛋白水平半定量分析
A:加rmGal-1后各蛋白的表达;B:各蛋白的蛋白半定量分析;C:加抑制剂(JSH-23)后各蛋白的表达;D:各蛋白的蛋白半定量分析;a:空白对照组;b:LTA组;c:rmGal-1组;d:LTA+rmGal-1组;1:空白对照组;2:LTA组;3:JSH-23组;4:LTA+JSH-23组;与LTA组比较:*P<0.05,**P<0.01
Gal-1是一种碳水化合物结合蛋白,在细胞外,Gal-1能够与各种免疫细胞表面的二价或多价聚糖相互识别而发挥免疫调节作用;在细胞内,Gal-1可参与细胞信号转导,并调节一系列病理生理反应[11]。有研究[12]表明,克氏锥形虫感染巨噬细胞后,内源性Gal-1表达升高,外源性加入Gal-1可以显著抑制克氏锥形虫刺激巨噬细胞后炎症因子的产生,明确了外源性Gal-1的体外抗炎作用[13],这些研究与该实验研究结果一致。该研究采用LTA刺激巨噬细胞Raw264.7后,内源性Gal-1表达水平明显升高。同时,该实验用外源性rmGal-1作用于Raw264.7细胞后表明,LTA诱导的巨噬细胞NLRP3炎症小体表达水平显著下降。这进一步证实了外源性Gal-1在体外的抗炎作用。有研究[14]显示内源性Gal-1可以通过与NF-κB相互作用而调节细胞炎症反应。该研究显示,LTA刺激Raw264.7细胞后,细胞内P-p65、Caspase-1、ASC和NLRP3表达水平显著升高,这表明LTA刺激巨噬细胞激活了NK-κB-NLRP3信号通路,给予外源性Gal-1后,显著抑制了巨噬细胞内P-p65、Caspase-1、ASC和NLRP3表达水平。这表明,rmGal-1可能通过抑制NK-κB-NLRP3信号通路来调节巨噬细胞炎症反应。为了进一步证实以上推论,该实验给予NF-κB抑制剂预处理Raw264.7细胞作为阳性对照,在LTA刺激巨噬细胞后显示,细胞内P-p65、Caspase-1、ASC和NLRP3表达水平显著下调。这一作用与rmGal-1作用效果相一致。
综上,该研究证实了金黄色葡萄球菌 LTA刺激Raw264.7 巨噬细胞可活化NLRP3炎症小体,诱导内源性Gal-1的表达升高,rmGal-1干预可显著抑制LTA刺激巨噬细胞炎症反应,可能与rmGal-1抑制NF-κB/NLRP3信号通路有关,这为哮喘等炎症相关疾病的治疗提供了新的依据。但rmGal-1对NLRP3炎症小体调控作用除通过NF-κB通路外,还可能与其影响其他调控炎症因子表达的途径有关,这些炎症通路间是否有一定的交互调控,仍需进一步的探究。

