厚朴叶不同极性溶剂萃取物总酚含量及体外抗氧化活性研究
康兆勇,李玉霜,吴过,黄杰林,陈钰,赵泽洋,马林,2,*
(1.西南科技大学生命科学与工程学院,四川绵阳621010;2.四川省生物质资源利用与改性工程技术研究中心,四川绵阳621010)
厚朴(Magnolia officinalis)是我国临床治疗中常用的一味中药[1],主要以皮入药,是著名的“三木药材”之一。在历代本草所载正品的药用部位均为树皮,未见有叶入药的记载。厚朴叶资源十分丰富,每年可以再生,已有研究表明,厚朴叶主要含有厚朴酚、和厚朴酚、挥发油等化学成分[2],具有抑菌[3]、抗癌[4]、抗腹泻[5]、血管调节[6]、增强免疫应答[7]等药理活性。同时,厚朴叶中含有的挥发油、生物碱、黄酮和多糖等活性物质,具有良好的抗氧化性[8-10]。此外,不同月份厚朴叶的营养成分有显著差异,其中9 月份的厚朴叶营养成分指标最好[11]。这些研究表明,厚朴叶资源具有潜在的开发利用价值。薄层色谱-生物自显影法将薄层色谱分离技术与生物鉴定技术相结合,是一种有效的快速活性筛选方法,目前主要用于抗氧化、抗菌及抑制胆碱酯酶等生物活性的筛选与测定[12]。该技术利用具有清除DPPH自由基能力的物质能将其还原成DPPH-H 而呈现黄色的原理[13],反映出样品间的化学成分的差异和薄层色谱上获得分离的成分间活性的强弱,且该方法操作较为简单、耗费低、灵敏度和专属性都较高,便于普及[14]。前期研究发现,乙醇可以作为厚朴叶抗氧化活性物质提取的优选溶剂,且90%乙醇提取物的抗氧化活性最高[15]。本研究应用薄层色谱-生物自显影技术快速跟踪厚朴叶乙醇提取物和不同极性部位中具有抗氧化活性的部位,并综合分析其抗氧化活性,为进一步分离抗氧化活性物质和综合开发厚朴树叶资源提供理论依据。
1 材料与方法
1.1 材料与试剂
厚朴(Magnolia offcinalis)叶2015 年9 月采自四川省绵阳市平武县,风干粉碎后过20 目筛,室温(25 ℃)下保存备用。
1,1 -二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):梯希爱(上海)化成工业公司;2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐[2,2-azino-bis(3-ethylbenzthiazoline-6-sulonic acid),ABTS]、福林酚(Folin-Ciocalteu):上海蓝季生物公司;抗坏血酸(VC):天津福晨化工试剂公司;2,6-二叔丁基-4-甲基苯酚(2,6-di-tert-butyl-4-methylphenol,BHT):阿拉丁试剂(上海)有限公司;以上试剂均为分析纯。
1.2 仪器与设备
旋转蒸发器(RE-52AA):上海亚荣生化仪器厂;低速离心机(SL02):上海知信实验仪器技术公司;调温电热套(ZDHW):河北省黄骅市中兴仪器公司;流水式高速中药粉碎机(FL-30):瑞安市富力中药机械厂;紫外可见分光光度计(752):上海佑科仪器仪表公司。
1.3 方法
1.3.1 厚朴叶不同极性萃取物的制备
取400 g 厚朴叶粉末,按料液比1 ∶8(g/mL),加入90 %乙醇,加热回流3 h,趁热抽滤,滤渣重复提取2次,抽滤后合并3 次滤液,于50 ℃下减压浓缩回收溶剂,得到乙醇提取物100.72 g。
将厚朴叶提取物加入200 mL 蒸馏水分散,混匀,得到浑浊水悬液,依次用石油醚、正丁醇、乙酸乙酯、甲醇分别萃取3 次,每次100 mL,收集石油醚、正丁醇、乙酸乙酯、甲醇不同极性溶剂萃取液,50 ℃减压浓缩,得到石油醚萃取物、正丁醇萃取物、乙酸乙酯萃取物、甲醇萃取物,萃取后剩余部分减压浓缩得到萃余相浓缩物。
1.3.2 薄层色谱-生物自显影法定性检测
分别取90%乙醇提取物、4 种溶剂萃取物(石油醚、正丁醇、乙酸乙酯、甲醇)和萃余相浓缩物各0.05 g,用无水乙醇溶解,配成1 mg/mL 的供试品溶液。吸取样品溶液分别点于同一硅胶薄层板上,依次点1、2、3、4、5、6 次,每个样品3 个平行,点样后的薄层板,喷以0.04%DPPH 乙醇溶液,于40 ℃下加热30 min 后,在可见光下检视[16]。
1.3.3 总酚含量测定
参考周云凯等[17]的方法测定总酚含量。分别取没食子酸对照品溶液0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mL 于10 mL 具塞试管中,加入1 mL 福利酚(Folin-Ciocalteu)试剂,混匀,黑暗条件下放置10 min,然后加入1 mol/L 的Na2CO3溶液2 mL,加蒸馏水至5 mL,50 ℃水浴反应10 min,在770 nm 处测定吸光度。以没食子酸的量为横坐标,吸光度值为纵坐标,绘制标准曲线。将厚朴叶乙醇提取物和不同极性部位配制成1.0 mg/mL 的样液,分别取0.1 mL 各样品溶液于具塞试管中,按测标准品的方法进行显色测定。其总酚含量以每克厚朴叶乙醇提取物和不同极性部位中的没食子酸含量表示[18]。
1.3.4 DPPH 自由基清除能力的测定
参考TANAKA 等[19]的方法。取2 mL 厚朴叶乙醇提取物及各极性部位样液加入1 mL 500 μmol/L DPPH乙醇溶液,振摇混合均匀,在室温(25 ℃)下避光放置反应20 min,于517 nm 波长处测其吸光度,将1 mL 500 μmol/L DPPH 乙醇溶液与2 mL 无水乙醇混合作为空白。空白与样品均测定3 次,以BHT 和VC作为阳性对照,吸光度调零为无水乙醇。DPPH 自由基清除率按式(1)计算。
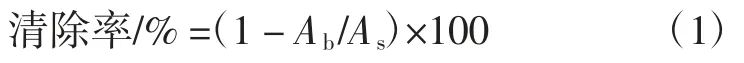
式中:Ab为以乙醇作为空白的吸光度;As为样品溶液吸光度。
1.3.5 ABTS+自由基清除能力的测定
参考曹清明等[20]的方法略作修改:取7 mmol/L 的ABTS 溶液50 mL 与2.45 mmol/L 的过硫酸钾溶液50 mL 混合均匀后,将混合液置于室温(25 ℃)避光条件下反应12 h~16 h,形成ABTS+自由基储备液。使用前将储备液用磷酸缓冲溶液(phosphate buffer solution,PBS)按1 ∶30(体积比)进行稀释,使用PBS 调节734 nm处吸光度为0.700±0.002(PBS 作为对照),作为工作液,于30 ℃预热备用。取0.2 mL 样液与4 mL ABTS+自由基工作液混匀,室温(25 ℃)下避光反应10 min 后。测其吸光度,平行测定3 次。ABTS+自由基清除率按式(2)计算。

式中:Ao为4 mL ABTS 溶液与0.2 mL 无水乙醇(样品溶剂)吸光度;Ai为4 mL ABTS 溶液与0.2 mL 样品溶液吸光度;Aj为4 mL PBS 与0.2 mL 样品溶液吸光度。
1.3.6 总还原力测定
参考高义霞等[21]的方法测定总还原力。将厚朴叶乙醇提取物和不同极性部位配置成0.05、0.1、0.2、0.4、0.6 mg/mL 的质量浓度,BHT 作为阳性对照,测定在波长为700 nm 的吸光度,吸光度越高,总还原能力越强[22]。
1.4 数据处理与统计分析
根据不同浓度样品的清除率作线性拟合,以待测样品浓度为横坐标(X),清除率为纵坐标(Y)得待测样品清除DPPH 自由基、ABTS+自由基能力的关系曲线。计算当清除率为50%时所需样品的浓度作为半清除率(EC50)。所需样品质量浓度越低,表明其半清除率越高,清除效果越好[23]。总还原力以700 nm 波长处的吸光度为0.5 时(OD700nm=0.5)的样品浓度计算,所需样品浓度越低,表明总还原能力越高。
所有试验数据均为3 次重复试验结果的平均值。采用SPSS22.0 统计软件进行数据分析,Origin9.2 进行作图,显著检验(p<0.05)采用Duncan 极差法,数据以±SD 表示。
2 结果与分析
2.1 抗氧化活性成分的薄层定性鉴定结果
厚朴叶乙醇提取物及不同极性部位薄层色谱-生物自显影定性鉴定结果见图1。
从图1 黄色斑点的深浅可知,厚朴叶各物质均具有一定抗氧化活性,其中正丁醇萃取物、乙酸乙酯萃取物黄色斑点最深,说明其抗氧化活性最高,90%乙醇提取物次之,石油醚萃取物、甲醇萃取物、萃余相浓缩物有较低的抗氧化活性;此外,点样4 次及以上时颜色区分开始明显,对厚朴叶抗氧化活性的定性判定具有指导作用。
2.2 厚朴叶乙醇提物及不同极性部位的总酚含量
测定没食子酸标准曲线方程为Y=0.033X+0.067 1(R2=0.997 6),发现没食子酸在5 μg~25 μg 范围内线性关系良好,根据标准曲线方程计算出厚朴叶乙醇提取物及不同极性部位的总酚含量见表1。

图1 厚朴叶乙醇提取物及不同极性部位薄层色谱-生物自显影定性鉴定结果Fig.1 Results of thin layer chromatography-bioautography spot plate for ethanol extract and different polar fractions from Magnolia officinalis leaves
由表1 可知,厚朴叶乙醇提取物及不同极性部位的总酚含量随萃取溶剂的不同而有所变化。石油醚萃取物的总酚含量最低,为(42.39±0.40)mgGAE/g,萃余相与石油醚萃取物的总酚含量相近(p<0.05),为(50.31±2.18)mgGAE/g,说明石油醚不能富集酚类成分。乙酸乙酯萃取物的总酚含量最高,为(178.56±11.32)mgGAE/g,其次是正丁醇萃取物,其总酚含量为(144.72±2.62)mgGAE/g,两者差异不显著(p>0.05),但都较高,乙酸乙酯和正丁醇的极性属于中等到强极性,而强极性的甲醇萃取得到的萃取物总酚含量反而不高,为(76.16±14.58)mgGAE/g,由此反映出,厚朴叶中大部分酚类物质属于中等到强极性,能被中等到强极性溶剂提取(乙醇、水)和富集(乙酸乙酯、正丁醇)。由表1 可知,各物质的总酚含量为:乙酸乙酯萃取物>正丁醇萃取物>90%乙醇提取物>甲醇萃取物>萃余相浓缩物>石油醚萃取物。

表1 厚朴叶乙醇提取物及不同极性部位总酚含量和清除自由基EC50 及Fe3+还原力Table 1 Total polyphenol content of ethanol extract and different polar fractions of Magnolia officinalis leaves and scavenging free radicals EC50 and Fe3+reducing power
2.3 厚朴叶乙醇提物及不同极性部位对DPPH 自由基的清除能力
厚朴叶乙醇提取物及不同极性部位对DPPH 自由基的清除作用测定结果见图2。

图2 厚朴叶乙醇提取物及不同极性部位对DPPH 自由基的清除作用Fig.2 DPPH radical scavenging activity of ethanol extract and different polar fractions from Magnolia officinalis leaves
由图2 可知,厚朴叶乙醇提取物和不同极性部位对DPPH 自由基均有一定的清除能力,且其清除率在一定浓度范围内(0.05 mg/mL~0.4 mg/mL)呈良好的量效关系,当质量浓度为0.4 mg/mL 时各物质对DPPH自由基清除率差异明显,乙酸乙酯萃取物与正丁醇萃取物清除率分别为92.49%和91.40%,与VC清除率(96.70%)接近,显著高于BHT(77.24%)。乙醇提取物的清除率为87.21%,高于BHT,说明厚朴叶乙醇提取物本身具有较高DPPH 自由基清除活性,与前期研究相匹配[15]。表1 结果显示,乙酸乙酯萃取物[EC50(86.27±0.02)μg/mL]和正丁醇萃取物[EC50(129.36±0.05)μg/mL]的抗氧化能力显著高于BHT[EC50(199.85±0.01)μg/mL],但低于VC的抗氧化能力。石油醚萃取物[EC50(377.52±0.02)μg/mL]和萃余相浓缩物[EC50(382.69±0.02)μg/mL]抗氧化能力差异不显著(p>0.05),说明其清除DPPH自由基能力相当,与其他萃取物相比,其活性均较低。可能是由于石油醚萃取物和萃余相浓缩物中酚类化合物极性较低,和乙醇提取物和其余萃取物中酚类成分差异较大,导致活性较低。各物质清除DPPH 自由基能力为:VC>乙酸乙酯萃取物>90%乙醇提取物>正丁醇萃取物>BHT>甲醇萃取物>石油醚萃取物>萃余相浓缩物。
2.4 厚朴叶乙醇提物及不同极性部位对ABTS+自由基的清除能力
厚朴叶乙醇提取物及不同极性部位对ABTS+自由基的清除作用测定结果见图3。
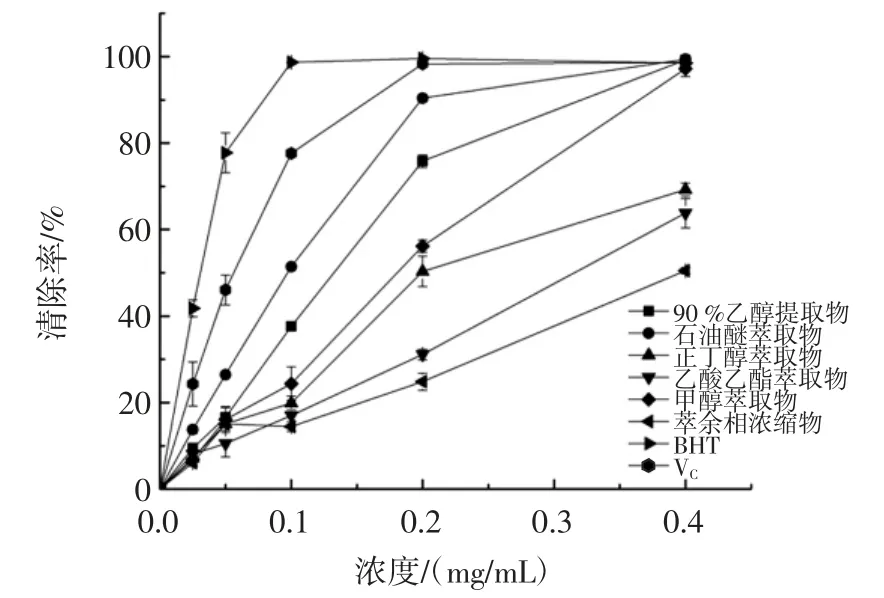
图3 厚朴叶乙醇提取物及不同极性部位对ABTS+自由基的清除作用Fig.3 ABTS radical scavenging activity of ethanol extract and different polar fractions from Magnolia officinalis leaves
由图3 可知,厚朴叶乙醇提取物和不同极性部位对ABTS+自由基均有一定的清除能力,且其清除率在一定浓度范围内(0.025 mg/mL~0.4 mg/mL)呈良好的量效关系。低浓度时(0.025 mg/mL~0.2 mg/mL),厚朴叶各物质对ABTS+自由基的清除能力均低于对照VC和BHT,当达到一定浓度(0.4 mg/mL)时,乙酸乙酯萃取物(99.40%)和正丁醇萃取物(99.33%)对ABTS+自由基的清除能力达到了VC(98.60%)和BHT(98.48%)的清除能力。质量浓度为0.4 mg/mL 时,乙醇提取物对ABTS+自由基的清除率与对照的清除率接近,为97.18%,显著高于其余萃取物和萃余相浓缩物。由表1 可知,各物质EC50值差异明显(p<0.05),表示各物质清除ABTS+自由基能力有显著差异,乙酸乙酯萃取物的抗氧化能力最高,EC50为(127.20±0.01)μg/mL,显著高于正丁醇萃取物[EC50(200.98±0.05)μg/mL],但低于VC[EC50(46.86±0.01)μg/mL]。各物质清除ABTS+自由基的能力为:VC>乙酸乙酯萃取物>正丁醇萃取物>90%乙醇提取物>甲醇萃取物>萃余相浓缩物>石油醚萃取物。
2.5 厚朴叶乙醇提物及不同极性部位的总还原能力
厚朴叶乙醇提取物及不同极性部位的总还原能力测定结果见图4。

图4 厚朴叶乙醇提取物及不同极性部位的总还原能力Fig.4 Total reduction ability of ethanol extract and different polar fractions of Magnolia officinalis leaves
图4 显示,厚朴叶乙醇提取物及不同极性部位对Fe3+均有一定的还原能力,且其还原能力在一定浓度范围内(0.05 mg/mL~0.6 mg/mL)呈良好的量效关系,但对Fe3+的还原力显著低于阳性对照BHT(p<0.05)。厚朴叶各物质中乙酸乙酯萃取物总还原能力最高,显著高于正丁醇萃取物和其余物质。石油醚萃取物的总还原力最低,萃余相浓缩物的总还原力与其接近,均低于乙醇提取物和其余萃取物。由表1 可知,各物质OD700nm=0.5 时的样品浓度差异显著(p<0.05),表示各物质对Fe3+的还原能力有显著差异。各物质的总还原能力为:BHT>乙酸乙酯萃取物>正丁醇萃取物>90%乙醇提取物>甲醇萃取物>萃余相浓缩物>石油醚萃取物。
2.6 相关性分析
2.6.1 总酚含量与抗氧化活性的相关性分析
用Pearson 系数对厚朴叶乙醇提取物和不同极性部位的抗氧化性与总酚含量测定结果进行相关性分析,结果见表2。

表2 总酚含量与DPPH 自由基、ABTS+自由基和总还原力测定结果之间的相关性分析Table 2 Correlation coefficients for relationships among total polyphenol contents and DPPH assay,ABTS+assay and total reducing force measurement results
由表2 可知,Folin-Ciocalteu 比色法测定厚朴叶乙醇提取物和不同极性部位总酚含量的结果与3 种抗氧化方法的相关因子大于0.797,表明厚朴叶乙醇提取物和不同极性部位中的酚类物质与其抗氧化能力密切相关。总酚含量与DPPH 自由基清除能力、ABTS+自由基清除能力以及总还原力的相关系数分别为0.797、0.866、0.875,有显著相关性(p<0.05)。这显示出厚朴叶中具有抗氧化活性成分的物质很有可能为酚类物质。
2.6.2 3 种抗氧化活性指标之间的相关性分析
比较测定抗氧化能力所用的3 种指标,进行相关性分析。由表2 结果可知,ABTS+自由基清除率和总还原力的相关因子为0.982,说明这两种指标之间具有极高的相关性(p<0.01)。DPPH 自由基清除率与ABTS+自由基清除率的相关因子为0.784,DPPH 自由基清除率与总还原力的相关因子为0.769,比ABTS+自由基清除率与总还原力的相关因子低2 个数量级,但也表现出较高的相关性。说明3 种抗氧化测定指标相关性较好,采用这3 种方法可综合评价厚朴叶乙醇提取物和不同极性部位的抗氧化活性。
3 结论与讨论
体外抗氧化活性的测定需采用多种方法进行综合评价[24]。本研究采用DPPH 自由基清除体系、ABTS+自由基清除体系和总还原力测定对厚朴叶乙醇提取物和不同极性部位的抗氧化能力进行综合评价。DPPH·是一种稳定的自由基,广泛应用于抗氧化物自由基清除能力的测定,可通过检测样品溶液对DPPH·的清除率,表示其抗氧化能力的强弱[25]。ABTS+·通常用于筛选复杂的活性混合物,如植物提取物、饮料和生物液体[26]。目前已被广泛地应用于亲水性和亲脂性物质总抗氧化能力的测定[27]。总还原能力是具有抗氧化性的化合物将Fe3+的形式还原为Fe2+形式,通过添加FeCl3形成普鲁士蓝色复合物亚铁(Fe2+)形式。因此,测量普鲁士蓝在700 nm 处的形成,可测定样品的还原能力,吸光度越高表示铁还原力越高[28]。研究表明,厚朴叶乙醇提取物和不同极性部位均具有抗氧化活性,其抗氧化活性大小与样品浓度存在良好的量效关系。在不同的抗氧化体系中,厚朴叶乙醇提取物和不同极性部位的抗氧化能力有一定差异,这可能与采用的抗氧化体系不同和各物质抗氧化成分的构成差异有关。3 种抗氧化评价体系得出,乙酸乙酯萃取物的抗氧化活性最高,抗氧化活性接近商业抗氧化剂BHT 和天然抗氧化剂VC,可能与其高的总酚含量有关。
酚类化合物是植物中分布较广、活性较高的一类化合物,是天然植物提取物或萃取物中具有抗氧化活性的主要物质基础[29]。本研究测定了厚朴叶乙醇提取物和不同极性部位的总酚含量,其中乙酸乙酯萃取物的总酚含量最高,为(178.56±11.32)mgGAE/g。前期研究表明,厚朴叶不同溶剂提取物抗氧化活性与其总酚含量成正相关[15]。已报道的天然产物中总酚含量与抗氧化呈显著相关性的文献很多,如:蓝莓叶[30]、红薯叶[31]、人参茎叶[32]、柳叶[33]、杜仲叶[34]等。厚朴叶乙醇提取物和不同极性部位的总酚含量与3 种抗氧化性的相关性有差异,这种差异是因为不同的自由基的清除机理不同,同时酚类物质和其他化学成分存在拮抗或协同反应[35]。所以通过一种方法来评价厚朴叶的抗氧化活性是片面的,需要从多角度测定综合评价厚朴叶的抗氧化活性。
通过薄层色谱-生物自显影法和3 种抗氧化评价体系定性及定量测定抗氧化活性,得出各物质的抗氧化活性表现出较为一致的顺序,说明薄层色谱-生物自显影法可用于抗氧化活性的快速定性分析。厚朴叶乙醇提取物和不同极性部位中,乙酸乙酯萃取物的抗氧化活性和总酚含量均最高,说明乙酸乙酯可以富集其中的抗氧化活性物质,可以利用乙酸乙酯萃取物进一步分离其抗氧化活性物质。张晓琦等[36]对厚朴树叶中的酚酸类物质进行分离,从厚朴叶挥发油中鉴定出41 种化合物,含量较高的组分为β-氧化石竹烯,4-丙烯基苯酚,喇叭醇,龙脑香等。分离得到了较纯的起药用作用的厚朴酚及和厚朴酚,进一步分离得到的抗氧化物质可能与这些物质相关。该研究为进一步开发利用厚朴叶资源提供了理论依据。

