HPLC-MS/MS 法同时测定人血浆中伏立康唑及其氮氧化代谢物浓度
李天萍,于 勇,应玉雯,杨雨晴,谢利军,陈 娟,张宏文,周 辰,孙鲁宁*,王永庆*
1 南京医科大学第一附属医院 临床药理研究室,南京 210029;2 湖南食品药品职业学院 药学院,长沙 410208
伏立康唑为新一代的三唑类抗真菌药物,其常用于预防和治疗一些与侵袭性真菌感染相关的疾病[1,2]。然而,由于存在个体差异和治疗窗较窄,伏立康唑可能导致一些不良反应,如视觉障碍、光敏性、神经毒性和肝功能障碍等[3]。伏立康唑及其代谢产物伏立康唑-N-氮氧化物血药浓度与患者的临床疗效及不良反应密切相关,监测两者血药浓度可提高抗真菌治疗的有效性和安全性[4]。伏立康唑-N-氮氧化物是伏立康唑通过细胞色素P450(CYP)酶代谢的主要产物,占其代谢物的70%以上。尽管伏立康唑-N-氮氧化物的药物活性低于伏立康唑,但可以抑制与伏立康唑代谢相关的CYP450 酶的代谢活性[5]。因此,建立同时测定伏立康唑和伏立康唑-N-氮氧化物浓度的方法具有重要意义;可用于血药浓度监测或药动学研究,以确定和调整给药方案。
已有文献报道,采用高效液相色谱法(HPLC)、液相色谱-质谱联用技术(LC-MS/MS)和免疫分析法测定生物样本中伏立康唑及其代谢物伏立康唑-N-氮氧化物的含量,但定量下限较高,最低仅为0.4 μg·mL-1,最高血药浓度为1.6μg·mL-1,根据《化学药物临床药代动力学研究技术指导原则》,定量下限大于最高血药浓度的1/20,不能满足药代动力学研究要求[6]。本研究旨在简化分析步骤,基于液相色谱-质谱联用技术,建立一种更灵敏、简便、可靠的人血浆中两者同时定量分析的方法,并将该方法应用于伏立康唑药物代谢动力学研究。
1 材 料
1.1 药品和试剂
伏立康唑对照品(批号100862-201402,纯度99.7%,由中国食品药品检定研究院提供);伏立康唑-N-氧化物对照品 (纯度99.9%,批号2352-043A11,由TLC Pharmaceutical Standards 提供);同位素内标(伏立康唑-D3、伏立康唑-N-氮氧化物-D3同位素纯度分别为98.8%、98.7%,由Toronto Research Chemicals 公司提供);甲醇、乙腈、甲酸为色谱纯;氨水为分析纯;试验用水为纯化水。
1.2 仪器与设备
安捷伦1290 Infinity 高效液相色谱仪(G1316C柱温箱,G4226A 多孔板自动进样器,G4220A 二元高压泵);API 4000(美国应用生物公司);Analyst®软件(1.6.3 版本);BP 211D 电子天平(Sartorius 公司)等。
2 方 法
2.1 检测条件
色谱条件:色谱柱:安捷伦ZORBAX SB-Aq(2.1 mm×50 mm,1.8 μm);柱温:38 ℃;流动相:含0.1%的甲酸(A)和甲醇(B)(梯度洗脱:0~3 min,45%B;3~3.1 min,45%~95%B;3.1~4.5 min,95%B,4.5~4.6 min,95%~45%B;4.6~6.0 min,45%B);流速:0.6 mL·min-1;自动进样器温度:8 ℃;进样量:1 μL。
质谱条件:多重反应监测(MRM),离子化方式:电喷雾离子化(ESI);离子极性:正离子;离子化电压:5500 V;离子源温度:500 ℃;雾化气压力:344.7 kPa;涡轮气压力:413.7 kPa;气帘气压力:275.8 kPa;碰撞气压力:41.4 kPa。待测物伏立康唑、伏立康唑-N-氮氧化物的二级质谱图见图1。伏立康唑、伏立康唑-N-氮氧化物及其内标的化合物参数见表1。
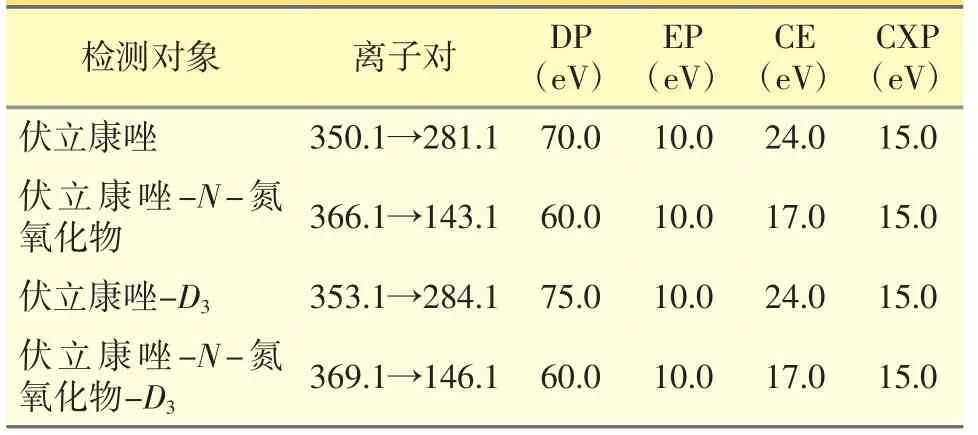
表1 伏立康唑、伏立康唑-N-氮氧化物及其内标的化合物参数
2.2 储备液与工作溶液的配制
分别精密称取伏立康唑对照品、伏立康唑-N-氮氧化物对照品适量,用乙腈溶解配制成浓度分别为1.00 mg·mL-1和400 μg·mL-1的储备液。
分别精密量取伏立康唑储备液和伏立康唑-N-氮氧化物储备液适量,置于同一量瓶中,用0.1%氨水乙腈稀释成浓度均为160 μg·mL-1的混合工作液。再用0.1%氨水乙腈逐级稀释配制系列浓度的标准曲线用和质控用混合工作液。
内标储备液及工作溶液:分别精密称取伏立康唑-D3对照品、伏立康唑-N-氮氧化物-D3对照品适量,用乙腈溶解,分别配制成浓度均为125 μg·mL-1的储备液。分别精密量取伏立康唑-D3储备液和伏立康唑-N-氮氧化物-D3储备液适量,置于同一量瓶中,用乙腈稀释成30 ng·mL-1的混合内标工作液。
2.3 标准曲线用与质控用样本的配制
取1.5 mL 塑料离心管数支,加入50 μL 空白血浆,再分别加入2.5 μL 相应浓度的标准曲线用或质控用混合工作液,涡旋10 s,混匀,配制成含伏立康唑和伏立康唑-N-氮氧化物浓度分别为10.0、20.0、50.0、200、500、2000、3600、4000、7000、8000 ng·mL-1的标准曲线用及浓度分别为10.0、25.0、400、3000、6000 ng·mL-1的质控用标准含药血浆样本。
2.4 血浆样品的预处理
取1.5 mL 塑料离心管数支,加入50 μL 血浆样本,涡旋10 s,混匀,再加入200 μL 内标工作溶液(30 ng·mL-1),涡旋1 min,用多管涡旋振荡器涡旋5 min,于4 ℃、16000 r·min-1离心10 min。取上清液40 μL 加120 μL 纯化水至自动进样器样品瓶中,涡旋混匀后,进行LC-MS/MS 分析。
3 方法学确证及结果
3.1 特异性考察
精密量取伏立康唑、伏立康唑-N-氮氧化物和内标储备液适量,用含0.1%氨水的乙腈溶液稀释数倍后进行测定,伏立康唑及其同位素内标保留时间为2.6 min,伏立康唑-N-氮氧化物及其同位素内标保留时间为1.0 min。取6 种不同来源的空白血浆,除不加内标外,按“2.4”项下处理,制备空白血浆样本并进行测定。本方法具有较高的选择性,内源性杂质不干扰测定。见图2。
3.2 标准曲线与定量下限
取1.5 mL 塑料离心管数支,按“2.3”项下方法操作,配制系列标准曲线用标准含药血浆样本,同时制备空白血浆样本,进行LC-MS/MS 分析,并记录色谱图。分别计算伏立康唑、伏立康唑-N-氮氧化物的峰面积As和内标峰面积Ai的比值f(f=As/Ai),以峰面积比值f 对血药浓度C 作权重回归计算,根据最小二乘法得出直线回归方程并制备标准曲线(f=a×C+b),权重系数为1/C2,计算各样本实测浓度及准确度。伏立康唑、伏立康唑-N-氮氧化物典型标准曲线分别为:f=8.36×10-3C+2.79×10-2,r=0.9973;f=9.31×10-3C+3.39×10-2,r=0.9972。结果表明,伏立康唑及其代谢物伏立康唑-N-氮氧化物浓度在10.0~8000 ng·mL-1范围内线性关系良好,定量下限均为10.0 ng·mL-1。
3.3 精密度与准确度试验
取1.5 mL 塑料离心管数支,按“2.3”项下方法操作,配制系列质控用标准含药血浆样本,每个浓度配制并处理5 份样本,共做3 批,计算批内、批间精密度和准确度。该方法精密度和准确度良好。见表2。
3.3 介质效应
分别取6 种不同来源的空白血浆和纯化水各50 μL,除乙腈不含内标外,按“2.4”项下方法操作,取上清液作为溶剂,配制伏立康唑和伏立康唑-N-氮氧化物浓度为25.0 ng·mL-1和6000 ng·mL-1的介质效应样本溶液和对照样本溶液若干份。分别取上述溶液50 μL 加入浓度为3.00 μg·mL-1的内标溶液2 μL,涡旋1 min,混匀,再取上清液40 μL 加120 μL纯化水至自动进样器样品瓶中,涡旋混匀后,进行LC-MS/MS 分析。记录色谱图,计算样本溶液、对照样本溶液各浓度伏立康唑和伏立康唑-N-氮氧化物的峰面积As和内标峰面积Ai的平均值,各浓度样本溶液峰面积的平均值与对照样本溶液峰面积的平均值之比,即为相应成分的基质效应。该方法待测物质的测定不受基质干扰。见表2。
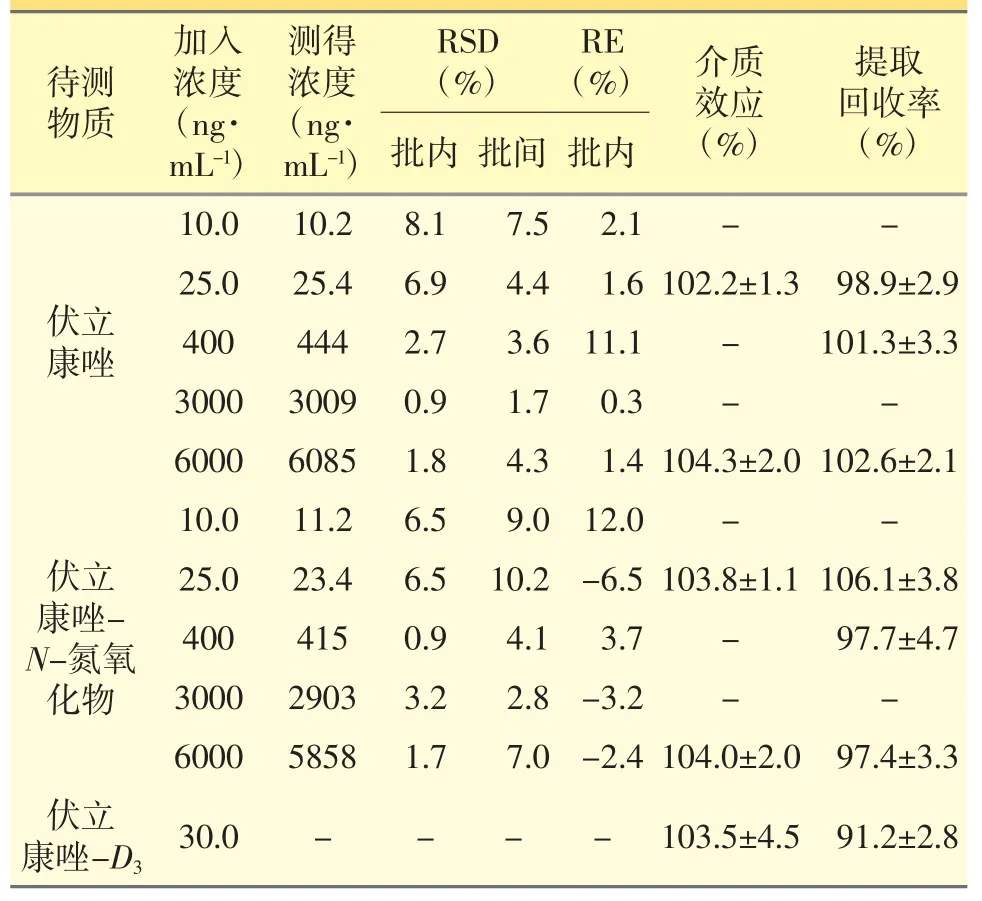
表2 伏立康唑和伏立康唑-N-氮氧化物精密度、准确度、介质效应和提取回收率结果
3.4 提取回收率
本试验考察了伏立康唑和伏立康唑-N-氮氧化物25.0、400、6000 ng·mL-1等3 个质控浓度水平的提取回收率。通过比较相应浓度质控用标准含药血浆样本溶液中待测物或内标的响应值与同一浓度介质效应样本溶液中待测物或内标的响应值,来评价回收率。该方法提取回收率良好。见表2。
3.5 稳定性试验
考察了伏立康唑和伏立康唑-N-氮氧化物25.0、400、6000 ng·mL-1等3 个质控浓度水平的血浆样品在室温放置20 h、-40 ℃条件下3 个冻融循环、-40 ℃条件下放置90 d 及处理后待测样品溶液自动进样器(10 ℃)放置24 h 的稳定性。结果表明,伏立康唑和伏立康唑-N-氮氧化物在各处置条件下稳定。
3.6 稀释可靠性和残留效应
取1.5 mL 塑料离心管数支,按“2.3”项下方法配制含伏立康唑和伏立康唑-N-氮氧化物浓度均为12000 ng·mL-1的标准含药血浆样本,用空白血浆稀释2 倍后,按“2.4”项下方法处理,重复稀释6 次,测得浓度与加入浓度的偏差均小于±15.0%,表明该方法具有良好的稀释可靠性。将标准含药血浆样本(8000 ng·mL-1)与空白血浆样本轮流进样,共10 次,在待测物和内标出峰位置无明显干扰,表明该方法残留效应符合要求。
4 伏立康唑注射液药代动力学预试验
试验方案经南京医科大学第一附属医院伦理委员会批准,2 名中国健康受试者(男女各1 人)给予4 mg·kg-1的注射用伏立康唑(Pharmacia &Upjohn Company,规格200 mg)。于试验第1 天早上8时空腹给药,用250 mL 的0.9%氯化钠注射液稀释,配制成所需的输液浓度。血样采集前,埋置肝素钠抗凝留置针头,于给药前(-30~0 min)及静脉滴注给药开始后15 min (0.25 h)、30 min (0.5 h)、45 min(0.75 h)、1、1.25、1.5、2 h (静滴结束)、2.25、2.5、3、3.5、4、6、8、12、24、48、72 h 采集静脉血4 mL,置于含EDTA 抗凝管中。轻摇后于4 ℃下离心,然后用吸管将血浆转移至预先标记好的冻存管中,每个血浆样本分成3 份,每份600 μL 置于1.5 mL 离心管中。立即以垂直方式置于-20 ℃冰箱保存,12 h 内转移至-70 ℃±10 ℃冰箱保存备测。采用WinNonlin(8.0)非房室模型计算伏立康唑在人体的药代动力学参数。
伏立康唑和伏立康唑-N-氮氧化物血药浓度-时间曲线见图3。2 例受试者单次静滴注射伏立康唑后的平均药代动力学参数:AUC0-t均值为10285 ng·h·mL-1,AUC0-∞均值为12761 ng·h·mL-1,Cmax均值为1767 ng·mL-1,Tmax均值为2.0 h,t1/2均值为9.86 h;伏立康唑-N-氮氧化物的平均药代动力学参数:AUC0-t均值为24220 ng·h·mL-1,AUC0-∞均值为30850 ng·h·mL-1,Cmax均值为1631 ng·mL-1,Tmax均值为5.0 h,t1/2均值为10.6 h。预试验结果显示,伏立康唑和伏立康唑-N-氮氧化物Cmax接近,后者AUC 更大,提示代谢物同样值得关注。
5 讨论
伏立康唑和伏立康唑-N-氮氧化物在有机溶剂中具有较高的溶解度,故可以考虑用乙腈或甲醇沉淀血浆蛋白来提取待测物。试验发现,血浆样品经甲醇沉淀时在出峰位置处基线明显抬高,而乙腈沉淀时基线波动较小,出峰位置处无明显的干扰峰,故采用乙腈作为沉淀剂。结果表明,用乙腈1∶4 处理可使回收率达85%以上,上清液加3 倍纯化水稀释后进样,未观察到明显的基质效应。
伏立康唑在正离子条件下有较强且稳定的质谱响应,故以正离子方式进行检测。在水相中加入0.1%的甲酸可以增加离子化效率并提高灵敏度。最低定量下限为10.0 ng·mL-1,满足生物样品测定过程中最低定量下限低于1/10~1/20 Cmax的要求。利用梯度洗脱优化色谱分离条件,最初将低甲醇比(45%)维持3 min 以达到基本分离,然后在0.1 min 内增加到95%,以冲洗内源性成分,因有机流动相含量高,也提高了分析物的电离效率[7]。
与高效液相色谱法相比,LC-MS/MS 具有特异性和灵敏度高的优点。与以往报道的LC-MS/MS 法相比,本研究乙腈沉淀提取待测物,0.1%甲酸和甲醇为流动相,具有更低的定量下限,操作简单、经济。建立的HPLC-MS/MS 法可运用于伏立康唑静滴注射人体作药代动力学预试验研究。

