甲氨蝶呤代谢酶基因多态性与类风湿关节炎患者疗效的相关性研究*
束 庆,曹 智,,王丹丹,朱怀军,葛泳含,刘蕴星,姚 瑶,孙 雷,葛卫红**
1 南京大学医学院附属鼓楼医院 药学部,南京 210008;2 徐州医科大学附属邳州医院 药学部,徐州 221300;3 南京大学医学院附属鼓楼医院 风湿免疫科,南京 210008
类风湿关节炎(rheumatoid arthritis,RA)是一类以关节炎为主要临床表现的系统性自身免疫病,全世界发病率约为0.24%[1],我国大陆地区患病率为0.2%~0.4%[2]。甲氨蝶呤(methotrexate,MTX)是欧洲抗风湿病联盟(EULAR)及美国风湿病学会(ACR)推荐治疗RA 的一线药物。关节损伤发生在类风湿关节炎病程的早期[3,4],治疗RA 首要目标是对疾病的早期控制,防止疾病进展对关节结构的破坏和功能的影响。但是,服用MTX 需6 个月才达到血药浓度稳态[5],方可判定疗效。此外,研究显示,约30%的患者对MTX 的治疗无效[6-8]。因此,MTX 在临床用药的困难是:能否预知MTX 对患者的疗效,从而能够早期有效控制疾病的活动。
关于MTX 在体内的代谢及药理机制的发挥过程如图1 所示:MTX 通过还原型叶酸转运载体-1(reduced folate carrier 1,RFC-1)运送到细胞内,进而谷氨酸基团通过多聚谷氨酰胺合成酶(folylpolyglutamate synthetase,FPGS) 添加到MTX上,转变为多聚谷氨酸化甲氨蝶呤(MTXPGn)[9];而γ-谷氨酰水解酶(γ-glutamyl hydrolase,GGH)则可移除MTXPGn 末端的多聚谷氨酸,使之恢复成单聚谷氨酸的形式,然后很快地被三磷酸腺苷结合盒转运体(ATP-binding cassette ABC 转运体)的膜蛋白家族转运出细胞。胞内的MTXPGn 可通过抑制:①胸苷酸合成酶(thymidylate synthase,TYMS)干扰蛋白质的合成。②抑制二氢叶酸还原酶(dihydrofolate reductase,DHFR)使四氢叶酸无法转化为二氢叶酸,进一步导致5,10-亚甲基四氢叶酸无法在亚甲基四氢叶酸还原酶 (5,10 -methylenetetrahydrofolate reductase,MTHFR)的催化作用下、形成5-甲基四氢叶酸盐,最终引起DNA 甲基化的减少。③抑制5-氨基咪唑-4 -氨甲酰核苷酸转甲酰酶 (5 -aminoimidazole -4 -carboxamide ribonucleotide transformylase,ATIC),影响嘌呤的合成。
在甲氨蝶呤通路中,各种代谢酶的基因多态性可能影响细胞内MTXPGn 对叶酸抑制作用的发挥效果[10]。但是,目前关于中国人群相关基因的多态性的研究较少,因此,本研究通过检测MTX 代谢酶基因多态性在中国RA 患者中的分布情况,探讨基因多态性与MTX 疗效的相关性,为临床对RA 患者的个体化用药提供参考。
1 材料和方法
1.1 仪器与设备
Verity 96well PCR 仪;Gene Genius 凝胶成像仪(Syngene 公司);3730XL 测序仪 (ABI 公司);H6-1 电泳槽 (上海精益有机玻璃制品仪器厂);DYY-8C 电泳仪(北京六一仪器厂);HC-2518R 冷冻离心机 (BBI 公司);TGL-14G 台式高速离心机(上海医疗器械有限公司)。
1.2 药品与试剂
甲氨蝶呤每片2.5 mg,上海上药信谊药厂有限公司。Pfu DNA 聚合酶、DNA 提取试剂盒、PCR 产物纯化回收试剂盒、PCR 扩增试剂、无乙水醇、异丙醇、丙三醇等均购自生工生物工程(上海)公司。
1.3 研究对象
选取2017 年3~11 月在医院门诊信息系统记录且诊断为RA 的患者,共纳入109 例。本实验符合人体试验委员会制定的伦理学标准,并按照鼓楼医院伦理委员会批准的标准执行。
1.3.1 入组标准、排除标准 入组标准:符合ACR2010年RA 诊断标准;能规律服用MTX(10 mg/周)至少3 个月,且合并用药为不影响MTX 代谢的免疫抑制剂。排除标准:联合其他抗风湿药物治疗者;有严重心、肾等重要脏器损伤和血液系统疾病者(WBC<4.0×109/L,Hb<80 g·L-1,PLT<70×109/L);肝功能ALT、AST 超过正常上限1.5 倍者;血肌酐超过正常上限者。
排除3 个月初判时ESR<20 mm·h-1、但是6 个月未达到有效标准的患者。
1.3.2 疗效评价 疗效判定标准为以下二种预定结果之一:(1)有效患者(稳定剂量的MTX 治疗至少6 个月,治疗6 个月后的血沉(ESR)<20 mm·h-1);(2)无效患者(稳定剂量的MTX 治疗至少3 个月,ESR 较用药前改善率低于20%)。
1.4 实验方法
1.4.1 患者血液采集 入组患者来院检查时,从检验科回收患者行血常规检查后剩余的血液样本,保存于-80 ℃冰箱中。
1.4.2 外周血DNA 的提取 应用Wizard®Genomic DNA 提取试剂盒进行提取。冷冻血充分解冻后混匀,取300 μL 加入到900 mL 细胞裂解液内,颠倒5~6 次混匀,室温静置10 min,颠倒2~3 次,14000×g 室温离心30s,弃去上清液,保留10~20μL,涡旋振荡器上充分振荡15~20 s;加入300 μL 核酸裂解液,反复吹打5~6 次,液体变粘稠;加入100 μL蛋白沉淀液,14000×g 室温离心3 min;在另一1.5 mL EP 管中加入异丙醇300 μL,将前一步骤中的上清液全部加入其中,轻柔反复颠倒至白色絮状沉淀出现;14000×g 室温离心1 min,弃去上清液,加入室温70%乙醇300 μL,轻柔颠倒EP 管;再于14000×g 室温离心1 min,弃去上清液,室温静置15 min;加入100 μL DNA 再水化液溶解DNA,标记后于-80 ℃冰箱保存。
1.4.3 PCR 实验方法
(1)引物的设计:见表1。
(2)PCR 反应体系:25 μL 体系的配制为1 μL 模板、0.5μL 正向引物、0.5μL 反向引物、0.5μL 的10mM dNTP、2.5 μL Taq 缓冲液、0.2 μL 的5 U·μL-1Taq酶、20 μL 的水。

表1 引物的设计
(3)PCR 反应条件:95 ℃预变性3 min;94 ℃变性30 s;58 ℃退火30 s;72 ℃延伸30~60 s;进行35 个循环;72 ℃修复延伸10 min。
1.4.4 基因型测序 用PCR 产物纯化回收试剂盒对产物进行回收,并用测序仪对其序列进行测定(3730XL 美国ABI),得到序列峰图进行分析。
1.5 统计分析方法
资料收集后经STATA14 进行卡方检验分析。P<0.05 为差异有统计学意义。计算各组基因型频率及等位基因频率,拟合优度卡方检验、确认各组基因型分布是否符合Hardy-Weinberg 平衡。各组间基因型及等位基因频率比较采用卡方检验。
2 结果
2.1 研究患者的基本特征
入组的患者共109 人,分析中包含的受试者的临床和人口学特征,见表2。

表2 纳入研究患者的基本特征
2.2 等位基因频率分析
探讨了6 个基因共15 个SNP 位点,其中ATIC(rs2372536)中共有7 位患者未检测出基因型;ATIC(rs7563206)中共有9 位患者未检测出基因型。等位基因频率见表3。
各等位基因频率与中国汉族人群的等位基因频率基本相同,无明显差异。各基因型频率分布均作Hardy-Weinberg 平衡检验,除RFC-1(rs1051266)、ABCB1 (rs1045642)、TYMS (rs2853542)、TYMS(rs34743033)、ATIC(rs7563206)这几个基因型外,其他基因频率分布P<0.05,表明样本来自一个较大的群体,具有群体代表性。
2.3 等位基因与疗效的相关性分析
探讨了6 个基因共15 个SNP 位点,各基因型与疗效的相关性检验见表4。
其中在ATIC(rs2372536)中共有7 位患者未检测出基因型,即有效患者中5 位、无效患者中2 位;在ATIC(rs7563206)中共有9 位患者未检测出基因型,即有效患者中8 位、无效患者中1 位。
2.3.1 RFC-1 基因多态性与疗效的关系 RFC-1(rs1051266)的基因型分布(AA/AG/GG)在有效组和无效组的比较中未显示统计学差异 (χ12=2.44,P1=0.12,χ22=1.16,P2=0.28,χ32=2.89,P3=0.09)。
2.3.2 ABCB1 基因多态性与疗效的关系 ABCB1(rs1045642)的基因型分布(CC/CT/TT)在有效组和无效组的比较中未显示统计学差异 (χ12=0.23,P1=0.63,χ22=0.01,P2=0.93,χ32=0.01,P3=0.93)。
2.3.3 MTHFR 基因多态性与疗效的关系MTHFR(rs1801131)的基因型分布(AA/AC/CC)在有效组和无效组的比较中未显示统计学差异 (χ12=0.001,P1=0.97,χ22=0.27,P2=0.60,χ32=0.27,P3=0.61)。MTHFR(rs1801133)的基因型分布(CC/CT/TT)在有效组和无效组的比较中未显示统计学差异 (χ12=0.004,P1=0.95,χ22=0.07,P2=0.80,χ32=0.02,P3=0.89)。
2.3.4 TYMS 基因多态性与疗效的关系 TYMS(rs2853542)的基因型分布(CC/CG/GG)在有效组和无效组比较中无统计学差异(χ12=0.07,P1=0.79,χ22=1.56,P2=0.21,χ32=1.03,P3=0.31)。TYMS(rs34743033)的基因型分布(2R2R/2R3R/3R3R)在有效组和无效组比较中仅P1有统计学差异(χ12=5.69,P1=0.02),即含有三个重复序列的患者疗效更好。
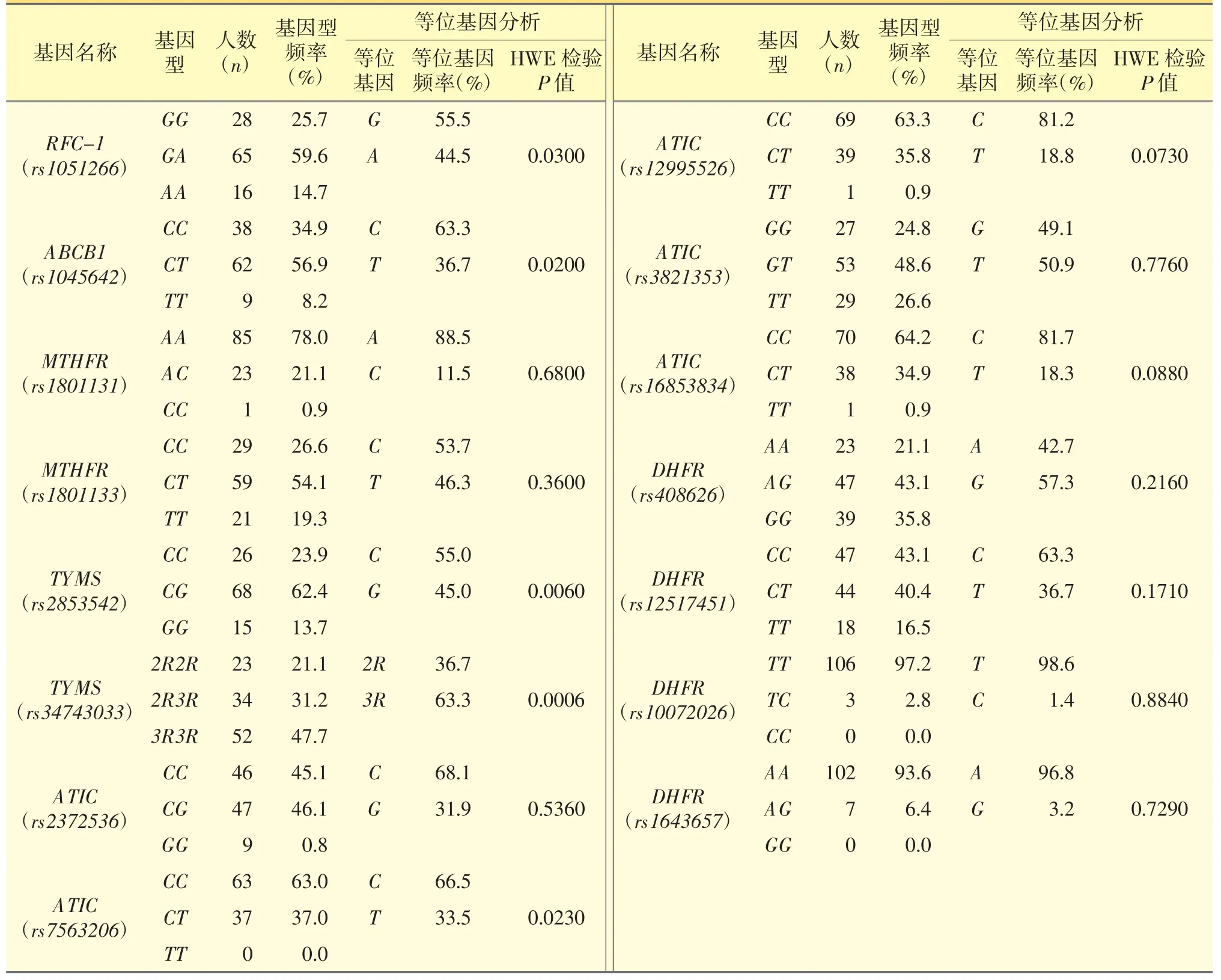
表3 患者MTX 代谢酶等位基因频率
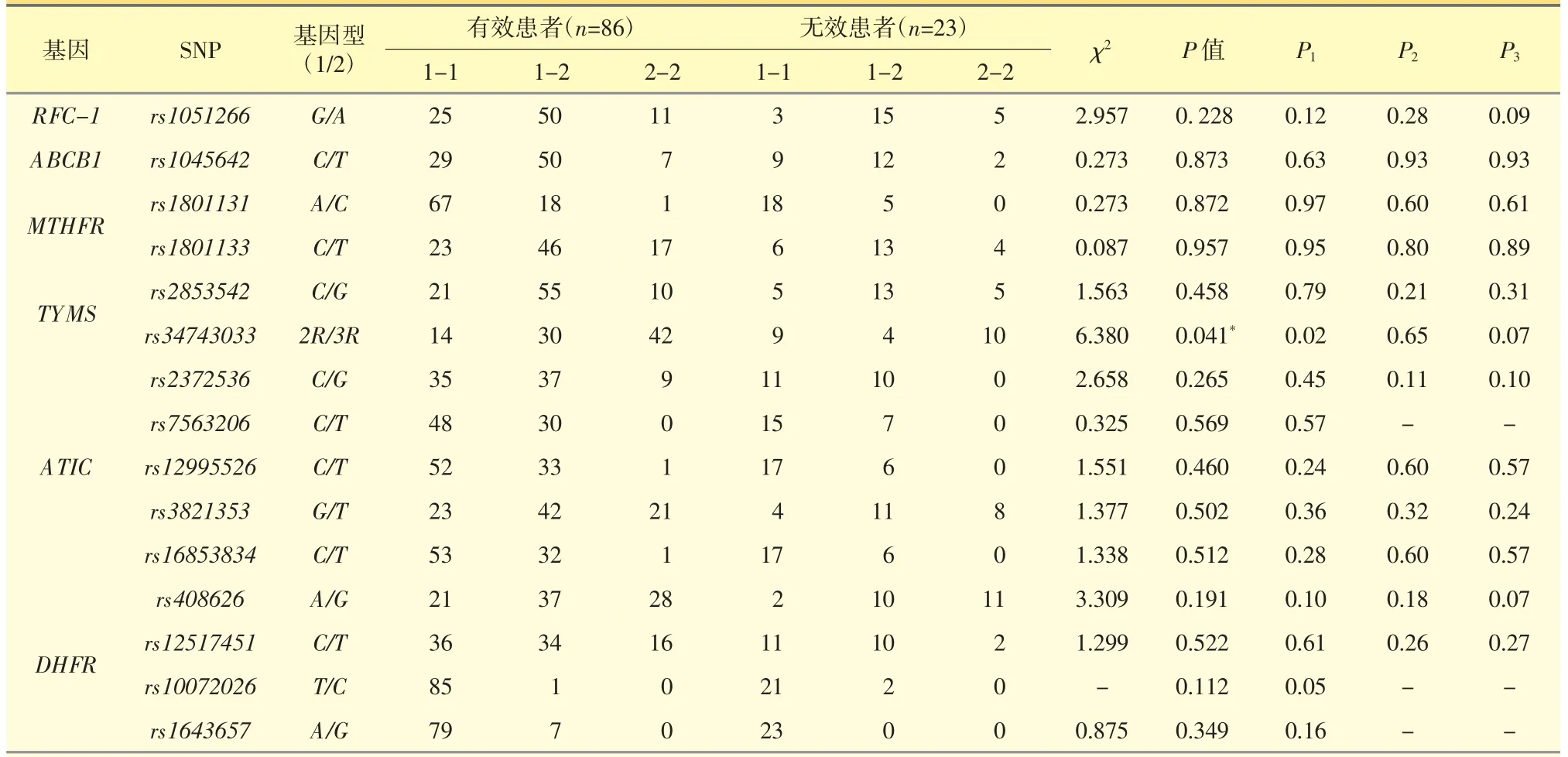
表4 MTX 代谢酶基因多态性与疗效的相关性检验
2.3.5 ATIC 基因多态性与疗效的关系 ATIC(rs2372536)的基因型分布(CC/CG/GG)在有效组和无效组的比较中无统计学差异(χ12=0.57,P1=0.45,χ22=2.56,P2=0.11,χ32=2.69,P3=0.10)。ATIC(rs7563206)的基因型分布(CC/CT/TT)在有效组和无效组的比较中无统计学差异 (χ12=0.32,P1=0.57)。ATIC(rs12995526)的基因型分布(CC/CT/TT)在有效组和无效组的比较中无统计学差异(χ12=1.41,P1=0.24,χ22=0.28,P2=0.60,χ32=0.33,P3=0.57)。ATIC(rs3821353)的基因型分布(GG/GT/TT)在有效组和无效组中无统计学差异(χ12=0.85,P1=0.36,χ22=1.00,P2=0.32,χ32=1.35,P3=0.24)。ATIC (rs16853834) 的基因型分布(CC/CT/TT) 在有效组和无效组的比较中无统计学差异(χ12=1.19,P1=0.28,χ22=0.27,P2=0.60,χ32=0.32,P3=0.57)。
2.3.6 DHFR 基因多态性与疗效的关系 DHFR(rs408626)的基因型分布(AA/AG/GG)在有效组和无效组的比较中无统计学差异(χ12=2.69,P1=0.10,χ22=1.84,P2=0.18,χ32=3.32,P3=0.07)。DHFR(rs12517451)的基因型分布(CC/CT/TT)在有效组和无效组的比较中无统计学差异 (χ12=0.26,P1=0.61,χ22=1.29,P2=0.26,χ32=1.23,P3=0.27)。DHFR(rs10072026)的基因型分布(TT/TC/C)在有效组和无效组的比较中无统计学差异(χ12=3.85,P1=0.05)。DHFR(rs1643657)的基因型分布(AA/AG/GG)在有效组和无效组的比较中无统计学差异(χ12=2.00,P1=0.16)。
3 讨论
早期预测RA 患者使用MTX 后的疗效反应,以及制定MTX 个体化治疗方案,以满足RA 患者需求,这是目前临床治疗上亟须解决的问题。因此,本研究通过入组在本院诊治并服用MTX 的109 名RA患者,考察了6 个MTX 代谢途径的关键酶的15 个基因多态性位点,发现TYMS(rs34743033)含有3R重复序列的患者对治疗反应效果好,即稳定剂量的MTX 治疗至少6 个月后ESR<20。
在本研究中发现TYMS (rs34743033) 与MTX疗效的相关性,既往关于葡萄牙和塞尔维亚RA 患者的研究显示,3R3R 基因型与MTX 治疗的无反应相关[11,12]。而Stamp LK等[13]在对108 名美国RA 患者与MTX 疗效之间的关系,研究发现,2R2R 基因型患者疗效较好。种族人群的基因差异导致的疗效差异可能是导致研究结论不同的原因。
本研究中还涉及了RFC-1(rs1051266)、TYMS(rs34743033)、DHFR(rs408626,rs10072026)等位点基因多态性与MTX 疗效的相关性;但是都未有显著意义,有待进一步扩大样本量来寻找疗效差异的基因位点。
在国外研究方面,在对于RFC-1 的研究中,Drozdzik M 等[14]研究分析了174 名波兰RA 患者与MTX(5~15 mg/周)疗效之间的关系,提示AA 基因型患者临床疗效较好。Ghodke-puranik Y 等[9]研究分析了217 名印度RA 患者与MTX(20 mg/周)疗效之间的关系,显示含有A 等位基因的RA 患者疗效更好。Hayashi H 等[15]研究分析了89 名日本RA 患者与MTX(8~12 mg/周)疗效之间的关系,显示具有G 等位基因的患者疗效更差;Hashiguchi M 等[16]研究分析了99 名日本RA 患者与MTX 疗效之间的关系,显示含有AA 基因型患者疗效更好。在服用MTX(4~10 mg/周)55 名日本RA 患者[17]与服用MTX(10~25 mg/周)327 名印度RA 患者[18]的研究提示,RFC-1 基因与疗效无关。
ABC 转运蛋白主要参与MTX 的外排,广泛表达于肠道细胞、肝脏细胞、肾小管上皮细胞,排泌功能影响胞内MTX 水平。ABC 亚型ABCB1 的C3435T(rs1045642)多态性的研究,有的结果提示,与MTX 治疗RA 的疗效无关[19],有的研究认为,TT基因型的患者病情缓解率较高[20]。
MTHFR 两个突变位点C677T (rs1801133)和A1298C(rs1801131)是影响酶活性重要因素。既往,较多研究关注这两个基因多态性与MTX 的疗效的相关性,但是研究结果仍不一致。其中,关于C677T(rs1801133),分析了233 名服用MTX(2.5~25mg/周)的葡萄牙RA 患者[11],200 名服用MTX(约15 mg/周)新西兰RA 患者[13],67 名巴基斯坦RA 患者[19]及309名英国RA 患者[21],结果研究均表明,该位点与疗效无关。而研究表明,120 名服用MTX (11.7±2.9 mg/周)的捷克RA 患者与MTX 疗效之间的关系,CC 型和TT 型等位基因疗效更好[22]。Dervieux T 等[23]研究分析了48 名美国RA 患者与MTX 疗效之间的关系,研究发现,TT 基因型患者疗效较差。关于A1298C (rs1801131),217 名服用MTX 20 mg/周的印度RA 患者的研究显示,含有A 等位基因的RA患者疗效更好[9]。Kato T 等[17]分析了55 名日本服用MTX 4~10 mg/周的RA 患者与MTX 疗效之间的关系,研究发现,AA 基因更容易使疾病缓解。但是关于120 名服用MTX(11.7±2.9 mg/周)的捷克RA 患者的结果表明,CC 型等位基因疗效更好[22]。
ATIC 是腺苷途径的重要代谢酶,该基因突变会影响细胞外腺苷的释放。309 名服用MTX(≥15 mg/周) 的英国患者的研究提示,ATIC 的三个单核苷酸(rs3821353,rs7563206 和rs16853834)与MTX 的疗效相关[24]。关于ATIC(rs2372536)这个位点:108 名美国RA 患者与MTX 疗效之间的关系,研究发现,GG 基因型与患者的疗效相关[13]。
关于DHFR 的研究,服用MTX (10.2±2.8 mg/周) 的125 名西班牙RA 患者的用药显示,AA 型患者疗效较差[25]。
需要特别指出的是,目前有关代谢酶基因多态性与疗效的研究结论并不一致,分析导致的原因可能主要为以下几点:①目前相关的研究基本属于回顾性或横断面研究。因此结果的分析仅为治疗期间的一个时间点,并不能全面反映患者在整个治疗期的情况,从而不能全面有效地反映出基因多态性这类潜在的遗传标记物对MTX 疗效的影响[26]。②MTX的疗程、剂量和给药途径在各个研究之间有差异,也是造成各项研究结论差异的影响因素。一般亚洲人群的剂量为10 mg/周,而欧美人群高达15~20 mg/周。③各研究对疾病活动的评价标准有很大差异。不同研究对于入组患者疾病程度的标准和临床观察终点的标准并不完全一致。④不同种族人群存在基因背景的差异,也可能影响研究结果的判定。
基于以上影响因素以及本研究是单中心小样本的研究,因此,后期一方面需要扩大样本量和联合多中心研究来探讨中国人群基因多态性对MTX疗效的影响;另一方面结合多位点的单倍型分析和MTX 活性产物的血药浓度测定来更好地评价药效,从而实现对RA 患者的个体化精准用药,为患者合理、安全、经济用药提供保障。

