达芬奇机器人辅助治疗巨大胆总管囊肿1例报告
山西医科大学第一医院
崔王平,刘 宇,余 杰,闫 浩,魏志刚
患者女,16岁,未婚,主因“上腹部疼痛伴发热15 d”于2018年7月12日入院。患者于入院前15 d无明显诱因出现上腹部疼痛,并不断加重,程度剧烈,伴恶心、呕吐及发热,体温最高达41℃,就诊于当地医院行MRCP等相关检查,诊断为胆总管囊肿伴感染,予以抗炎等治疗。为进一步诊治转诊我科。入院查体见全身皮肤、黏膜黄染,右上腹压痛(+),反跳痛(-),墨菲征(+),右上腹可触及巨大包块,质硬,活动度差,术前红细胞3.53×1012/L,血红蛋白83.0 g/L,其余血常规项目及肝功能已大致纠正于正常水平,大便潜血阳性,电解质水平及肿瘤系列等正常。继续完善腹部B超、CT等检查(图1),提示:肝内外胆管不同程度扩张,胆总管明显扩张,局部成囊状,约14 cm×12 cm,考虑先天性胆总管囊肿合并感染。结合患者血便常规等检查高度怀疑患者目前贫血为胆总管囊内出血所致,考虑患者一般情况较差,遂先行抗炎抑酸、纠正贫血、营养治疗等处理。由于患者年龄较小,且胆总管囊肿巨大,为在小切口下尽可能切除病灶并最大限度地保留正常胆管组织,保证胆肠吻合时的视野及灵活性,待患者一般情况改善后决定于2018年7月20日于全麻下行机器人辅助腹腔镜下胆总管囊肿切除术+胆肠Roux-en-Y吻合术。患者取平卧位,常规消毒铺巾。脐部穿刺建立气腹,脐下3 cm处做12 mm纵行切口,置入机器人腹腔镜目镜,直视下于适当位置穿刺Trocar,并连接机器人机械臂,置入腹腔镜器械。镜下探查见腹腔内无明显积气、积液,胆管囊肿直径约20 cm×15 cm,囊肿巨大,占据腹腔大部分空间(图2),与周围组织中度粘连,胆囊体积明显增大。用超声刀仔细分离粘连,先行胆管囊肿减压(图3),分离出囊肿上极,位于左右肝管汇合下1.0 cm,于此处切断胆总管,分离出胆囊管、胆囊动脉、右肝动脉,结扎切断胆囊动脉,将胆囊由胆囊床完整剥离(图4),牵开十二指肠,显露胆总管胰腺段及十二指肠段,于胆总管末端切开囊肿至正常胆管,将囊肿切除并移出体外,送术中快速冰冻,结果示:胆总管病变符合胆总管囊肿,慢性胆囊炎;于胆总管十二指肠段与胰管汇合前的胆管处行双层荷包缝合,并用电钩烧灼残余胆管壁黏膜,提起小肠,距屈氏韧带约20 cm处用腔镜下直线切割闭合器切断肠管(图5),仔细观察上段胆管黏膜,并整形修剪至合适长度(图6),于横结肠系膜根部无血管区做小口,将远端肠管由结肠后方向上提起,将距断端约5 cm处小肠与肝总管行端侧吻合(图7),于适当位置补加缝针,使吻合确切可靠(图8),距胆肠吻合口下方约40 cm处行近端小肠-远端小肠端侧吻合术(图9),检查两吻合口无张力,血供好,仔细止血,查无活动性出血、清点纱布器械无误后,分别于胆肠吻合口前方及后方留置腹腔引流管,逐层缝合切口。手术时间240 min,术中出血量100 mL,术中未输血,术后病理报告为胆总管囊肿,慢性胆囊炎,腺肌症。术后患者生命体征平稳,予以抗炎、抑酸、抑酶、营养等治疗,胆肠吻合口引流量逐渐减少,于术后第3天开始逐渐退管,术后1周拔除引流管,术后第10天患者一般情况可,恢复良好,出院。于术后2个月、半年来院复诊,无明显异常。

图1 冠状位 图2 探查见胆总管巨大囊肿 图3 胆管囊肿减压
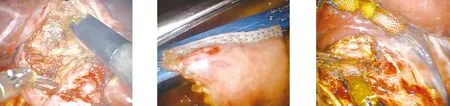
图4 完整剥离胆囊 图5 切断空肠 图6 胆管上段整形

图7 胆肠吻合 图8 胆肠吻合牢固效果确切 图9 体内人工肠肠吻合
讨 论 先天性胆总管扩张症即先天性胆总管囊肿,表现为胆总管呈囊状或梭状扩张,伴(或不伴)肝内胆管扩张的先天性胆道畸形,在东方国家较常见,女性多见,男女发病率约为1:4[1]。临床表现可有腹痛、腹部肿块、黄疸,也可伴发畏寒、发热等,囊肿破裂可继发胆汁性腹膜炎[2-3]。其发病原因可能为先天性胰胆管合流异常导致胰液反流入胆管,损害胆管内膜,继而导致胆总管囊肿;也可能为胆管上皮空泡化等先天性胆道发育不良,致使胆总管壁薄弱发生囊性扩张[4]。一般根据胆管扩张的部位、范围及形态可分为五种类型,I型为胆总管扩张,最常见,占70%~90%;Ⅱ型为胆总管憩室样扩张,占2%~5%;Ⅲ型为胆总管十二指肠壁内段扩张,占4%,又称为胆总管末端囊肿;Ⅳ型为胆管多发性扩张,占10%~20%;V型为肝内胆管单发或多发性囊状扩张,占1%,又称为Caroli病。目前更推荐将董氏分型作为分类标准:A型为周围肝管型肝内胆管扩张,分为2个亚型,A1型:病变局限于部分肝段,A2型:病变弥漫分布于全肝。B型为中央肝管型肝内胆管扩张,分为2个亚型,B1型:单侧肝叶中央肝管扩张;B2型:病变同时累及双侧肝叶主肝管及左、右肝管汇合部。C型为肝外胆管型胆管扩张,分为2个亚型,C1型:病变未累及胰腺段胆管;C2型:病变累及胰腺段胆管。D型为肝内外胆管型胆管扩张,分为2个亚型,D1型:病变累及2级及2级以下中央肝管;D2型:病变累及3级及3级以上中央肝管。该分型将肝外胆管扩张的分型化繁为简[5-6]。因反复发作的胆管炎可导致肝硬化、癌变、囊肿破裂或胆管结石等严重并发症,尤其癌变率较高,因此本病一经确诊,应尽早手术[7]。
完全胆总管囊肿切除+胆肠Roux-en-Y吻合术是其主要治疗手段,疗效较好。微创化已成为外科手术发展的主流方向,对于胆总管囊肿切除+胆肠Roux-en-Y已从传统开腹手术逐渐向腹腔镜手术发展[8]。然而腹腔镜手术多使用有限自由度的器械进行刚性操作,缺乏类似于人类手腕、关节的灵活运动,加之二维成像的特点,使手术操作难有深度感及平稳直观的术野,因而降低了手眼的协调性[9]。胆管空肠吻合要求精准的缝合技术,且操作空间狭小,对持针的技术要求尤其高,因而在腹腔镜下施行此术式有一定的局限性、挑战性,而且由于吻合技术及条件的限制,很多中心在肠肠吻合中往往采取体外吻合,增加了操作的不便利性[10]。达芬奇机器人手术系统在很大程度上弥补了传统腹腔镜手术的不足,突破了传统腹腔镜的限制。术中消除了外科医生的运动震颤,使操作更加精准、安全,避免了不必要的损伤;手术视野的三维可视化,更利于暴露上腹部组织器官结构,可正确识别解剖变异;机器人手术平台上的腕式器械,更能胜任精确控制技术的挑战性任务,如精细的解剖、缝合,可靠的吻合;为外科医生改进的人体工程学也是机器人系统的一个重要优势,它使外科医生能舒适地坐在控制台,进行复杂的解剖与精确的缝合[10]。也正是基于达芬奇机器人提供的操作便利与技术突破,手术效果、安全性方面的优势也逐渐显现,据报道[7,11],相较传统腹腔镜手术,机器人辅助治疗胆总管囊肿的术中、术后并发症(如出血、胆漏)发生率更低;患者对手术直观体验满意度更高,进一步增强了术后重返社会的信心[12]。在我国,根据刘斐、黄宪强等研究结合其早期的临床经验显示,机器人辅助手术在肝门暴露、胆肠吻合方面的优势明显,手术效果及远期随访结果显示,达芬奇机器人治疗胆总管囊肿的安全性、可靠性显著[13-15]。
结合本团队全机器人下胰十二指肠联合切除术的手术经验及成熟的胆肠吻合技术,我们认为,机器人胆总管囊肿手术的安全可靠性及手术效果明显:胆肠吻合时采用可吸收缝线PD-SⅡ于胆管前后壁进行双向连续吻合,机器人清晰放大的3D影像,使术者对吻合情况的观察更清楚,尤其后壁吻合确切,确保了吻合效果,降低了术后胆漏发生率;其次,本例患者由于胆总管囊肿巨大,占据了腹腔大部分空间,使操作空间受到限制,但因为机器人视野清晰,腕式结构的灵活性突出,对胆总管内壁的观察更加清晰,并且在精确结扎胆总管下段的同时,对胆总管胰腺段的残余黏膜进行完全烧灼,从而减少了胰液反流、胰瘘、残余胆管相关并发症的发生。当然达芬奇机器人手术也存在手术时间长、费用昂贵、缺乏触觉反馈等局限性,相信随着学习曲线及设备的不断优化,其局限性会不断减少。随着技术的进步、术者手术经验的积累,对于胆总管囊肿,机器人手术是可行的,可能给患者带来更多的裨益,并成为新趋势。

