早期开放血流技术在肾门部中央型肿瘤保留肾单位手术中的疗效分析
施 展,曲发军,胡传义,褚 健,叶剑青,干思舜,储传敏,曹建伟,章 璟,郑景存,徐冀东,张向民,张 鹤,崔心刚,
(1.浙江省台州市第一人民医院,浙江 台州,318020;2.第二军医大学附属上海公利医院;3.第二军医大学第三附属医院)
近年,随着腹腔镜技术在泌尿外科手术领域的日益普及,腹腔镜肾部分切除术越来越受到临床泌尿外科医师的青睐。研究表明,相较传统开放手术,腹腔镜肾部分切除术可达到良好的手术效果及肿瘤治疗目的,具有相同的远期与近期效果[1]。但其中肾门部中央型肾肿瘤,由于自身特性,包括手术风险高、切缘阳性率高、术后并发症多等,使得腹腔镜肾部分切除术受到了极大挑战[2]。2016年4月至2018年12月我中心共采用腹腔镜肾部分切除术治疗肾门部中央型肾肿瘤18例,手术效果较好,随访结果满意。现将体会报道如下。
1 资料与方法
1.1 临床资料 2016年4月至2018年12月共收治18例肾门部中央型肾肿瘤患者,其中男10例,女8例,平均(51.1±15.2)岁;左侧8例,右侧10例。肿瘤最大径(2.8±1.1)cm,R.E.N.A.L评分(8.5±1.2)分。患者均为体检或因其他疾病行B超或CT检查时发现肾肿瘤。术前行肾动脉CTA明确肾动脉情况,行智能型定性定量分析(intelligent qualitative and quantitative analysis,IQQA)三维重建明确肾动脉分支情况及与肿瘤的关系[3],并行肾脏肾小球滤过率检查评估分肾功能。
1.2 手术方法 麻醉成功后,患者取健侧卧位,头低足低折刀位,腰部适当垫高。健侧下肢屈曲、患侧下肢伸直,双腿间垫厚垫,妥善固定上述体位。根据肿瘤位置、大小及偏向肾脏背侧或腹侧,决定采用相应的经腹膜后入路(n=6)或经腹腔入路(n=12)。
1.2.1 手术入路选择[4](1)经腹膜后入路:于腋后线12 肋下做纵向切口,长1~2 cm,切开皮肤与皮下组织,置入中弯钳垂直戳入、穿透腰背筋膜,钝性分离肌层与腰背筋膜。置入食指将腹膜推向腹侧,将腹膜外脂肪推向内侧。置入气囊扩张器,充入1 000 mL气体,维持1 min后退出,以此扩张腹膜后间隙。于腋前线肋弓下及腋中线髂嵴上各做1~2 cm小切口,分别穿刺Trocar。充入CO2建立气腹,压力维持在13~15 mmHg。沿肾脏背侧分离出肾动脉(图1),沿腰大肌分离出输尿管。(2)经腹腔入路:于腹直肌外侧缘脐上2 cm做切口,切开皮肤及皮下组织,穿刺气腹针,突破腹直肌前鞘、后鞘及腹膜,充入CO2建立气腹,压力维持在14 mmHg,穿刺12 mm Trocar,置入腹腔镜。在腹腔镜直视下分别于锁骨中线肋缘下2 cm、髂前上棘内上方3 cm处穿刺12 mm Trocar。打开结肠旁沟附近的侧腹膜,下拉肠管。分离出输尿管,分离显露肾蒂,先找到肾静脉,在肾静脉深面分离显露肾动脉,用血管吊带环绕备用。
1.2.2 暴露及切除肾肿瘤 通过术前及术中阅读CT片,对肾肿瘤位置、大小及生长方式仔细判断。充分游离肿瘤周边区域,完全显露肾肿瘤(图2)。显露肿瘤的同时,进一步显露肾动脉、肾静脉的分支血管及输尿管的毗邻关系,以防误伤肾蒂血管与输尿管。应用腔内超声准确判断肿瘤边界。阻断肾动脉或分支动脉,必要时阻断肾静脉,结合钝性推剥与锐性切割,完整切除肿瘤(图3)。观察肾脏创面,采用单极或双极电凝预止血操作。
1.2.3 缝合创面、早期开放血流技术 使用Quill 0号可吸收倒刺缝线连续缝合肾脏内层髓质创面,遇血管断端及肾盂破口时,需要重点点对点缝合(图4)。此后,用Quill 1号可吸收倒刺缝线缝合外层皮质创面(图5),遇创面张力大、难以完全对合或不适合行创缘对合时,采用锁边缝合的方法予以缝合。此后开放肾脏血流,恢复肾脏供血。此时再次采用1号可吸收倒刺缝线连续缝合肾脏皮质创面进行加固缝合(图6)。根据术前IQQA三维重建的影像,明确肾动脉分支情况。明确肿瘤由分支血管供血时,可于术中完全分离肾门动脉血管,结合IQQA的血管重建结果,寻及供应肿瘤的分支动脉,此时可采用序贯血流阻断法,即先行肾动脉全阻断,缝合完内层创面后仅行分支动脉阻断。
1.3 标本的取出 将标本置入标本袋,冲洗手术区域。放置引流管,取出标本并缝合切口。
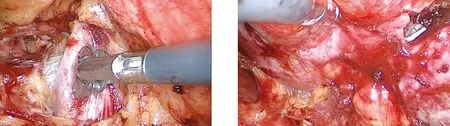
图1 分离显露肾动脉 图2 分离显露肾肿瘤及周围结构
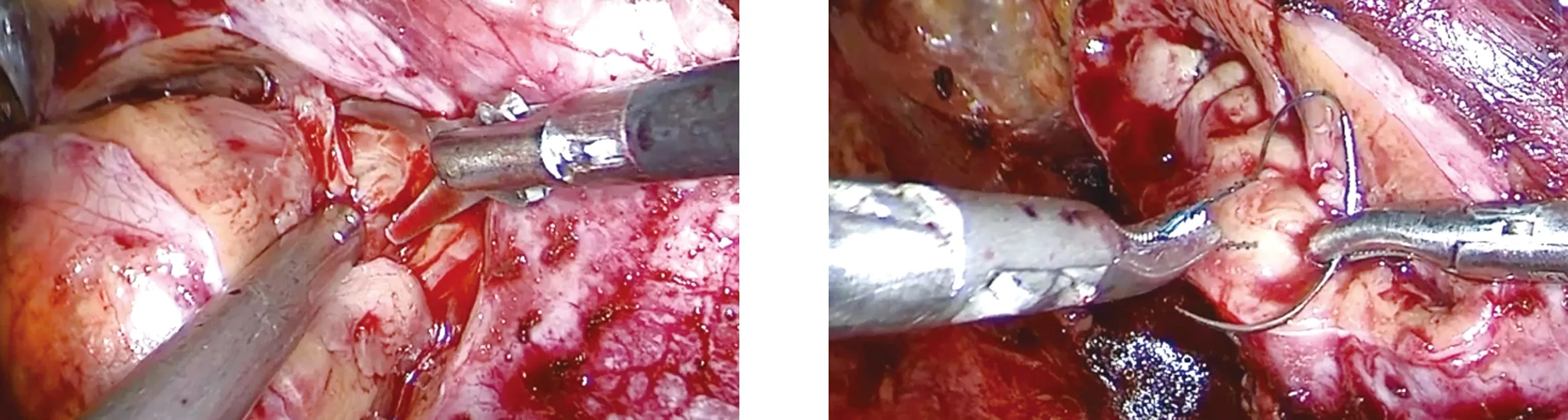
图3 完整切除肾肿瘤 图4 使用Quiil 0号线缝合内层创面

图5 使用Quill 1号线缝合外层创面 图6 加固缝合肾脏外层创面
2 结 果
16例患者均在腹腔镜下顺利完成肾部分切除术,2例中转开放手术行肾部分切除术。手术时间平均(134.5±18.4)min,平均热缺血时间(19.1±3.8)min,术中出血量平均(88.5±10.2)mL,术后引流管平均留置(4.8±0.5)d,术后平均住院(6.5±0.5)d。术后嘱患者绝对卧床48~72 h,术后3个月内禁止剧烈活动。3例患者出现术后严重出血,2例经数字减影血管造影及选择性肾动脉栓塞治疗后痊愈,1例患者保守治疗无效而行开放肾切除术;1例患者术后出现漏尿,经保守治疗后痊愈。术后随访患肾肾小球滤过率,2例患者较术前下降明显,其中1例合并肾动脉硬化疾病,另1例术后曾接受选择性肾动脉栓塞术,余者术后患肾肾小球滤过率下降幅度不明显,提示患肾功能恢复良好。术后病理结果:14例为透明细胞癌,4例为嫌色细胞癌。
3 讨 论
随着腹腔镜技术的日臻成熟,腹腔镜肾部分切除术的手术适应证也逐渐放宽。以往手术难度巨大的肾门部中央型肾肿瘤,也可尝试接受腹腔镜肾部分切除术,从而获得很好的治疗效果。所谓肾门部中央型肾肿瘤,国际上也存有争议。比较公认的定位为[5]:肿瘤靠近肾门,肿瘤的边界距肾蒂血管或肾盂集合系统的距离小于5 mm。本研究囊括的肾门部中央型肾肿瘤,也是采用的这一定义方法。这种类型的肿瘤有其自身的特点[6],主要包括:(1)肿瘤靠近肾门结构,术中极易损伤肾脏血管或肾盂输尿管;(2)术中肿瘤切除困难,容易导致肿瘤包膜破损,从而造成肿瘤残留或种植转移;(3)肿瘤创面边缘可能缺少正常肾组织,从而导致创面对合困难、张力大;(4)术后创面出血的可能性大,术后易出现需要急诊处理的延迟性出血等突发情况;(5)术中肾脏热缺血时间较长,术后易出现患肾功能不全甚至肾萎缩;(6)术中创面缝合效果不佳,术后创面出血时血液可进入破溃的集合系统,从而使出血难以自限。
因为存在以上诸多挑战性,因此对于肾门部中央型肾肿瘤而言,通常面临术式的诸多综合考虑,某些情况下为保证手术整体的安全性,而采用根治性肾切除术。但对于某些特殊群体而言,术后肾功能的保留可极大地提高生活质量,如孤立肾肾肿瘤。因此,对于有经验的泌尿外科医师而言,在充分评估并发症风险的基础上,结合自身腹腔镜技术水平,可尝试行肾部分切除术。在所有并发症中,我们认为,术后出血、漏尿、肾功能不全是最为严重的情况[7]。首先,出血是最为凶险的,本研究中3例患者发生严重出血,术后分析原因考虑为肿瘤较大,切除后创面张力大,导致对合困难,从而影响了术后创面对合的止血效果。其次,患肾功能严重受损甚至患肾萎缩,往往意味着“保肾”价值的无法体现,对于肾部分切除术而言是最为“得不偿失”的情况。造成患肾功能不全的原因很多[8],如肿瘤过大、切除了较多的肾组织;切除肿瘤及缝合创面过程中,切断、阻断了肾实质的血供;术中肾动脉阻断时间较长,肾脏热缺血时间较长,造成肾组织较重的热缺血再灌注损伤。其中,肾组织热缺血再灌注损伤是可通过技术改良而获益的最主要方面[9]。我们通过对早期开放血流技术进行改良,在保证缝合效果确切的基础上,缩短了肾脏的热缺血再灌注时间,从而为术后肾功能的恢复提供了有利条件。我们的技术优点主要体现在:(1)通过对术前IQQA重建,对肾门处的血管及供应肿瘤的血管充分了解,从而为术中的精确缝合及序贯血流阻断技术提供了技术保障;(2)肾门部位的肿瘤被切除后,创面往往难以在低张力的情况下有效关闭,此时需要行锁边缝合,即充分利用周围正常的肾包膜,在低张力的状态下有效缝合创面;(3)对于肾门部肿瘤而言,往往需要充分游离到肾动脉的二级、三级分支。结合术前IQQA三维血管重建的结果,可选择行全肾动脉阻断、分支肾动脉阻断及序贯血流阻断法[10]。三种阻断法执行的都是 “2+1”的缝合操作[11],即缝合完内层与外层创面后,开放血流,在无缺血状态下行加固创面缝合。全肾动脉阻断法针对肾脏、肿瘤血供复杂或肾动脉分支较晚的情况。分支血流阻断法可应用于肿瘤有较明确的分支血管供应,阻断分支肾动脉后可获得良好的手术视野,这一技术的应用有较为严格的适应证,术中容易出现创面出血、视野不佳的情况,某些情况下需要重新补行全肾动脉阻断。而序贯血流阻断法可应用于更为广泛的情况。序贯血流阻断技术是在结合分支阻断及“2+1”缝合技术上提供的新理念与新方法。具体操作为:分离肾动脉主干及分支血管后,行全肾动脉及分支动脉双重阻断;切除肿瘤后行创面内双极电凝止血、点对点血管断端缝合止血、集合系统破损处缝合关闭的操作,然后开放肾动脉主干的阻断夹,仅行分支动脉的阻断;在分支阻断的条件下,行切除创面的第2次缝合操作;然后开放分支动脉的阻断夹,行无阻断操作,在无阻断血流的条件下,行再次创面加固缝合操作。序贯血流阻断技术可达到“进可攻、退可守”的目的。
所谓早期开放血流,一定是在创面出血得到初步有效控制的基础上进行的,其核心理念是“2+1”缝合技术,其技术准备是IQQA三维血管重建,其技术革新是序贯血流阻断技术。我们认为,对于肾门部中央型肾肿瘤而言,在术者技术水平达到一定程度的基础上,可常规开展肾部分切除术。为了更有效地保护患肾功能的恢复,包含一系列技术保障的早期血流开放技术对患肾功能的远期恢复大有裨益,具有较好的临床应用价值。

