泰地罗新注射液在治疗猪呼吸系统疾病上的研究进展
田 伟 谭炳海 曾繁宝 冯言言 吴连勇
(齐鲁动物保健品有限公司, 山东济南 250100)
泰地罗新为动物专用的新型大环内酯类抗生素,其大环内酯环上有3 个氨基取代基,使得分子具有三元特性[1]。2011 年,英特威公司开发的以泰地罗新为活性成分的注射液(商品名“Zuprevo”)经欧盟批准用于治疗和控制对泰地罗新敏感的胸膜肺炎放线杆菌、多杀性巴氏杆菌、支气管败血波氏杆菌和副猪嗜血杆菌引起的猪呼吸系统疾病[1],2019 年4 月,我国农业农村部批准齐鲁动物保健品有限公司等单位申报的泰地罗新注射液为国家二类新兽药,新兽药注册证书号为(2019)新兽药证字19 号[2]。本文结合泰地罗新注射液在国内外治疗猪呼吸系统疾病的应用,阐述了泰地罗新注射液在猪上使用的抗菌谱、药物代谢动力学、临床应用、残留研究等内容,为该药物的临床合理使用提供参考。
1 抗菌谱
泰地罗新对胸膜肺炎放线杆菌、多杀性巴氏杆菌和副猪嗜血杆菌等病原菌具有很好的抑制和杀灭作用,临床上可用于治疗和控制由胸膜肺炎放线杆菌、多杀性巴氏杆菌和副猪嗜血杆菌引起的猪呼吸系统疾病[3]。
泰地罗新的作用机制同其他大环内酯类抗生素,能够与敏感菌的核蛋白体50S 亚基结合,通过对转肽作用和/或mRNA 位移的阻断,抑制肽链的合成和延长,影响细菌蛋白质的合成,起到抑菌和杀菌的作用[4]。
2 药物代谢动力学
泰地罗新在猪体内能够被快速吸收,以4 mg/kg·bw 肌内注射给药后,达峰时间(Tmax)为0.167 h,峰浓度(Cmax) 为1.116 μg/mL,绝对生物利用度为82.58%。体内分布广泛,表观分布容积(Vd) 为60.998 L/kg,肺和支气管液中泰地罗新的浓度较高。消除半衰期(t1/2)较长,约为121.90 h。药物约17%通过尿液排出,约57%通过粪便排出[2]。
据EMA 报道[5],以2 mg/kg·bw、4 mg/kg·bw、6 mg/kg·bw 对猪单剂量肌内注射泰地罗新注射液后,泰地罗新可被机体快速吸收,Tmax和Cmax平均值分别为0.38 h 和900 ng/mL。泰地罗新半衰期较长,t1/2>4 d,平均驻留时间MRT(0-LOQ)>3.5 d,以4 mg/kg·bw给药后,泰地罗新能够在呼吸道感染部位集聚。治疗后5 d 支气管液中的药物浓度高于14 000 ng/g,治疗后24 h 肺匀浆中的浓度高于4 000 ng/g,远高于血浆中的药物浓度。在治疗后至少14 d,支气管液中的泰地罗新浓度高于6 000 ng/g,肺匀浆中的药物浓度高于1 000 ng/g。
EMA 报道[1]大鼠和犬口服泰地罗新后能够快速吸收。血浆消除半衰期为6~17 h,不同性别的血浆药物浓度无明显差异。相比大鼠,犬口服泰地罗新的生物利用度较高。单剂量给药和一日一次重复给药并没有潜在的累积作用。大鼠和犬重复口服给药后,在结肠处检测到最高浓度的放射性物质,其次为肝脏、肾脏、脂肪和肌肉。泰地罗新在不同动物,如牛、猪、犬和大鼠的肝脏、肾脏和尿中进行代谢。尽管不同种系动物存在各种代谢形式,但是泰地罗新在靶动物和实验动物体内的主要代谢表型是相似的。
孙美珍等[6]研究了泰地罗新注射液在健康猪体内的药代动力学特点。研究选用8 头健康的杜洛克×长白×约克夏杂交猪,公母各半,8 周龄左右,平均体重为(16.3±0.66)kg。以4 mg/kg·bw 单剂量肌内注射泰地罗新注射液,前腔静脉采血,用高效液相色谱-串联质谱法检测血浆中泰地罗新的浓度,使用非房室模型处理血浆药物浓度-时间数据,计算有关药动学参数。研究结果显示,健康猪肌内注射泰地罗新注射液后的主要药动学参数如下:MRT 为(44.19±16.81) h,Cmax为(0.997±0.63)μg/mL,Tmax为(0.48±0.35)h,t1/2为(92.61±13.69)h,AUC 为(7.05±1.79)μg·h/mL,Vd/F 为(80.67±24.56) L/kg,CL/F 为(0.60±0.15)L/h/kg。研究得出结论,泰地罗新注射液在健康猪体内吸收迅速,达峰时间短,消除半衰期长,分布广泛。
闫超群等[7]研究了泰地罗新注射液在健康猪体内的药动学特征及生物利用度。试验选取20 头健康猪,随机分为2 组,按4 mg/kg·bw 进行单剂量静注、肌注泰地罗新注射液,于注射后5 min、10 min、15 min、0.5 h、1 h、2 h、4 h、8 h、12 h、1 d、2 d、3 d、4 d、5 d、6 d、7 d、8 d、9 d、10 d、11 d、12 d、13 d、14 d、15 d 进行前腔静脉采血,使用HPLC-MS/MS 法检测猪血浆中泰地罗新的浓度,使用非房室模型分析方法,计算药物的动力学参数。研究结果显示,猪静脉注射给药后, AUClast和 AUCinf(pred)分 别 为 (18 030.30 ±7 560.75)h·ng/mL 和(18 795.31±7 455.23)h·ng·mL-1,t1/2为(99.42±22.25) h,MRT 为(81.71±12.15)h。肌内注射停药后,Cmax为(886.00±155.63)ng/mL,Tmax为(0.51±0.30)h,AUClast和AUCinf(pred)分别为(19 702.05±6 442.36) h·ng/mL 和(20 840.08±6 849.76) h·ng/mL,t1/2为(100.83±20.23) h,MRT 为(81.80 ±9.44) h, 绝 对 生 物 利 用 度 为109.27%。研究得出结论,泰地罗新肌注后在猪体内具有吸收迅速、分布广泛、达峰迅速、消除缓慢、生物利用度高等特点,在兽医临床上可安全使用。
赵森等[8]研究了泰地罗新注射液在藏香猪体内的吸收、分布、转化及排泄规律,试验选取8 头藏香猪,以泰地罗新单剂量注射给药(4 mg/kg·bw),在不同时间点采集藏香猪血液,利用高效液相色谱法测定血浆中药物浓度。结果表明,泰地罗新注射液注射给药后,在藏香猪体内的药-时曲线符合吸收三室开放模型,其主要药 动 学 参 数:Tmax为(0.457±0.143) h,Cmax为(0.759±0.192)μg/mL,t1/2为(120.518±10.181)h,AUC 为(22.224±2.641)μg·h/mL。研究结果显示,泰地罗新注射液给药后,在藏香猪体内吸收迅速,消除较为缓慢。
3 微生物敏感性
EMA 报道[5]了2005—2010 年间在欧洲多个国家进行的泰地罗新对引起猪呼吸系统疾病主要病原菌的最小抑菌浓度(MIC)研究。具体结果见表1。研究表明,泰地罗新对引起猪呼吸系统疾病的常见病原菌,如胸膜肺炎放线杆菌、多杀性巴氏杆菌和副猪嗜血杆菌敏感性好。表1 泰地罗新对引起猪呼吸系统疾病主要病原菌的MIC 值(μg/mL)
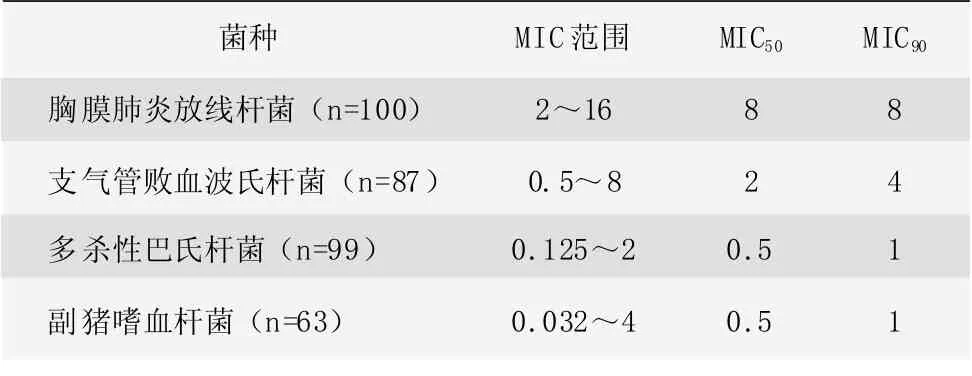
表1 泰地罗新对引起猪呼吸系统疾病主要病原菌的MIC 值(μg/mL)
Andersen 等[9]报道了泰地罗新与泰乐菌素、替米考星和泰拉霉素对溶血性曼氏杆菌、多杀性巴氏杆菌、大肠杆菌的MIC。结果表明,泰地罗新对引起畜禽呼吸道疾病溶血性曼氏杆菌和多杀性巴氏杆菌有很好的疗效,MIC 值分别为0.5 μg/mL、1 μg/mL。
4 临床应用
研究人员在德国开展了一项临床试验,以4 mg/kg·bw 单剂量肌内注射泰地罗新注射液,观察治疗猪呼吸道疾病的疗效[1]。研究结果显示,在治疗后10 d,泰地罗新注射液给药组的治疗成功率为86%,阳性对照药物氟苯尼考注射液对照组的治疗成功率为81%。在给药后第1 d,泰地罗新注射液治疗组和氟苯尼考注射液对照组猪的直肠温度、呼吸评分和状态评分均明显下降。
研究人员于2008—2009 年在德国和法国的6 个城市进行了泰地罗新注射液对猪的临床疗效研究[1]。试验选用4~20 周龄的患有呼吸系统疾病的猪,以4 mg/kg·bw 剂量单剂量肌内注射泰地罗新注射液,阳性对照药物为泰拉霉素注射液。在试验第10 d 和第17 d,分别计算泰地罗新注射液和泰拉霉素注射液对呼吸道疾病的治愈率,分别为93%和88%、92%和89%,复发率分别为6%和3%。两者试验组在治疗后第1 d 直肠温度、呼吸评分和状态评分均明显下降。
在美国针对泰地罗新注射液对猪呼吸系统疾病临床疗效的一项试验表明,泰地罗新注射液给药剂量为4 mg/kg·bw,单次肌内注射,选用泰拉霉素注射液作为阳性对照药物。研究结果显示,泰地罗新注射液和泰拉霉素注射液对猪呼吸系统疾病的临床治愈率分别为70%和69%,并且泰地罗新注射液明显优于生理盐水对照组治愈率(40%)[1]。
蒋其君[10]研究了泰地罗新注射液的临床药效。试验通过建立人工诱发感染疾病模型,确定副猪嗜血杆菌攻毒量。将试验猪群分为6 组,即泰地罗新注射液低剂量组(2 mg/kg·bw)、中剂量组(4 mg/kg·bw)、高剂量组(8 mg/kg·bw)和对照药物组(氟苯尼考注射液),感染对照组和健康对照组等进行人工感染副猪嗜血杆菌病治疗试验,并以临床症状、病理剖检以及有效率、治愈率和死亡率等指标进行临床疗效评价。研究结果表明,人工感染副猪嗜血杆菌疾病模型建立成功的攻毒剂量为0.25 mL/kg,攻毒活菌量为3×109CFU/mL,感染途径为腹腔注射。从人工感染副猪嗜血杆菌病例的治疗效果来看,泰地罗新注射液高、中、低剂量组与对照药物组在有效率、治愈率以及死亡率方面无显著性差异(P>0.05),泰地罗新注射液高剂量组与低剂量组在有效率、治愈率以及死亡率方面差异极显著(P<0.01),泰地罗新注射液中剂量组与高剂量组和低剂量组在有效率与死亡率方面无显著性差异(P>0.05),泰地罗新注射液中剂量组和高剂量组在治愈率方面无显著性差异(P>0.05),泰地罗新注射液高、中剂量组与感染对照组在死亡率方面差异极显著(P<0.01),泰地罗新注射液低剂量组与感染对照组在死亡率方面无显著性差异(P>0.05),对照药物组与感染对照组在死亡率方面差异极显著(P<0.01)。从自然感染猪呼吸道疾病病例的治疗效果来看,受试药物组与对照药物组在有效率、死亡率与治愈率等方面无显著性差异。研究结果表明,以4 mg/kg·bw 一次量肌内注射,可作为泰地罗新注射液治疗猪呼吸道疾病的最佳使用剂量。
林红等[11]评价泰地罗新注射液对靶动物猪的安全性。试验采用健康猪为试验动物,将24 头猪随机分为4组,每组6 头,给药组分别按临床推荐剂量的1 倍(4 mg/kg)、3 倍(12 mg/kg)、5 倍(20 mg/kg)给药,每隔4 d 给药1 次,连续给药3 次,健康对照组不给药,观察猪的临床表现、生理生化、组织病理学等指标,评价泰地罗新注射液在猪临床应用中的安全性。结果表明,与健康对照组比较,给药组猪的体重、血液生理、生化指标等检测结果差异不显著(P>0.05);解剖猪未见肉眼可见的病理变化,组织切片显微镜观测未见病理变化。说明泰地罗新注射液在猪体内耐受性高,按临床推荐剂量应用是安全的。
5 毒理学
EMA 报道[1,5],泰地罗新对啮齿类动物具有较低的急性毒性,口服剂量高达2 000 mg/kg·bw,小鼠静脉注射后的半数致死量LD50 范围为6.25~12.5 mg/kg·bw。对大鼠口服给予泰地罗新后,连续4 周口服给药后的最大无作用剂量为25 mg/kg,连续3 个月口服给药后的最大无作用剂量为20 mg/kg。对于犬,最大耐受的口服剂量为200 mg/kg·bw/d。在4 周的口服毒性研究中,未确定最大无作用剂量,确定了最低效应剂量为20 mg/kg·bw/d。在13 周的毒性研究中,建立最大无作用剂量为6 mg/kg·bw,在55 周的重复给药毒性研究中,最大无作用剂量为10 mg/kg·bw/d。
研究人员研究了泰地罗新对大鼠和兔子的生殖毒性,建立母体毒性和胎儿毒性的无作用剂量为30 mg/kg·bw/d。在任何研究的任何剂量水平均未发现泰地罗新具有潜在致畸性。研究人员研究了一系列泰地罗新的致突变性试验,结果显示泰地罗新无致突变性或基因毒性。鉴于泰地罗新缺少与致癌物质相关的化学结构,以及泰地罗新无基因毒性,并且考虑到大环内酯类抗生素无潜在的致癌性,因此,可以确定泰地罗新无致癌风险。基于使用大鼠和犬进行的急性和亚慢性毒性研究,可以确定泰地罗新无神经毒性。泰地罗新对皮肤和眼睛无刺激性。豚鼠接触泰地罗新后会有潜在的敏感性。
6 残留研究
研究人员研究了以4 mg/kg·bw 剂量对体重范围为30.1~38.4 kg 的猪单剂量肌内注射给药后的组织残留[1]。使用经验证的HPLC-MS/MS 分析给药后16 d 猪可食性组织中的残留情况。在最初采集的样品中,肾脏中的药物浓度最高,为11 320 μg/kg,其次为注射部位(8 649 μg/kg)、肝脏(4 145 μg/kg)、皮脂(721 μg/kg)以及最低的肌肉浓度(328 μg/kg)。在给药后第16 d,肾脏、注射部位、肝脏、皮脂和肌肉中的浓度分别下降为2390μg/kg、1761μg/kg、1928μg/kg、184μg/kg和68 μg/kg。
2014 年3 月,欧盟兽药委员会公布了泰地罗新在猪上使用的最高残留限量(MRLs)[5],如表2 所示。结合制定的最高残留限量,兽药委员会将泰地罗新在猪上使用的休药期定为9 d。
王文湘等[12]建立了适用于猪组织中泰地罗新残留检测的高效液相色谱- 串联质谱法。试验将猪组织(肌肉、肝脏、肾脏和皮脂)样品经0.1 mol/L 磷酸二氢钾溶液提取,上清液采用HLB 固相萃取柱浓缩净化,Phenomenex Luna Omega C18 色谱柱梯度洗脱,采用表2 泰地罗新在猪可食性组织中的最高残留限量(MRLs)(μg/mL)电喷雾正离子扫描和多反应监测(MRM)模式对泰地罗新进行分析,采用基质匹配法对泰地罗新含量进行标准校正。研究结果显示,泰地罗新添加剂量在肌肉中25~2 400 ng/g、肝脏中25 ~2 500 ng/g、肾脏 中25 ~2 000 ng/g 和皮脂中25~1 600 ng/g 的范围内,与特征离子峰面积呈良好的线性关系(r2≥0.99)。猪组织添加泰地罗新样品中肌肉、肝脏、肾脏和皮脂的检测限均为10 ng/g,定量限均为25 ng/g。对猪组织在定量限、1/2 MRL、MRL、2 MRL 这4 个剂量下进行泰地罗新的添加回收试验,各组织中的批内平均回收率为85.6%~105.0%,批内回收率相对标准偏差为2.3%~9.5%,批间回收率相对标准偏差为4.7%~7.6%。研究表明,该方法简单易行,灵敏度高且特异性强,可用于猪组织中泰地罗新残留量的分析测定。

表2 泰地罗新在猪可食性组织中的最高残留限量(MRLs)(μg/mL)
7 结语
泰地罗新注射液在国内外已批准用于治疗由胸膜肺炎放线杆菌、多杀性巴氏杆菌和副猪嗜血杆菌等细菌引起的猪呼吸系统疾病,临床疗效好,安全无副作用,在治疗猪呼吸系统疾病中具有广阔的市场应用前景。

