全小肠内置管减压引流在复杂小肠瘘早期治疗中的意义
刘鹭,李怡,吴剑宏
(1.华中科技大学同济医学院附属同济医院胃肠外科,湖北 武汉 430030;2.河南科技大学第一附属医院胃肠外科,河南 洛阳 471000)
小肠瘘的诊断及治疗较为困难,多数为手术相关并发症,以往小肠瘘病人死亡率高[1-2]。由于小肠瘘属于高流量瘘[3],腹腔内感染不容易局限,在肠瘘发生早期时,多采取非手术治疗,治疗手段比较消极;但是部分病人疾病进展迅速,合并明显感染及营养障碍,不得不早期采取手术治疗[4-6]。以往早期手术治疗方法单一,多以腹腔置管引流为主;行肠修补或肠切除易再发肠瘘,手术治疗效果难于令人满意。因此,小肠瘘早期手术时机的决策及手术方法的选择,目前仍是困扰胃肠外科医生一个棘手的难题。为此,我们总结近5年来小肠瘘早期手术治疗的经验,希望有助于提高对小肠瘘的科学认识,改善小肠瘘的治疗效果。
资料与方法
一、研究对象
2013年1月至2017年12月华中科技大学同济医学院附属同济医院胃肠外科收治小肠瘘并行全小肠内置管减压引流手术病人33例,其中肠梗阻行肠切除术后肠瘘12例(2例曾行腹部放疗);炎性肠病致肠瘘5例;腹部外伤术后小肠瘘5例;妇科手术后小肠瘘3例;P-J综合征并发肠套叠行小肠息肉切除术后肠瘘2例;小肠粪石切开取石术后肠瘘2例;腹部异物致小肠坏死肠瘘2例;膀胱穿刺致肠瘘1例;胆肠吻合术后肠瘘1例。年龄16~69岁,平均年龄37.9岁,男女比例约3∶1。
本组病人主要特点:①小肠瘘发生位置多位于小肠中上段,部分病人发生多处小肠瘘,最多发生7处肠瘘。②腹腔内污染严重,多处肠间脓肿形成,小肠壁水肿明显。③超过一半病人(18例)多次腹部手术史(>2次),剖腹探查发现腹腔粘连严重,存在多处肠梗阻;肠管松解时易造成肠壁不同程度破损。④因腹腔严重感染,消化液大量丢失,无法正常进食,大部分病人一般情况较差,部分病人处于感染休克状态。
二、手术方式
以上病人均急诊行剖腹探查术:①术中充分清洗腹腔。②切除肠瘘所在肠段,常规手工吻合,重建肠道连续性,对于多个瘘口存在的情况,若相对集中可采取切除相关肠段,相隔过远则根据情况行肠修补。③游离松解全小肠,游离过程中损伤的肠壁需仔细修补。④全小肠内置管减压引流术:于距屈氏韧带约15~20 cm空肠置入小肠内减压管(示意图见图1)。内置管为乳胶管,直径约为0.5 cm,长度根据肠管长度决定。内置管中段均剪出侧孔,侧孔不超过管道1/3,侧孔之间距离约为5 cm。内置管沿肠管向下,通过空肠、回肠及肠吻合口,进入盲肠。常规切除阑尾,内置管远端经阑尾残端引出(图1)。内置管近远端由肠管引出后,分别以双荷包缝合,近远端分别经左上腹及右下腹引出腹腔并固定;肠管顺序放入腹腔。⑤将引流管置于左右侧腹,根据术中情况可留置多根引流管,其中吻合口旁常规置引流管。术后常规行肠内减压引流,营养支持,抑制肠分泌及抗感染治疗。
三、术后处理
①术后内置管两端立即接引流袋,充分胃肠减压;②应用生长抑素类药物,减少消化液分泌,进一步减低肠管内压力;③病人通气通便顺利,无腹膜炎表现情况下,可开始尝试夹闭小肠内置管近远端,病人顺利恢复情况下,内置管一般于术后4周拔除,若存在其他情况,拔管时间可以延后。拔除前需提前20 min饮用少量石蜡油。拔管时,首先在保持张力条件下,剪去内置管近端体外部分,近端即回缩,再从远端拔出。拔管时注意动作应轻柔缓慢, 以免造成肠套叠,多采用分次拔管,每次拔管长度约为1 m,如遇困难可从内置管注入石蜡油协助拔管,有阻力时切不可暴力拔管。每次分次拔管结束后,别针固定内置管,以免回缩。
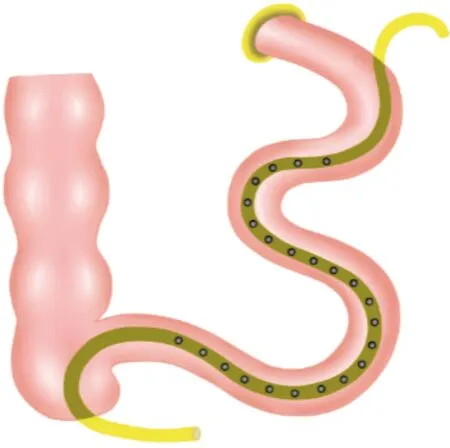
图1 全小肠内置管减压引流示意图
结 果
在33例病例中,5例再发肠瘘,其中1例为炎性肠病,因家属放弃治疗出院,结局不详;余4例肠瘘再发病人中,P-J综合征术后1例,腹部外伤术后1例,小肠切开取石术后肠瘘1例,肠梗阻术后1例。4例均通过原留置的引流管行腹腔双腔负压引流后肠瘘自愈,康复出院。这4例肠瘘再发病人病程特点:①肠瘘再发后流量较小,多数为200~400 ml;②肠瘘流量减少迅速,多于4~8 d迅速降至50~100 ml,其中1例在10 d内由1 500 ml下降至50 ml,15 d后瘘口自闭;③病程较短,多于2~3周内瘘口自闭,恢复进食;④均未再发弥漫性腹膜炎,均未再行手术治疗。其余28例病人恢复顺利,在院期间均有不同程度的腹胀、腹痛,均可自行缓解。
术后5例出现切口感染,肛门排气时间为3~4 d,平均住院时间为19.8 d,拔除小肠内置管时间为(32.3±5.9) d。
讨 论
小肠瘘多数继发于腹部手术后,也可继发于腹部创伤、炎症感染等其他多种原因,70年代之前早期死亡率在80%以上[7]。目前随着营养支持的进步以及治疗策略的改变,小肠瘘的死亡率控制在10%~30%[8-9]。目前对于小肠瘘的处理,早期的限制性手术及后期确定性手术是治疗的主要方式。目前小肠瘘的治疗周期多半在3个月以上,除了时间消耗外,长期的住院导致病人的经济负担同样很重。然而传统的急诊手术单纯行瘘修补或肠切除肠吻合,再发瘘概率高,大多数以失败收尾,这也是死亡率高的主要原因,因此我们通过对急诊手术处理方式进行改进,并取得满意的效果。在本组33例病例中,28例顺利恢复,5例再发肠瘘中,除1例由于家属放弃不知道结局外,其余4例均通过保守治疗恢复,免去再次手术之苦,取得了满意的临床效果。
全小肠内置管减压引流对于小肠瘘早期手术治疗有着重要的作用:①能有效降低肠腔内压力,减少消化液蓄积,大部分再发肠瘘主要是由于腔内压力增高,消化液腐蚀吻合口造成修补或吻合失败,所以充分减压引流对于肠管愈合生长有着重要意义。②除了能有效减压外,全小肠内置管同时也包含有肠道排列作用,小肠瘘的病人多半合并着严重的腹腔感染,腹腔内易形成广泛粘连,术后近期的粘连,特别是瘘口远端的粘连甚至梗阻可导致近端肠管压力增高,再发肠瘘,造成手术失败;远期的粘连可致病人因粘连性肠梗阻再次入院手术,全小肠内置管的应用能使肠道形成有序的粘连,减少上述情况的发生。这样的排列不会额外损伤肠壁,乳胶管作为内置管,其本身的韧度和弹性保证不会出现肠袢呈锐角的状况,充分保证了肠道的通过性[10]。
在小肠瘘急诊手术过程中,由于本身多个瘘口的存在,以及分离腹腔粘连过程中造成的医源性肠壁破裂,需要我们处理多个瘘口。以往,由于担心瘘口的修补无法愈合,多半以肠段切除处理,但是多个节段肠切除除了本身吻合口瘘的风险外,同时会造成肠管长度的损失,严重时可能造成短肠综合征。对此我们的经验是,在放置内置管前提下,处理小瘘口时,直接修补也有着很高的成功率,主要是由于内置管可以进行有效的肠管内减压。
内置管近端置入位置我们选择的是距屈氏韧带约15~20 cm,距离太短容易在后期成角造成近端梗阻,过长不利于肠道充分的引流和排列。在内置管引出上,我们采取的近远端均引出的方式,相比于近端单侧引出,这种方式的远端引流效果更好,而且在拔除内置管时,选择由远端顺肠蠕动方向拔出,避免由近端逆蠕动拔出造成的相关肠套叠等并发症。我们这样做的缺点是:由于多一个肠道引出孔,相关渗漏的风险也提高,故在阑尾及回盲部肠管条件差的情况下,可考虑由升结肠、甚至是横结肠引出远端,不限于一定由阑尾处引出。
我们在选择应用内置管引流术的病例中,多为中上段小肠瘘,腹腔污染重,存在明显粘连和梗阻风险的病人,对于腹腔污染轻,粘连不严重,肠管条件良好的病人,没有必要一律使用内置管引流术。若没有选择地应用会增加病人的不适和负担,主要是由于:①内置管置入术本身会延长手术时间;②内置管肠壁引出孔的存在会增加引流口瘘的风险;③内置管未拔除前均有不同程度的腹痛。
另外,术后切口感染对于肠瘘这一类的污染手术来说,还是最为常见的并发症,术中应加强对切口的保护,术前、术后的抗生素需达到足够的使用强度。术后应用包括谷氨酰胺、ω-3脂肪酸、精氨酸等, 通过增强免疫细胞应答, 达到减轻有害或过度的炎症反应,维持肠道正常屏障功能的作用[11-14]。在术后恢复过程中,同时多给予病人鼓励,对一些消极的病人可以给予心理治疗,目前心理治疗在小肠瘘中的作用也得到重视[15]。
全小肠内置管减压引流在小肠瘘早期手术治疗,尤其是高位、高流量瘘中有明显的治疗效果。该手术方法的探索及改进对小肠瘘早期治疗和预防有显著临床意义。技术本身容易掌握,适合广泛推广,特别是基层医院处理相关疾病时使用。

