葡萄籽多肽制备及其自由基清除能力的研究
李文慧,刘飞,刘江,赵巧玲,董娟,*
(1.石河子大学食品学院,新疆石河子832000;2.喀什大学生命与地理科学学院,新疆喀什844006;3.新疆赛里木现代农业股份有限公司,新疆博乐833400)
葡萄在世界上无论是栽培还是产量都在水果里占有很大的比例,全世界葡萄的每年产量大概有6 000万吨,我国年产量达到200多万吨,由于对葡萄籽不合理利用和加工,造成了葡萄籽副产物不可避免的浪费[1]。葡萄籽蛋白含有人体8种必需氨基酸,脱脂葡萄籽粕中含有蛋白质约13%~16%,而脱壳榨油后的籽粕中蛋白质含量高达30%,以酶解的方法能够水解葡萄籽蛋白并且成功得到葡萄籽活性多肽,多肽分子量很小并且没有免疫原性、易吸收,同时为我国动植物生物活性多肽的研究提供强有力的理论基础[2]。
本文通过酶法改性、冷冻干燥制备葡萄多肽,再根据自由基清除能力、抗油脂氧化酸败和还原能力的测定,分析葡萄多肽的抗氧化活性;最后通过试验设计优化工艺流程关键技术参数,确定最佳工艺参数,可提高葡萄籽的附加值,具有较好的发展前景[3]。不但能够充分利用新疆优越的资源优势,推动多肽食品的开发,而且还能推动新疆的农作物经济发展,实现资源的有效利用。
1 材料与方法
1.1 材料与试剂
晒干的葡萄籽:玛纳斯县新天国际葡萄酒业有限公司。以脱脂葡萄籽粕为原料,采用酶辅助碱溶酸沉法得到脱脂葡萄籽中的蛋白质。
石油醚、氢氧化钠、甲醛、DPPH试剂:天津永晟精细化工有限公司;95%乙醇:乌鲁木齐碘伏消毒液有限责任公司;考马斯亮蓝G-250:背景博奥拓达科技有限公司;牛血清白蛋白、木瓜蛋白酶(>200 U/mg)、碱性蛋白酶(>200 U/mg):安驰科技股份有限公司。
1.2 仪器与设备
小钢磨粉碎机:温岭市林大机械有限公司;ZXRD-7080全自动新型鼓风烘箱:上海智城分析仪器制造有限公司;DK-8D数显恒温水浴锅:金坛市医疗仪器厂;Multifuge X3R 离心机:Thermo Fisher scientific;UVmini-1240分光光度计:日本岛津公司。
1.3 方法
1.3.1 葡萄籽多肽的制备工艺流程
脱脂葡萄籽蛋白→复合酶解(碱性蛋白酶、木瓜蛋白酶)→离心→干燥→酶解物(葡萄籽多肽)
1.3.2 水解度的测定
蛋白质在水解过程中肽键会断裂生成多肽或游离氨基酸[4]。因此,水解度=游离氨基氮含量/总氮含量。游离氨基氮含量采用甲醛滴定法,总氮含量测定采用凯式定氮法(GB 5009.5-2016《食品安全国家标准食品中蛋白质的测定》)。
1.3.3 复合酶解单因素试验设计
分别以复合酶质量比(0∶10、4∶6、5∶5、7∶3、9∶1、10∶0)、酶浓度(0.5%、1%、1.5%、2%、2.5%)、pH(6.2、6.6、7.0、7.4、7.8)、酶解温度(40、45、50、55、60 ℃)和酶解时间(1、2、3、4、5 h)为影响因素考察其对水解度的影响[5]。
1.3.4 试验设计
通过单因素试验确定了复合酶质量比为7∶3,在单因素试验得到最佳值的基础上,使用Design-Expert 8.9.6软件程序,根据Box-Behnken中心组合试验设计原理,选择如表1所示的响应面分析法,以水解度为响应值,通过响应面分析对提取条件进行优化,选择出葡萄籽多肽水解度最高的提取条件为最佳提取工艺[6-7]。各因素、水平的正交试验,因素水平见表1。

表1 响应面因素水平表Table 1 Response surface factor level
1.3.5 葡萄籽多肽抑制油脂氧化活性的研究
采用最优工艺提取出的葡萄籽蛋白多肽,分别溶于葵花籽油中,在65℃强化条件下,定期(每隔2天)测定油脂的过氧化值,相同条件下与VC、VE做对照试验,观察葡萄籽蛋白多肽对葵花籽油氧化的抑制作用[8]。
1.3.6 清除DPPH自由基能力的测定[9]
将1 mL不同浓度葡萄籽蛋白复合蛋白酶酶解物与3 mL的DPPH反应,反应平衡时517 nm处测定吸光度,研究其对DPPH自由基的清除率。

式中:A0为空白吸光度值;A为517 nm下加入样品的DPPH的吸光度值;Ab为517 nm下不加入样品的DPPH的吸光度值。
1.3.7 数据分析
试验中每组试验重复3次,OriginPro8.5进行制图。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 复合酶的配比对葡萄籽蛋白水解度的影响
复合酶的配比对葡萄籽蛋白水解度的影响见图1。

图1 复合酶的配比对葡萄籽蛋白水解度的影响Fig.1 Effect of the ratio of compound enzyme on the degree of hydrolysis of grape seed protein
根据图1可知,使用质量比为碱性蛋白酶∶木瓜蛋白酶=7∶3时,蛋白多肽水解度达到17.93%,当加入碱性蛋白酶和木瓜蛋白酶时,蛋白多肽被分解为分子质量更小的多肽和氨基酸,因此效果最佳[10]。
2.1.2 复合酶浓度的影响
设定酶解pH7.0、酶解温度45℃、酶解时间3 h,考虑不同酶浓度(0.5%、1%、1.5%、2%、2.5%)对水解度的影响,结果见图2。

图2 复合酶浓度对水解度的影响Fig.2 Effect of the concentration of complex enzyme on the degree of hydrolysis
由图2可知,在pH值、酶解温度、酶解时间一定的情况下,随着酶浓度的增大,反应速度越快,蛋白质水解度也越高,但当酶浓度为2%以后水解度基本不再增加[11-12]。
2.1.3 pH值的影响
设定酶浓度为2%、酶解温度45℃、酶解时间3 h,考虑不同pH值对水解度的影响,结果见图3。
由图3可知,在酶浓度、酶解温度、酶解时间一定的情况下,使用复合蛋白酶水解pH 7.4左右时,水解度达到最大,高于或低于此值,酶的活性都会受到抑制[12-14]。

图3 pH值对水解度的影响Fig.3 Effect of pH on the degree of hydrolysis
2.1.4 酶解温度的影响
设定酶浓度为2%、pH为7.4、酶解时间3 h,考虑不同酶解温度对水解度的影响,结果见图4。

图4 温度对水解度的影响Fig.4 Effect of temperature on degree of hydrolysis
酶是具有很强专一性的蛋白质,所以只有达到某种温度时,酶才有最强的活性,当加热温度过高时,会导致酶蛋白变性,使酶丧失催化能力。由图4可知,在酶浓度、pH值、酶解时间一定的情况下,使用复合蛋白酶水解脱脂葡萄籽,酶解温度50℃时,水解度达到最大[15-18]。
2.1.5 酶解时间的影响
设定酶浓度为2%、pH为7.4、酶解温度50℃,考虑不同酶解时间对水解度的影响,结果见图5。

图5 时间对水解度的影响Fig.5 Effect of time on the degree of hydrolysis
由图5可知,在前3 h内,水解度有一个较快的增加,但是酶解3 h以后再延长酶解时间,水解度基本上不再增加。因此,考虑到生产成本,选择3 h为最佳酶解时间。
2.2 响应面法试验结果及回归方程分析
2.2.1 响应面法试验方案及结果
在单因素试验结果的基础上,选定酶解时间(A)、酶解温度(B)、酶解pH值(C)为因素,以水解度为响应值,根据响应面分析方法,设计三因素三水平试验方案,试验设计方案及结果见表2,试验设计方案共17个试验点,12个为分析试验,其余5个为中心试验(用于估算试验误差)。

表2 响应面试验方案及结果Table 2 Response plan experiments and results
2.2.2 回归方程的建立与方差分析
回归方程方差分析见表3。

表3 回归方程方差分析Table 3 Analysis of variance of regression equation

续表3 回归方程方差分析Continue table 3 Analysis of variance of regression equation
试验结果进行多元拟合回归,得到以葡萄籽蛋白水解度(Y)为因变量,以酶解时间(A)、酶解温度(B)、酶解pH值(C)为自变量的回归方程为:Y=23.33-1.23 A+0.30B+2.88C+0.020AB+2.15AC-0.16BC-1.05A2-2.73B2-1.64C2
由表3可知,回归模型P小于0.000 1,水平为极显著,能够正确反映葡萄籽蛋白水解度与各因素之间的关系,失拟项P值为0.921 1,P>0.05,表示其不显著,说明回归模型与实际实验拟合较好,多元相关系数R2=0.996 6,表明实测值和预测值间有很好的拟合度,此模型调整R2为0.986 5,表明有98.65%的得率变异分布在所研究的3个相关因素中。方程的B、BC表现为显著,A、C、AC、A2、B2、C2表现为极显著,说明这3个因素对葡萄籽蛋白水解度影响都较大。根据F值大小,可知影响因素的主次顺序为酶解pH值>酶解时间>酶解温度。方差分析结果显示该回归模型适用,可适用于葡萄籽多肽提取试验。
2.3 响应面分析
利用软件对试验结果进行统计并生成响应曲面图及等高线图,见图6~图11。
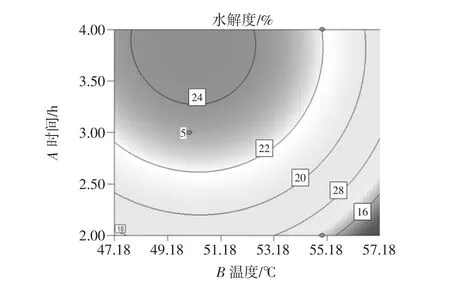
图6 时间-温度等高线图Fig.6 Time-temperature contour map

图7 时间-温度响应曲面图Fig.7 Time-temperature response surface map
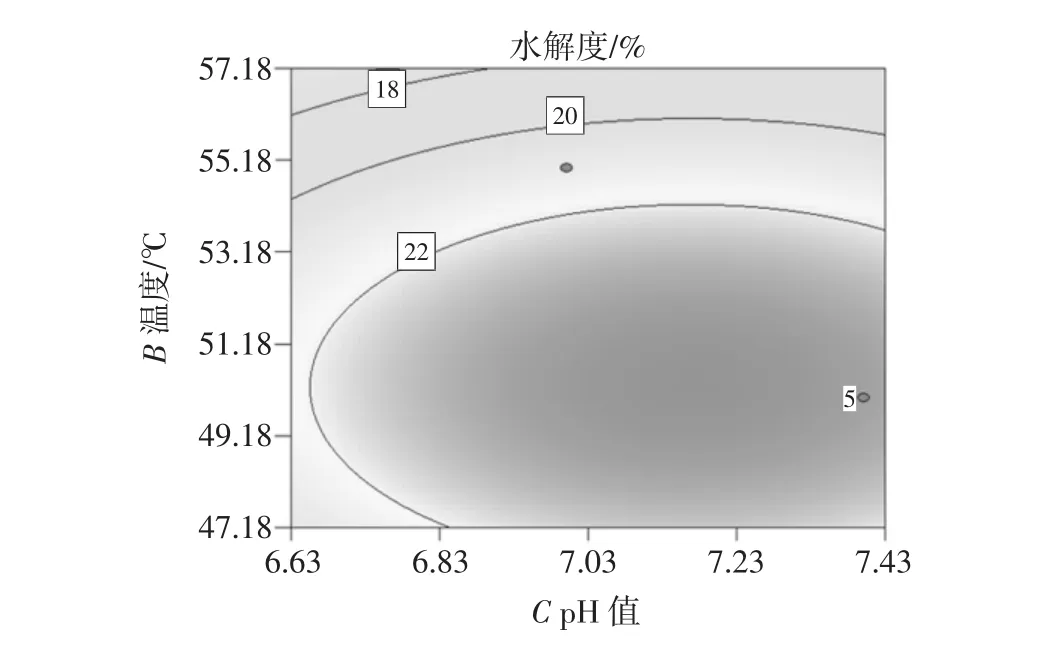
图8 温度-pH等高线图Fig.8 Temperature-pH contour map
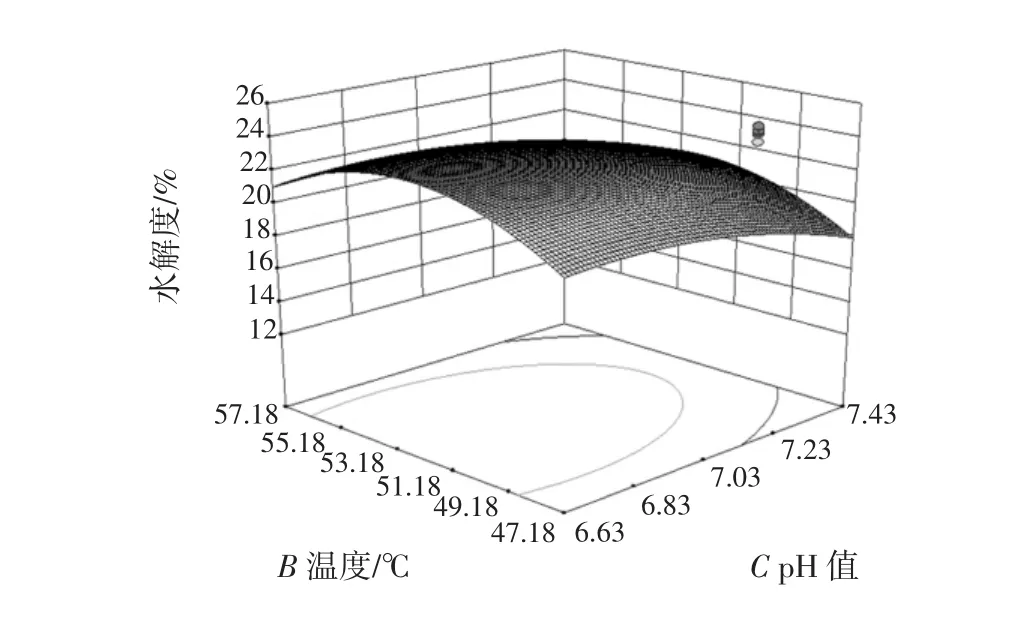
图9 温度-pH响应曲面图Fig.9 Temperature-pH response surface map
等高线图的形状一般趋于椭圆形和圆形,椭圆形表示因素作用显著,而圆形则与其相反。同样,从响应曲面图曲面的平缓或陡峭也可以反映出两因素交互作用的强弱,若曲面较平缓,说明两因素交互作用不显著,若曲面较陡,则表示两因素交互作用显著[12]。
从以上时间-温度等高线图可以看出,等高线的形状为椭圆形,表示时间、温度两个因素的交互作用显著,从时间-温度响应曲面图可以看出,随着C(酶解时间)、B(酶解温度)的增加,葡萄籽蛋白的水解度有明显的变化趋势,最佳的酶解时间和酶解温度都在一个范围内,酶解温度越高、酶解时间越长,葡萄籽蛋白的水解度都有所下降,所以,酶解温度和酶解时间对葡萄籽蛋白的水解度有所影响。

图10 时间-pH等高线图Fig.10 Time-pH contour map

图11 时间-pH响应曲面图Fig.11 Time-pH response surface map
从以上温度-pH值等高线图的形状(椭圆)可以看出,酶解温度和酶解pH值两个因素的交互作用显著,从温度-pH值的响应曲面图可以看出,随着pH值和酶解温度的增加,葡萄籽蛋白的水解度有明显的变化,表现为曲面变陡,因此,酶解温度与酶解pH值对葡萄籽多肽的提取有极其显著的效果。
从以上时间-pH值等高线图的形状(椭圆)可以看出,酶解时间、酶解pH值两个因素的交互作用显著,从时间-pH响应曲面图可以看出随着A(酶解时间)、C(酶解pH值)的增加,葡萄籽蛋白的水解度有明显的变化,表现为曲面变得较陡,因此,酶解温度与酶解pH值对提取效果的影响较显著。
2.4 最佳工艺的确定及验证试验
对二次多项回归方程求偏导得最优工艺组合为酶添加量为2%、酶解温度50.47℃,酶解时间3.61 h,酶解pH7.39,预测响应值为24.47%。为检验响应面法(response surface method,RSM)法的可靠性,采用最优工艺组合进行试验证明,基于试验操作的可行性,选取酶添加量为2%、酶解温度50℃、酶解pH7.4、酶解时间3 h,得到的响应值为24.33%,是理论值的95.34%,十分接近预测响应值,符合要求[19-20]。
2.5 葡萄籽蛋白酶解产物抑制油脂氧化活性的结果分析
不同浓度葡萄籽蛋白酶解物对葵花籽油过氧化值的影响见图12。

图12 不同浓度葡萄籽蛋白酶解物对葵花籽油过氧化值的影响Fig.12 Effect of different concentrations of grape seed protein hydrolysate on peroxide value of sunflower oil
由图12明显看出,葡萄籽蛋白酶解物对葵花籽油氧化的抑制作用随着浓度增大而增强,第8天添加0.15%葡萄籽提取物的葵花籽油过氧化值明显增高,综合考虑,遵循经济原则,葡萄籽提取物用量为0.15%时抗氧化效果较好。
不同抗氧化剂对葵花籽油过氧化值的影响见图13。

图13 不同抗氧化剂对葵花籽油过氧化值的影响Fig.13 Effect of different antioxidants on peroxide value of sunflower oil
由图13可知,葡萄籽蛋白酶解物和所选抗氧化剂对葵花籽油的氧化均有抑制作用,在抗氧化剂浓度都为0.15%时,葡萄籽蛋白酶解物与VC、VE相比对葵花籽油过氧化值的影响较大,抗氧化效果更好。
2.6 葡萄籽酶解物清除自由基的能力
质量浓度与DPPH自由基清除率的关系见图14。

图14 质量浓度与DPPH自由基清除率的关系Fig.14 The relationship between DPPH free radical scavenging rate and mass concentration
由图14可知,葡萄籽蛋白复合蛋白酶酶解物对清除DPPH 自由基有一定的作用,在120 μg/mL~600 μg/mL的质量浓度范围内,其清除DPPH自由基的能力为19.25%~41.03%,并且葡萄籽蛋白复合酶酶解物对清除自由基的能力随着其浓度的增加而增强。
3 结论
以晒干的葡萄籽为原料,用复合酶解法提高了葡萄籽多肽的提取得率,与VC、VE相比,葡萄籽多肽用量为0.15%时抗氧化效果较好,对自由基也有一定的清除作用,因此可以将其作为抗氧化剂在食品生产中得到广泛应用。

