miR-422a通过调控SOX6抑制H2O2对PC12细胞的损伤*
张广华, 铁婷婷, 巨 虎, 许常林, 肖宗宇△, 苑 乐
(青海大学附属医院 1神经外科, 2神经内科, 3教学管理部, 青海 西宁 810001)
缺血诱导的神经损伤等是临床上常见的引发神经功能障碍的重要因素之一,其严重威胁着人类的生命健康[1]。缺血可以诱发神经组织中细胞发生级联反应,从而促进组织中的细胞凋亡,使得组织中的细胞之间信号传递受到阻碍,诱发患者残疾或死亡[2]。研究显示,氧化应激是引发神经细胞损伤发生的重要原因,减轻神经细胞氧化损伤是目前急需解决的问题[3]。微小RNA(microRNA, miRNA, miR)是近年来新发现的非编码RNA分子,可以通过与特定的mRNA分子相结合而调控基因的表达,在神经生长、细胞凋亡和脂肪代谢等过程中发挥广泛的生物学作用,是生物体发育及细胞分化过程中重要且功能广泛的调控因子[4-6]。近年来miRNA在神经损伤中的作用越来越受到广泛关注,其可以通过调控下游靶基因的表达而发挥生物学作用[7]。miR-422a是一个在人体组织生理和病理过程中均有调控作用的miRNA分子,参与细胞生长和凋亡等过程,miR-422a在过氧化氢(hydrogen peroxide,H2O2)刺激的神经细胞中表达下降,并且其表达水平的高低与细胞凋亡程度呈负相关[8]。性别决定区Y框6(sex-determining region Y box 6, SOX6)在人体组织中广泛表达,SOX6在缺氧诱导的神经损伤中发挥促进作用[9]。我们前期的预实验发现SOX6可能是miR-422a的靶基因,本次的实验探讨miR-422a在H2O2诱导的大鼠肾上腺嗜铬细胞瘤细胞株PC12(具有神经细胞特性)损伤中的作用和机制,为明确氧化应激诱导的神经细胞损伤机制提供参考。
材 料 和 方 法
1 材料
大鼠肾上腺嗜铬细胞瘤细胞株PC12购自ATCC。乳酸脱氢酶(lactate dehydrogenase,LDH)含量测定试剂盒购自北京索莱宝生物科技有限公司;cDNA合成试剂盒和real-time PCR试剂盒均购自宝生物工程(大连)有限公司;引物由生工生物工程(上海)股份有限公司合成;H2O2购自Sigma;Annexin V-FITC/PI细胞凋亡检测试剂盒购自上海碧云天生物技术有限公司;mimics control和miR-422a mimics由上海吉凯基因化学技术有限公司合成;阴性对照载体(pcDNA3.1)和SOX6过表达载体(pcDNA3.1-SOX6)由广州辉骏生物科技有限公司构建;萤光素酶报告基因载体由南京钟鼎生物技术有限公司构建;Lipofectamine 2000和TRIzol试剂购自Invitrogen。
2 方法
2.1real-time PCR法测定H2O2处理后PC12细胞中miR-422a的表达 用含H2O2(浓度为0和300 μmol/L)的细胞培养液培养PC12细胞,分别记为对照(control)组和H2O2组,细胞培养12 h以后,用real-time PCR法测定miR-422a表达水平。收集细胞,在细胞中添加TRIzol试剂,提取各组细胞中的总RNA,然后用紫外分光光度计检测A260/A280的比值,提取的RNAA260/A280的比值在1.8~2.0之间,可用于后续实验。使用cDNA合成试剂盒反转录,然后以U6作为内参照,进行PCR扩增,PCR条件为:95℃预变性2 min;92 ℃变性10 s、58 ℃退火30 s,共40个循环。U6的上游引物序列为5’-CTCGCTTCGGCAGCACA-3’,下游引物序列为5’-AACGCTTCACGGAATTTGCGT-3’;miR-422a的上游引物序列为5’-GGGACTGGACTTAGGGTCA-3’, 下游引物序列为5’-GTGCGTGTCGTGGAGTCG-3’。
2.2细胞转染和分组 PC12细胞分成4组,依次为control组、H2O2组、miR-NC+H2O2组和miR-422a+H2O2组。control组和H2O2组的处理方法同2.1。miR-NC+H2O2组和miR-422a+H2O2组分别为转染mimics control和miR-422a mimics后的PC12细胞,用含有H2O2浓度为300 μmol/L的细胞培养液培养。细胞转染用Lipofectamine 2000,转染步骤同转染试剂说明书。细胞培养12 h以后,用real-time PCR方法检测H2O2、miR-NC+H2O2组和miR-422a+H2O2组的细胞中miR-422a的表达水平,评估转染miR-422a mimics对H2O2刺激下PC12细胞中miR-422a水平的影响,步骤同2.1。
2.3MTT法测定细胞活力 按照control、H2O2、miR-NC+H2O2、miR-422a+H2O2分组将细胞种植到96孔板中,放置在37 ℃、5% CO2培养箱中培养,培养12 h以后,将培养板取出,在每个孔中依次添加10 μL的MTT溶液(5 g/L),放在培养箱中培养4 h以后,取出培养板,将孔内的的液体吸弃,加入150 μL的DMSO溶液,震荡反应10 min,在酶标仪上检测每个孔的A值,经过空白孔调零以后,计算细胞存活率。
2.4LDH漏出率的检测 将control、H2O2、miR-NC+H2O2和miR-422a+H2O2各组细胞培养12 h后,分别收集培养液上清和细胞,使用试剂盒检测LDH含量,计算上清和细胞中总LDH含量,以上清中LDH含量与总LDH含量的百分比作为LDH漏出率。LDH检测步骤同试剂盒说明。
2.5流式细胞术测定细胞凋亡 将control、H2O2、miR-NC+H2O2、miR-422a+H2O2各组细胞培养12 h后收集细胞,用结合缓冲液将细胞悬浮以后,添加10 μL的Annexin V-FITC染色液混合以后,再加入5 μL的PI染液,用流式细胞术测定细胞凋亡情况。
2.6miR-422a靶基因的预测及鉴定 使用靶基因预测软件TargetScan预测miR-422a的靶基因,miR-422a与SOX6的3’UTR端有互补结合位点,将SOX6的互补结合位点突变,构建突变型萤光素酶报告基因载体(MUT),同时构建野生型萤光素酶报告基因载体(WT),将MUT和WT分别同mimics control和miR-422a mimics共转染到PC12细胞中,培养48 h以后,检测萤光素酶活性的变化。
2.7Western blot检测SOX6蛋白的表达 将control、H2O2、miR-NC+H2O2和miR-422a+H2O2各组细胞培养12 h后,收集细胞,用蛋白裂解试剂分别提取总蛋白,收集的蛋白液同SDS-PAGE上样缓冲液充分混合,置于100 ℃条件下煮沸5 min。蛋白电泳时,在每个上样孔内分别添加30 μg样品,浓缩胶中80 V,分离胶中120 V,等到溴酚蓝染料已经进入到玻璃板的底部以后,停止电泳。设置300 mA电流转膜,把浓缩胶中的蛋白转移到大小合适的NC膜上,转膜共120 min。取出NC膜,然后放置在5%脱脂奶粉TBST封闭液内,震荡孵育1h。把NC膜置于含有 I 抗稀释液中的抗体孵育袋中,放在4 ℃条件下过夜。然后取出NC膜,放在1∶4 000稀释后的 II 抗稀释液内,在室温条件下孵育2 h。使用ECL化学发光,软件Quantity one分析条带灰度值。GAPDH为内参照。分析蛋白表达水平。
2.8SOX6过表达对细胞活力、凋亡和LDH漏出的影响 在PC12细胞中分别共转染miR-422a mimics、SOX6过表达载体和miR-422a mimics对照载体,使用H2O2浓度为300 μmol/L的细胞培养液培养,记为miR-422a+H2O2+SOX6组和miR-422a+H2O2+vector组。细胞培养12 h以后,检测细胞活力、LDH漏出率和细胞凋亡,步骤同上。
3 统计学处理
实验数据用SPSS 21.0分析,实验数据用均数±标准差(mean±SD)表示,两组数据间比较用t检验,多组差异比较用单因素方差,各组均数间的两两比较用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 H2O2诱导PC12细胞中miR-422a表达下调
PC12细胞经过H2O2处理以后,与对照组相比,细胞中的miR-422a水平下降(P<0.01),见图1。
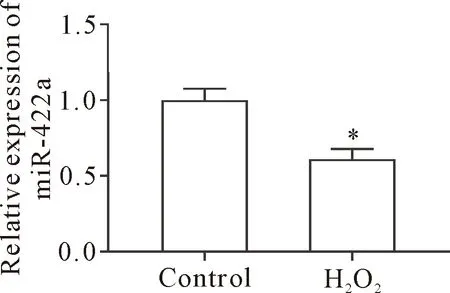
Figure 1.The expression of miR-422a in the PC12 cells before and after H2O2 treatment. Mean±SD. n=3. *P<0.05 vs control group.
2 miR-422a mimics提高H2O2刺激下PC12细胞中miR-422a的水平
在PC12细胞中转染miR-422a mimics,经过H2O2诱导处理以后,细胞中的miR-422a水平显著上调(P<0.05)。miR-422a mimics提高H2O2刺激下PC12细胞中miR-422a水平,见图2。

Figure 2.The expression of miR-422a in the PC12 treated with H2O2 and transfected with miR-422a mimics. Mean±SD. n=3. *P<0.05 vs miR-NC+H2O2 group.
3 miR-422a对H2O2刺激下PC12细胞凋亡、LDH漏出和细胞活力的影响
PC12细胞经过H2O2诱导处理以后,细胞凋亡率升高,细胞LDH漏出率也升高,细胞活力下降。在PC12细胞中转染miR-422a mimics,在同样条件下经过H2O2诱导处理以后,细胞凋亡率下降,LDH漏出率也下降,细胞活力升高(P<0.05),见图3。这说明miR-422a抑制H2O2诱导的PC12细胞凋亡和LDH漏出,提高细胞活力。
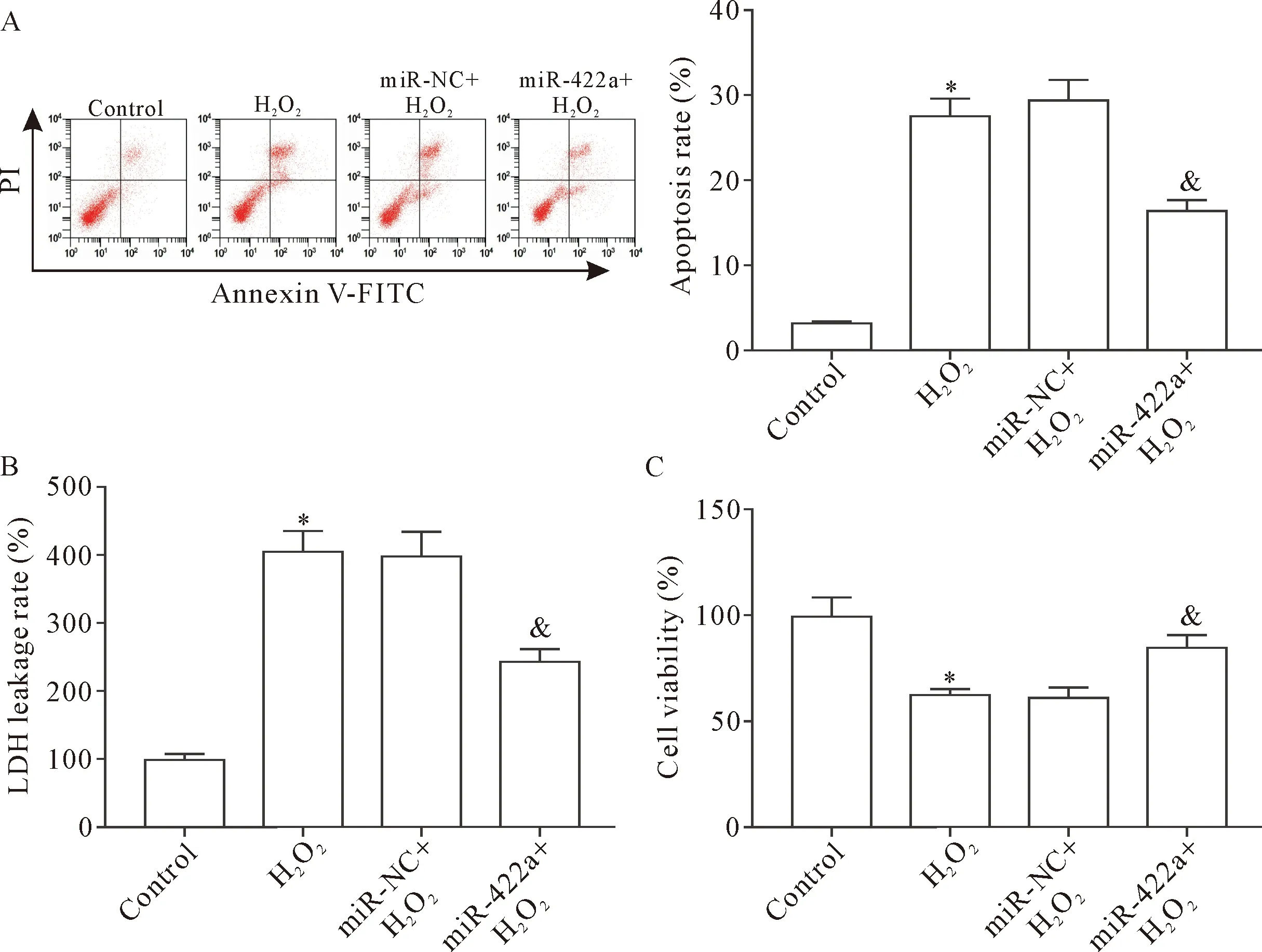
Figure 3.The effects of miR-422a on the apoptosis, LDH leakage and viability of PC12 cells treated with H2O2. A: the results of flow cytometry for analyzing the apoptotic rate of PC12 cells treated with H2O2; B: the cell LDH leakage rate; C: the cell viability was detected by MTT assay. Mean±SD. n=3. *P<0.05 vs control group; &P<0.05 vs miR-NC+H2O2 group.
4 miR-422a靶向调控SOX6
经过靶基因在线预测软件发现miR-422a与SOX6的3’UTR有互补结合位点,见图4A;萤光素酶报告基因实验结果显示,WT和miR-422a mimics共转染后细胞萤光素酶活性降低(P<0.05),见图4B。这说明miR-422a靶向调控SOX6。
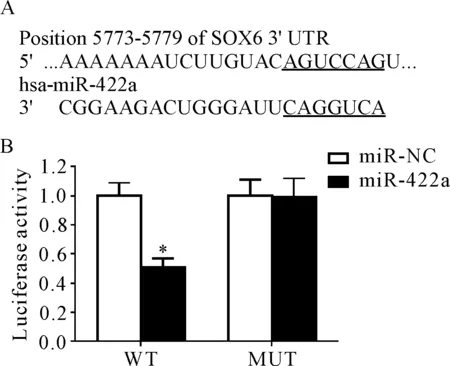
Figure 4.miR-422a targeted and regulated SOX6. A: bioinformatics software predicted the complementary binding sites between miR-422a and SOX6 3’UTR; B: luci-ferase activity changes. Mean±SD. n=3. *P<0.05 vs miR-NC group.
5 miR-422a负调控SOX6蛋白表达
PC12细胞经过H2O2诱导处理以后,细胞中SOX6蛋白水平升高。在PC12细胞中转染miR-422a mimics,经过H2O2诱导处理以后,细胞中SOX6蛋白水平降低(P<0.05),提示miR-422a抑制H2O2诱导的PC12细胞中SOX6蛋白表达,见图5。

Figure 5.miR-422a reduced SOX6 expression in the PC12 cells treated with H2O2. Mean±SD. n=3. *P<0.05 vs control group; &P<0.05 vs miR-NC+H2O2 group.
6 SOX6过表达载体逆转过表达miR-422a对H2O2处理后PC12细胞凋亡、LDH漏出和细胞活力的影响
在PC12细胞中共转染SOX6过表达载体和miR-422a mimics,细胞中的SOX6蛋白水平升高,细胞凋亡率升高,LDH漏出率也升高,细胞活力降低,与共转染对照载体和miR-422a mimics的细胞比较,差异有统计学意义(P<0.05),见图6和表1。

Figure 6.Reversal effect of SOX6 over-expression vector on inhibition of SOX6 protein expression and apoptosis by miR-422a overexpression in the PC12 cells treated with H2O2. A: the images of Western blot for determining the SOX6 protein level in the PC12 cells transfected with SOX6 over-expression vector; B: the images of flow cytometry for analyzing the apoptosis of the PC12 cells transfected with SOX6 over-expression vector.

表1 SOX6过表达逆转过表达miR-422a对H2O2处理后PC12细胞凋亡、LDH漏出率和细胞活力的作用Table 1.The effects of SOX6 over-expression on apoptotic rate, LDH leakage and viability of PC12 cells under H2O2 exposure and transfected with miR-422a mimics (Mean±SD. n=3)
讨 论
神经细胞氧化损伤是引发神经相关疾病发生的重要原因,神经细胞受到氧化应激的刺激以后,细胞过度凋亡,导致原来完整的神经结构和功能受到破坏[10]。PC12细胞是一种形态、结构等功能同神经元极为相似的细胞株,被广泛应用于神经细胞功能的研究中[11]。H2O2是体内氧化应激反应的产物,其极易扩散,参与细胞凋亡、增殖等多种生理及生化过程,H2O2被广泛应用于研究氧化应激诱导的神经损伤模型[12-13]。我们的实验发现,用H2O2处理PC12细胞,其活力降低,细胞LDH漏出率升高,细胞凋亡增加,说明H2O2处理可以诱导PC12细胞损伤,构建了氧化应激损伤模型。
miR-422a是目前已经发现的与细胞生物学作用有关的调节因子,在肿瘤中的研究较为广泛,能够通过影响肿瘤细胞的增殖、分化等调控肿瘤进展[14-16]。之前的研究报道显示,miR-422a在神经细胞氧化损伤模型中表达下降[8]。我们的实验同样发现H2O2处理后的PC12细胞中miR-422a表达水平降低,并且上调其表达后可以减少H2O2诱导的细胞损伤,这为研究miR-422a在神经细胞损伤中的作用提供了参考。
很多研究报道显示,miRNA分子调控机制与靶向影响下游蛋白的表达有关,并且这种调控作用大多数为负调控作用[17-19]。SOX6是一个具有广泛作用的调控基因,在肿瘤、软骨分化和缺氧诱导的神经损伤等过程中均有重要功能[9, 20-21]。研究显示,SOX6参与缺氧诱导的神经细胞凋亡过程,在神经损伤中可能发挥促进作用,下调SOX6发挥抗神经细胞损伤作用[9]。我们的实验发现,miR-422a靶向调控SOX6,并且过氧化氢处理后的神经细胞中SOX6蛋白水平升高,而上调SOX6可以逆转miR-422a对H2O2诱导的神经细胞损伤的抑制作用,这说明miR-422a可靶向抑制SOX6表达以发挥保护H2O2神经细胞损伤的作用,这与上述SOX6在神经细胞损伤中的作用一致。
综上所述,miR-422a参与H2O2诱导的神经损伤过程,且可以作用于靶基因SOX6而发挥作用,这为研究miR-422a在神经损伤中的作用和调控网络提供了参考,为研究神经损伤分子发生机制提供了参考依据。我们的实验只在PC12细胞中进行了体外实验,没有在原代神经细胞和体内进行验证,在后续实验中会对上述部分进行探讨,以期为阐明miR-422a分子调控机制提供参考资料。

