琼玉膏对胰腺癌小鼠化疗增效减毒作用研究*
刘 丽, 刘大晟, 李震东, 李接兴, 吴先林
(1暨南大学附属第一医院校门诊部, 广东 广州 510632; 2广东省中医院血管甲状腺科, 广东 广州 510120;暨南大学附属第一医院 3肝胆外科, 4中西医结合胰腺病诊治中心, 5中心实验室, 广东 广州 510632)
胰腺癌的5年生存率仅为5%,发病率与死亡率非常接近[1-2]。目前,治疗胰腺癌的主要方法是早期诊断手术治疗,但即使是切缘阴性、无淋巴结转移的患者,术后仍可能出现复发或转移,最常见的是肝转移等远处转移,且80%的胰腺癌患者确诊时已失去手术切除的时机。吉西他滨(gemcitabine)是近20年来胰腺癌化疗的代表药物,然而其可能带来的严重毒副作用,足以抵消其治疗效果,且总体生存率几乎没有改善[2]。其它治疗如放疗、内镜治疗及生物治疗等,各有其局限性,给胰腺癌的治疗带来了困境。因此,寻找能够更有效地治疗胰腺癌或改善吉西他滨毒副作用的联合辅助治疗药物具有重要的意义。
因胰腺特殊的解剖部位和独特的生理功能,胰腺癌相当于中医学“癥瘕”、“积聚”和“黄疸”等病症。中医对于胰腺癌的治疗进行了长期的临床实践,观察到患者在表现为气阴亏虚、脾虚气滞等证候,治疗上宜采用“益气养阴”法为主[3]。琼玉膏(Qiangyugao)是“益气养阴”代表方,并可健脾养血。前期的研究表明,琼玉膏能增强化疗药物抑制肺癌细胞增殖、促进肺癌细胞凋亡的作用,可改善肺癌化疗后小鼠的骨髓抑制情况,减缓肿瘤的生长,并能抑制HbxAg的表达,防治原发性肝癌,有可能成为一种能应用于临床抗肿瘤的辅助用药[4-6]。本项工作建立胰腺癌小鼠移植瘤模型,观察琼玉膏对胰腺癌小鼠吉西他滨化疗的增效减毒作用,并探讨其可能的作用机制。
材 料 和 方 法
1 动物与分组
SPF级C57BL/6小鼠50 只,6~8周龄,雌雄各半,体质量 (20±2)g,购自广东医学实验动物中心,动物合格证编号为SCXK(粤)2017-0012,常规饲养于暨南大学动物实验中心。将小鼠随机分为5组,每组雌雄各半,即正常(normal)组、模型(model)组、吉西他滨治疗(gemcitabine)组、琼玉膏治疗(Qiongyugao)组和联合治疗(combination)组,每组10 只。
2 药品制备
琼玉膏由本课题组自行配制,生地黄,茯苓和人参 (批号依次为:HX18ED1,HX18C01和HX18B01,广东和翔制药有限公司;蜂蜜 (批号:GB14963,北京同仁堂有限公司)。取生地黄 500 g、茯苓100 g、人参50 g,文火水提 2次,每次2 h,合并滤液,静置后取上清液,水浴浓缩为相对密度 1.21~1.25的原液1 000 mL 备用;蜂蜜350 mL炼至中蜜,取原液 1 000 mL加入炼蜜 350 mL,继续浓缩至1 000 mL,收膏过滤,于80 ℃测比重为 1.40 kg/L,即成琼玉膏。吉西他滨每支200 mg (批号:180707),由江苏豪森药业股份有限公司生产,购于暨南大学附属第一医院西药房,使用前每支予以生理盐水10 mL稀释。
3 细胞、主要试剂与仪器
胰腺癌Panc02细胞购自ATCC(American Type Culture Collection)。胎牛血清及DMEM 细胞培养液购自Gibco;糖链抗原19-9(carbohydrate antigen 19-9,CA19-9)和癌胚抗原(carcinoembryonic antigen,CEA)的酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)试剂盒购自欣博盛生物科技有限公司;流式检测试剂盒购自BD;Ficoll-Paque淋巴细胞分离液购自GE。全自动血细胞分析仪购自迈瑞公司。
4 方法
4.1瘤液制备和模型建立 胰腺癌Panc02细胞采用含10%胎牛血清的DMEM细胞培养液于37 ℃、5% CO2的恒温培养箱中传代培养,取生长良好的细胞用胰酶消化制成单细胞悬液,将细胞密度调至1×1010/L,取0.2 mL单细胞悬液,皮下接种于模型组和各治疗组小鼠腋窝处,建立胰腺癌小鼠移植瘤模型;对照组小鼠予以生理盐水0.2 mL皮下接种于腋窝处。
4.2给药方法 造模14 d后,模拟临床胰腺癌患者给药方式,吉西他滨组予以吉西他滨腹腔注射,每天2次,剂量为100 mg·kg-1·d-1;琼玉膏组予以琼玉膏灌胃治疗,每天2次,剂量为 14 g·kg-1·d-1;联合治疗组参考吉西他滨组和琼玉膏组给药方法,同时予以琼玉膏和吉西他滨治疗;对照组和模型组参考联合治疗组的给药方法,分别予以等量生理盐水腹腔注射和灌胃,以上各组均连续给药干预21 d。
4.3取材与指标检测 小鼠造模后,每5 d测量一次肿瘤大小并绘制瘤体体积变化图。治疗21 d后,无菌条件下摘眼球取血0.8~1 mL后处死小鼠,取胰腺和腋窝下瘤体组织,瘤体组织称重。
血常规检测:取各组小鼠血液,应用全自动血细胞分析仪 (型号BC-5390)通过电阻抗法检测白细胞(white blood cell,WBC)、红细胞 (red blood cell,RBC)和血小板 (platelet,PLT)计数及血红蛋白 (hemoglobin,HGB)含量。
ELISA检测:将肿瘤组织取下后充分研磨,4 ℃、1 800×g离心15 min,取上清,采用ELISA法检测样本中CEA及CA19-9水平,于酶标仪上读取样品各孔的吸光度(A)值,由标准曲线计算其浓度。
流式细胞学检测:将各组小鼠血液用等量生理盐水稀释后铺加于Ficoll-Paque淋巴细胞分离液的液面上并进行离心,分层后吸取外周血单个核细胞(peripheral blood mononuclear cell, PBMC),洗涤后重悬于相应的培养液中。将培养足够时间的PBMC从培养箱中取出,细胞原液调整为每100 μL含约106个细胞,加入针对CD4细胞表面抗原的anti-mouse CD4单克隆抗体染色,细胞固定和破膜后,加入1 mL的Perm/Wash buffer冲洗淋巴细胞,配成终体积为100 μL的淋巴细胞液,在其中分别加入所需检测的单克隆抗体anti-mouse IFN-γ、anti-mouse IL-4 APC、anti-mouse IL-17APE和anti-mouse Foxp3 APC,然后在4 ℃环境下避光孵育30 min,涡旋混合均匀,使用1 mL PBS进行洗涤,离心后加入200 μL PBS,重悬待测,流式细胞仪计数。
5 统计学处理
采用GraphPad Prism 5软件对数据进行分析,所有数据以均数±标准差(mean±SD)表示。瘤体曲线的组间比较采用双因素方差分析(two-way ANOVA),其它指标的组间比较采用单因素方差分析(one-way ANOVA),以P<0.05为差异有统计学意义。
结 果
1 小鼠瘤体体积
模型组和各治疗组小鼠皮下接种Panc02细胞后,瘤体不断增长(P<0.01)。给予药物治疗后,与模型组比较,3个治疗组小鼠瘤体增长缓慢,(P<0.05,P<0.05),见图1。
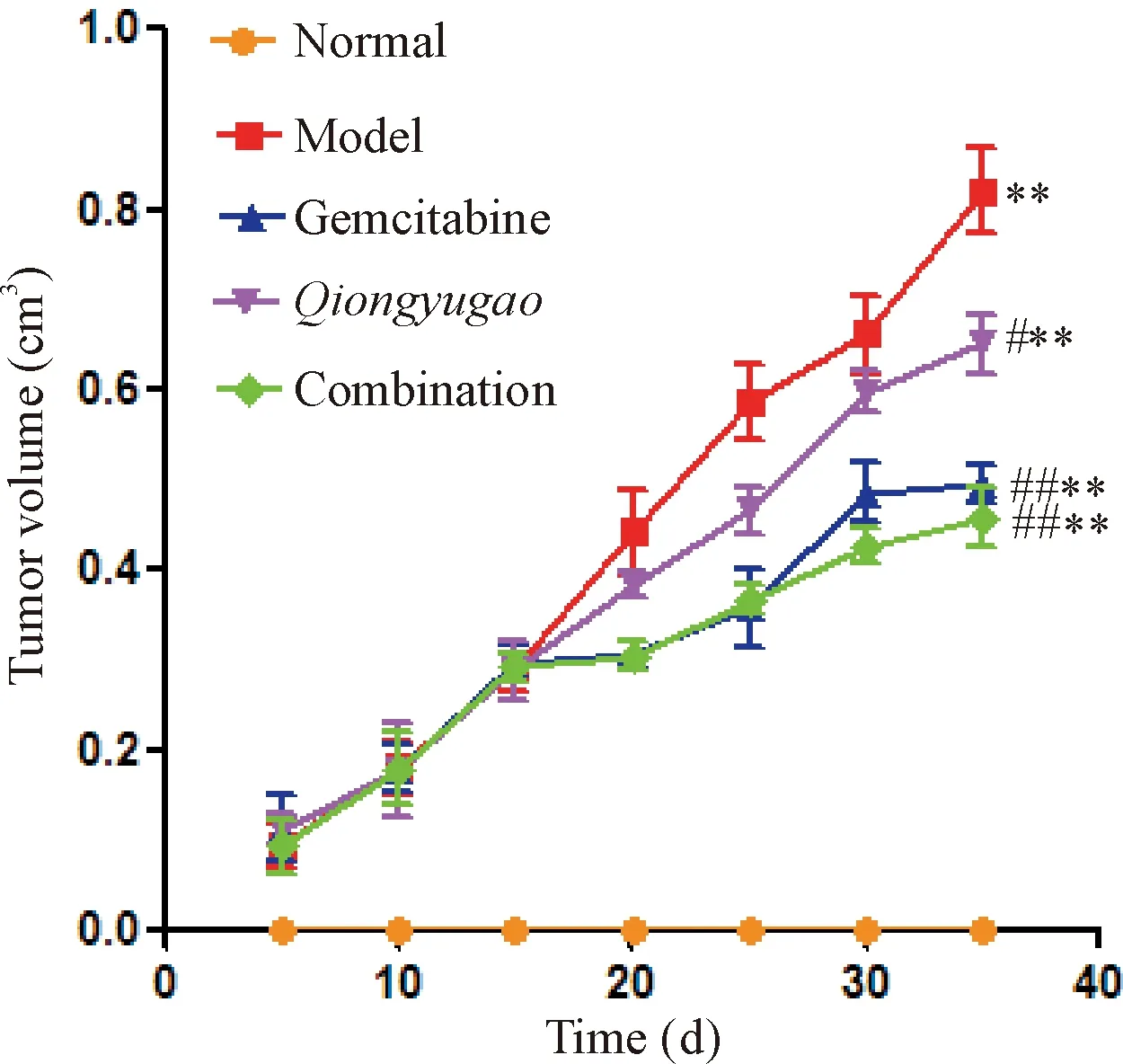
Figure 1.Tumor growth curve of mice in each group after modeling. Mean±SD. n=10.**P<0.01 vs normal group; #P<0.05, ## P<0.01 vs model group.
2 小鼠的体重和瘤重
小鼠成瘤后的整体观察及剥离后的瘤体照片如图2所示。造模后,小鼠体重较正常组均有下降;治疗21 d后,吉西他滨治疗组小鼠体重下降趋势最为显著,与模型组比较有统计学差异 (P<0.05),见图3A。模型组小鼠瘤重水平较正常组显著升高 (P<0.01);模型组小鼠瘤重水平与琼玉膏治疗组比较无统计学差异(P>0.05),与其它2个治疗组比较,差异显著(P<0.01),见图3B。
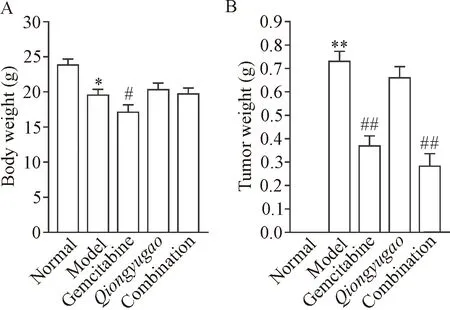
Figure 3.Comparison of body weight (A) and tumor weight (B) of mice in each group. Mean ± SD. n=10. *P<0.05,**P<0.01 vs normal group; #P<0.05, ## P<0.01 vs model group.
3 血常规
治疗21 d后,模型组小鼠WBC、RBC和PLT计数及 HGB含量与正常组比较均有显著下降 (P<0.01);与模型组比较,吉西他滨治疗组小鼠的WBC、RBC和PLT计数及HGB含量均下降(P<0.05,P<0.01);琼玉膏治疗组小鼠的WBC、RBC和PLT计数及HGB含量均有升高,其中WBC和HGB的比较具有统计学差异(P<0.05);联合治疗组小鼠的HGB含量显著升高(P<0.01),见图4。

Figure 4.Comparison of blood routines of mice in each group. A: comparison of WBC counts; B: comparison of HGB contents; C: comparison of RBC counts; D: comparison of PLT contents. Mean±SD. n=10.**P<0.01 vs normal group; #P<0.05,## P<0.01 vs model group.
4 ELISA检测血清肿瘤标志物
与正常组相比,模型组小鼠血清的CA19-9和CEA浓度显著升高 (P<0.01);治疗后,与模型组相比,3个治疗组的CA19-9和CEA浓度均有下降 (P<0.05),以吉西他滨治疗组和联合治疗组表现较为显著(P<0.01),见图5。
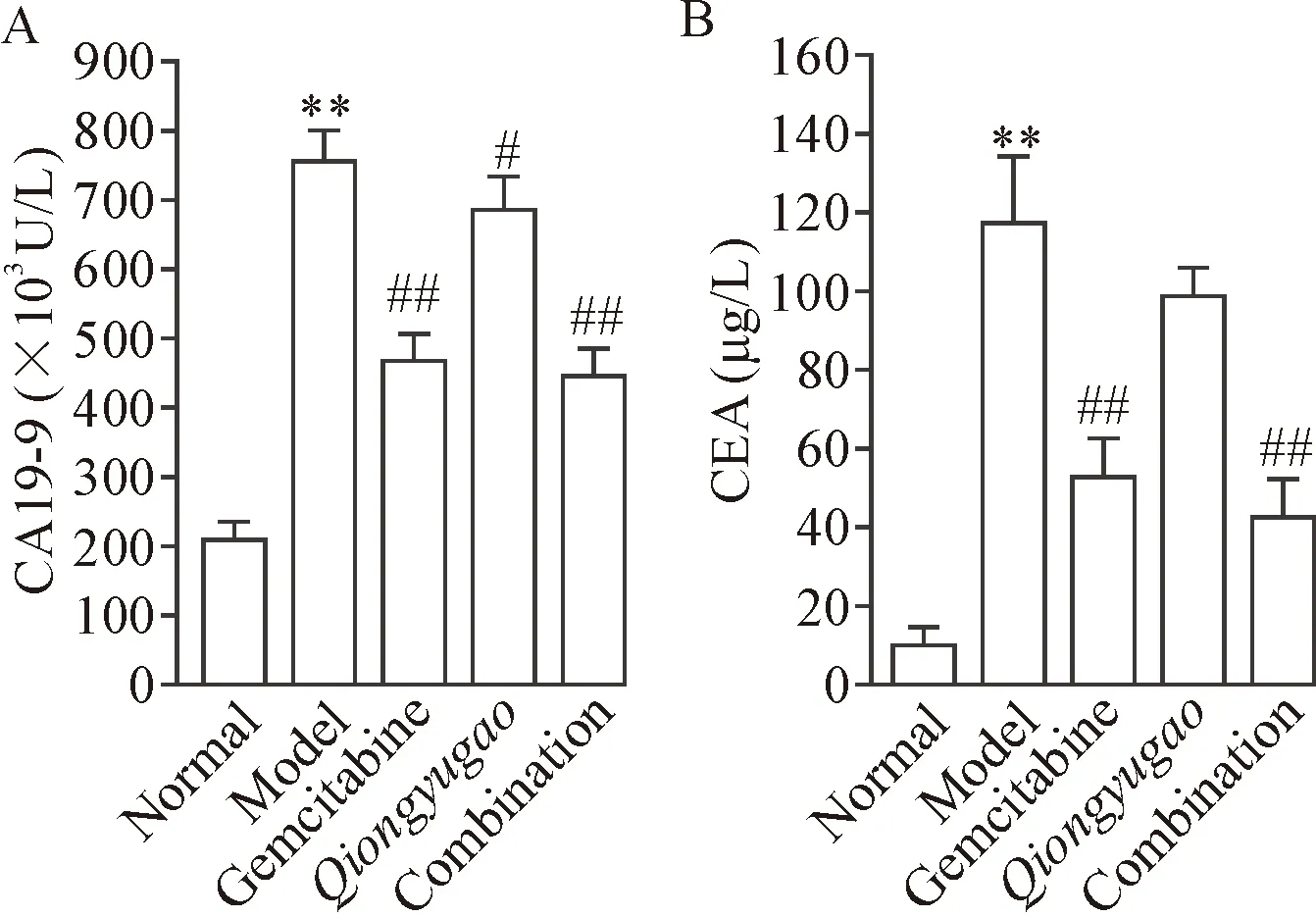
Figure 5.Comparison of tumor markers of mice in each group. Mean±SD. n=10. **P<0.01 vs normal group; #P<0.05, ## P<0.01 vs model group.
5 流式细胞术检测小鼠外周Th1/Th2和Th17/Treg的表达
胰腺癌小鼠造模后,Th1和Th17细胞的阳性表达率升高,而Th2和Treg细胞阳性表达率降低。与空白组相比,模型组小鼠的Th1/Th2和Th17/Treg比例显著上升(P<0.01);给予药物干预后,琼玉膏治疗组和联合治疗组Th1/Th2和Th17/Treg比例较模型组比较均显著下降(P<0.01);给予吉西他滨治疗后,与模型组相比,小鼠的Th1、Th2、Th17和Treg阳性表达率被抑制。吉西他滨治疗组Th1/Th2比值较模型组显著降低(P<0.01),Th17/Treg比值较模型组显著升高(P<0.01),见图6。

Figure 6.Comparison of Th1/Th2 and Th17/Treg of mice in each group. Mean±SD. n=10. **P<0.01 vs normal group; ##P<0.01 vs model group.
讨 论
吉西他滨是一种胞嘧啶核苷衍生物,通过抑制核糖核苷酸还原酶和竞争性插入 DNA 链中脱氧胞苷的位点导致 DNA 链断裂,使细胞阻滞在G1/S期,并诱导细胞凋亡而发挥抗肿瘤作用,但有明显的骨髓抑制作用。本研究表明,吉西他滨干预组小鼠瘤体大小及肿瘤标志物的表达较模型组显著降低,且小鼠血细胞计数显著减少。尽管吉西他滨化疗是晚期胰腺癌的主要治疗方法,其作为胰腺癌患者的化疗药物被批准主要是因为疾病相关症状的改善,但其骨髓抑制等副作用也不可忽视[7-9]。研究表明,将化疗药物与中药联合治疗能降低化疗药物的毒副反应,并提高化疗药物的疗效[10-12]。本研究通过对胰腺癌小鼠模型分别给予吉西他滨、琼玉膏和吉西他滨联合琼玉膏治疗,结果显示琼玉膏可减缓瘤体的增长,降低肿瘤标志物的表达,增加WBC、RBC和PLT计数及HGB含量,并可降低Th1/Th2和Th17/Treg比例,从而发挥其免疫调控作用。
中医理论认为,胰腺癌的发生是脏腑气血阴阳失调,正气虚损,外邪内侵,积渐而成。而胰腺癌患者化疗后,更易出现神疲乏力、腹痛纳差、气短口干等气阴两亏、脾虚气滞之证。本实验中琼玉膏由人参、生地黄、茯苓和蜂蜜四药相伍而成。方中生地黄益气滋阴,人参健脾养血、扶正祛邪,茯苓健脾除湿行气,蜂蜜味甘性润,四药合用有补有通,有开有阖,补而不滞,滋而不腻,补阴而不忘扶阳,益气而不忘育阴养血,共奏调节气血阴阳平衡之效。机体阴阳平衡,则正胜邪退,疾病向愈,机体免疫功能恢复,T细胞亚群比例平衡。有研究显示,琼玉膏中四味药均可调节T细胞亚群平衡,显著改变Th17/Treg细胞的计数和比例[13-14],并可通过增加CD4+和CD8+T细胞比率,调节T细胞平衡[15-16]。
T细胞亚群是肿瘤免疫的重要组成部分。Th1/Th2和Th17/Treg等互相拮抗,处于动态平衡,调节机体免疫。近年来研究表明,Th1细胞被认为是参与肿瘤免疫激活的主要细胞群;Th2细胞为肿瘤免疫逃逸提供重要条件,能阻滞Th1类细胞介导的肿瘤免疫应答[17];Th17细胞在肿瘤免疫中可能具有双重作用,一方面可能促进肿瘤血管生长和细胞增殖,另一方面又通过介导免疫反应等发挥抗肿瘤作用[18];Treg细胞作为淋巴细胞亚群在肿瘤进展中可抑制免疫反应,发挥维持机体免疫稳态和介导外周耐受的关键作用[19]。
本研究证实,尽管琼玉膏单独治疗胰腺癌的疗效较弱,对瘤体的抑制及肿瘤标志物的下调不如吉西他滨治疗组显著,但琼玉膏与吉西他滨联合用药的情况下,能通过降低Th1/Th2和Th17/Treg比例来调节T细胞亚群平衡,增加WBC、RBC和PLT计数和HGB含量,对吉西他滨的化疗起到增效减毒的作用。因此,我们推测琼玉膏可通过诱导CD4+T 细胞分化调控Th1/Th2和Th17/Treg的比值来调节T细胞亚群平衡,并增加WBC、RBC和PLT计数和HGB含量,降低肿瘤标志物水平,减缓瘤体的增长,从而减缓胰腺癌的发展。

