转录辅激活因子和乙酰基转移酶p300在心脏成纤维细胞衰老相关纤维化中的作用*
高小燕, 李 昕, 韦鉴钦, Nanette Hahr BISHOPRIC, 王钊煜, 周慧珊, 饶 芳△, 邓春玉
(1华南理工大学医学院, 广东 广州 510006; 2广东省心血管病研究所心内科, 广东省人民医院医学研究部,广东省医学科学院, 广东 广州 510080; 3迈阿密大学米勒医学院, 分子心脏病学及分子和细胞药理学系, 美国 佛罗里达州 迈阿密 33101)
房颤(atrial fibrillation,AF)是临床最常见的心律失常之一,其发病率随着年龄的增长而增加。随着人口的老龄化,我国AF的发病率逐年增加,探索衰老在AF发病中的机制显得尤为重要。结构重塑是AF发生的主要病理机制之一,而心房扩大和纤维化是AF结构重塑的主要表现[1],心房纤维化可使心房传导发生异常,从而产生心房折返通路诱发 AF[2]。研究者发现与老年患者相比,年轻患者左房纤维化更少。年老组患者左房基质金属蛋白酶2/9(matrix metalloproteinase-2/-9, MMP-2/9)活性明显升高,而金属蛋白酶组织抑制剂物(tissue inhibitors of metalloproteinases,TIMP)水平明显降低,年龄是唯一影响纤维化形成的因素[3]。
动物实验亦发现,快速起搏诱发AF的老年犬其左房纤维化相对于成年犬要严重[4]。主动脉缩窄术后心脏纤维化小鼠心脏中,衰老的心脏成纤维细胞(cardiac fibroblasts,CFs)明显增加[5];在人体组织中,亦发现AF患者心脏纤维化亦伴随着衰老CFs的堆积[6],提示衰老CFs在心脏纤维化中起重要作用。此外,另有研究显示,衰老可使心脏胶原合成降解失衡,胶原交联增强,最终导致纤维化发生[7-8]。
p300是一种能与腺病毒E1A蛋白相互作用的蛋白质,因其分子量为300 kD,被命名为p300,也被称为KAT3B或EP300。作为重要的真核生物基因调控因子,p300参与细胞生长、增殖和分化[9]。研究表明,p300参与慢性高血糖所致人皮肤微血管内皮细胞衰老[10],以及维持端粒功能和调节端粒相关的DNA损伤反应进而影响细胞衰老和周期[11];p300在硬皮病患者皮肤成纤维细胞中表达增加,且参与人皮肤成纤维细胞转化生长因子β(transforming growth factor-β,TGF-β)/Smads诱导的胶原生成增加[12]。因此,p300不仅参与细胞衰老的发生,还参与纤维化的发生,但是p300在CFs衰老及衰老相关纤维化中的作用尚不清楚。
综上所述,进一步明确p300在CFs衰老相关纤维化中的作用对了解衰老在AF发生发展中的作用具有重要意义。因此,本研究拟用不同月龄的C57BL/6小鼠以及不同代数的CFs为研究对象,观察p300、衰老及纤维化相关蛋白的表达变化,并干预p300,观察其对CFs衰老的影响。
材 料 和 方 法
1 动物
SPF级C57BL/6小鼠,雄性,3周龄,7周龄、5月、13月和18月龄,由广东省广州中医药大学实验动物中心提供,许可证号为SCXK(粤)2013-0034。不同基因型(p300+/+和p300flox/+)小鼠获赠于Dr. David Roux(Jackson Laboratory in Miller School of Medicine in University of Miami)。心脏成纤维细胞由小鼠心脏分离获取,连续传代至20代。本研究所有动物实验已通过广东省人民医院(广东省医学科学院)的动物实验伦理审查(No.GDREC2016128A)。
2 主要试剂
DMEM-F12 培养基(HyClone);特级澳洲胎牛血清和 0.25% EDTA-胰蛋白酶(Gibco);pBS185CMV-Cre 质粒和Neo-pEGFP-C1质粒(Addgene);G418和质粒提取试剂盒GenElute Plasmid DNA Miniprep Kit(Sigma);DNeasy Blood & Tissue 试剂盒(Qiagen);转染试剂Lipofectamine 2000(Invitrogen);DNA 及蛋白 marker(Fermentas);抗p300 抗体(Millipore);抗I型胶原蛋白α1链(collagen type I α1 chain,Col1A1)抗体(Abcam);抗MMP-2和p21抗体(Santa Cruz);抗p53、GAPDH、β-actin和TGF-β抗体及衰老相关β-半乳糖苷酶(senescence-associated β-galactosidase,SA-β-Gal) 染色试剂盒(Cell Signaling Technology);其它生化试剂均为进口分装或国产分析纯化。
3 主要方法
3.1细胞培养、质粒转染和克隆获取 使用0.25%EDTA-胰蛋白酶,从C57BL/6小鼠(3周龄)及p300+/+和p300flox/+小鼠(3月龄)心脏中消化分离心脏成纤维细胞,采用DMEM/F12培养基(含10% FBS、100 mg/L 链霉素和1×105U/L青霉素)培养于37 ℃、5% CO2培养箱。C57BL/6小鼠(3周龄)心脏成纤维细胞传代至第3、7和11代,用0.25%EDTA-胰蛋白酶消化收集于EP管,用于后续实验;p300+/+和p300flox/+小鼠(3月龄)心脏成纤维细胞传代至第4代,将细胞接种于60 mm培养皿中,待细胞密度达70%~80%时即进行转染。3.3 μg plasmid(3 μg pBS185CMV-Cre+0.3 μg Neo-pEGFP-C1)与相应体积的Opti-MEM培养基混合均匀,10 μL Lipofectamine 2000试剂与相应体积Opti-MEM培养基混合室温孵育5 min。然后将分别含有plasmid 和脂质体的溶液混合,轻柔混匀,室温孵育20 min后加入心脏成纤维细胞的培养基中,混匀,于37 ℃、5%CO2细胞培养箱中继续培养24 h。然后给予G418(1.1 g/L)进行筛选,获得细胞克隆,挑取细胞克隆扩增,获得稳定表达的细胞株。
3.2PCR鉴定细胞基因型 采用DNeasy Blood & Tissue 试剂盒分离提取各组细胞的DNA,分光光度法测定计算提取的DNA含量及浓度。PCR总反应体积为25 μL,其中具体方法如下:10 mmol/L dNTP,0.5 μL;50 mmol/L MgCl2,1.25 μL;10×PCR buffer,2.5 μL;10 μmol/L p300Xba+117S,1 μL;10 μmol/L p300Bam-460AS,1 μL;H2O,17.5 μL;DNA,1 μL;Taq polymerase,0.25 μL。引物序列:p300Xba+117S:5′-TGGACTGGTTATCGGTTCACC-3′;p300Bam-460AS:5′-CAGTTACATACAGCTGTGATG-3′。PCR程序为:94 ℃ 5 min;33×(94 ℃ 10 s、55 ℃ 1 min、68 ℃ 2 min);72 ℃ 7 min;4 ℃ forever。野生型的目的条带为800 bp,flox的条带为1 kb。然后,取PCR产物加适量上样缓冲液,在琼脂糖凝胶上电泳,凝胶图像成像系统拍摄保存实验结果。
3.3Western blot实验 细胞或剪碎研磨的组织内加入适量 RIPA裂解液,同时加入蛋白酶抑制剂,冰上裂解30 min,收集裂解液,12 000 r/min离心20 min,取上清,分装后储存于-80 ℃。测定蛋白浓度后,4×上样缓冲液(Invitrogen)稀释后的30 μg样本,95 ℃煮5 min。8%~10% SDS-PAGE分离蛋白,然后转至PVDF膜。TBST-脱脂牛奶室温下封闭2 h,加入相应Ⅰ抗[p300(1∶1 000)、Col1A1(1∶2 500)、MMP-2(1∶2 000)、p53(1∶1 000)、TGF-β(1∶1 000)、p21(1∶750)和GAPDH(1∶1 000)],4 ℃过夜。TBST 洗3次,每次10 min。根据Ⅰ抗来源种属选择合适的Ⅱ抗(辣根过氧化物酶标记的抗兔或抗小鼠IgG),5%脱脂奶粉1∶1 000比例稀释,室温孵育1 h。TBST洗3次,每次10 min。ECL 试剂盒显影蛋白条带,ImageJ软件定量分析蛋白灰度值,计算比值进行统计分析。
3.4SA-β-Gal染色 将细胞接种于6孔板,待细胞融合度达50%~70%可进行SA-β-Gal染色。弃培养基,PBS清洗3次,室温固定15 min,PBS清洗3次,按SA-β-Gal染色试剂盒说明配制染色工作液,调整pH至6.0,每孔加入1 mL染色液,37 ℃无CO2培养箱避光孵育24 h后,显微镜下采集图像。
3.5活细胞计数 将细胞制成细胞悬液,轻轻吹打细胞悬液,使细胞均匀分布;0.4%台盼蓝以1∶9与细胞悬液充分混匀,吸出少许细胞悬液滴于细胞计数板,静置1~2 min,拒染的为活细胞;显微镜下对计数板4个大格内的活细胞进行计数,遵循计上不计下,计左不计右原则;根据公式“细胞数=4大格细胞计数总数/4×稀释倍数×104×细胞悬液体积”算得细胞数目。
4 统计学处理
用SPSS 19.0统计软件进行分析。数据均采用均数±标准误(mean±SEM)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD和SNK检验,以P<0.05为差异有统计学意义。
结 果
1 不同月龄小鼠心脏组织p300及衰老和纤维化相关蛋白表达
Western blot检测不同月龄(7周、5月、13月和18月龄)C57BL/6小鼠左心房组织中p300,衰老相关指标p53和p21及纤维化相关蛋白Col1A1、MMP-2和TGF-β。结果显示,随着月龄增加,13月和18月龄小鼠左心房组织p300蛋白表达升高(P<0.01);与7周龄小鼠相比,13月和18月龄小鼠左心房组织p53和p21蛋白表达亦明显增加(P<0.05);纤维化相关蛋白Col 1A1的表达在13月和18月龄小鼠左心房组织中表达明显高于7周龄和5月龄组小鼠(P<0.05),MMP-2和TGF-β则以18月龄组小鼠左心房组织表达为最高(P<0.05),见图1。这提示随着月龄的增加,小鼠左心房p300表达明显升高,伴随着纤维化和衰老相关因子的表达增加。
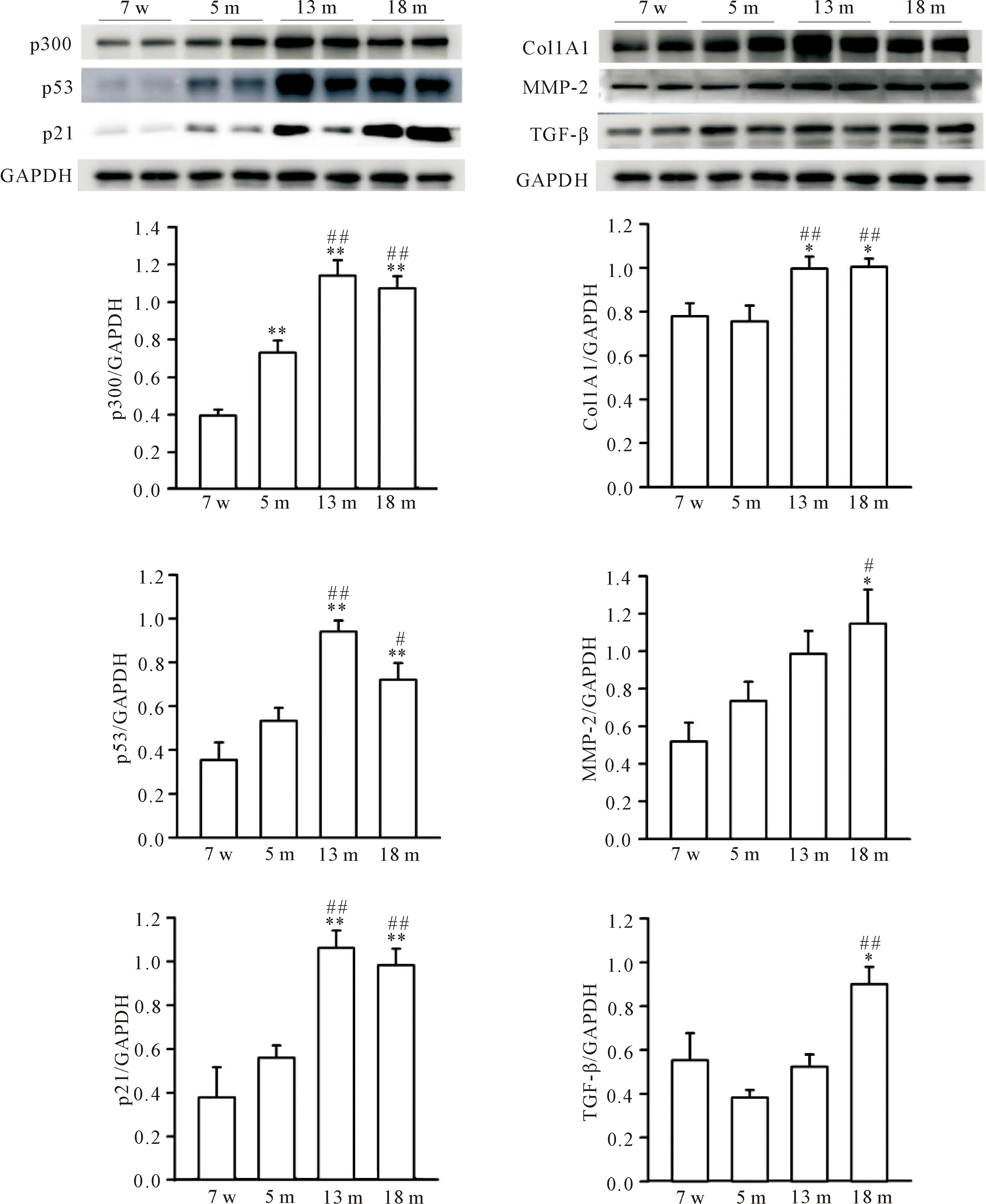
Figure 1.The protein expression of p300, p53, p21, Col1A1,MMP-2 and TGF-β in the atrial tissues of C57BL/6 mice at different ages. w: weeks; m: months. Mean±SEM. n=6~8. *P<0.05, **P<0.01 vs 7 w group; #P<0.05, ##P<0.01 vs 5 m group.
2 不同代数C57BL/6小鼠心脏成纤维细胞中p300、衰老相关蛋白及纤维化相关蛋白的表达
原代分离C57BL/6小鼠CFs,并传代培养诱导细胞衰老。取第3、7和11代细胞,Western blot检测p300、p53、p21、Col 1A1、MMP-2和TGF-β蛋白表达。随着细胞传代代数的增加,p300蛋白表达明显增加,以第11代的CFs表达最高(P<0.05);与第3代相比,第11代CFs细胞p53和p21蛋白的表达亦明显增加(P<0.05)。纤维化相关蛋白Col1A1、MMP-2和TGF-β随着细胞代数的增加,与第3代小鼠CFs相比,第11代CFs的Col1A1、MMP-2和TGF-β的蛋白表达均明显增加(P<0.01),见图2。这提示,随着心脏成纤维细胞的衰老,p300的表达和纤维化因子分泌增加。
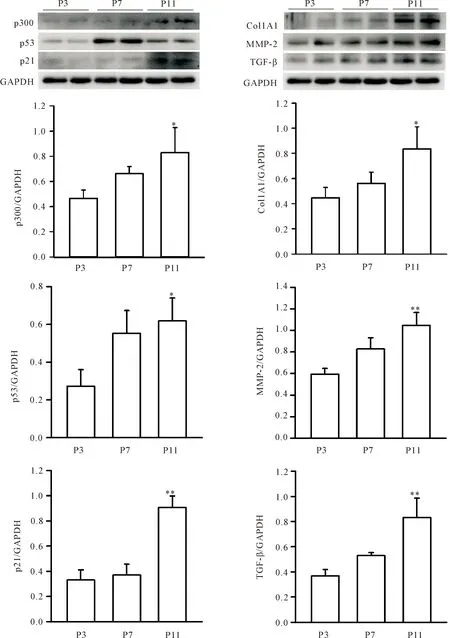
Figure 2.The protein expression of p300, p53, p21,Col1A1, MMP-2 and TGF-β in mouse cardiac fibroblasts of different passages. Mean±SEM. n=6~8. *P<0.05, **P<0.01 vs P3 cells.
3 稳定敲除p300的心脏成纤维细胞株的建立
分离p300+/+和p300flox/+小鼠的CFs,构建pBS185 CMV-Cre和Neo-pEGFP-C1质粒,以10∶1的比例,使用Lipofectamin 2000进行转染,转染24 h后,倒置荧光显微镜观察,见图3A。予以G418(1.1 g/L)筛选后形成细胞克隆,PCR鉴定p300是否成功被敲除一条等位基因。结果显示,Het 组细胞株1a、2a、5a和5b均被成功敲除p300的一条等位基因,且Western blot检测提示其p300蛋白表达明显下降(P<0.01),见图3B、C。
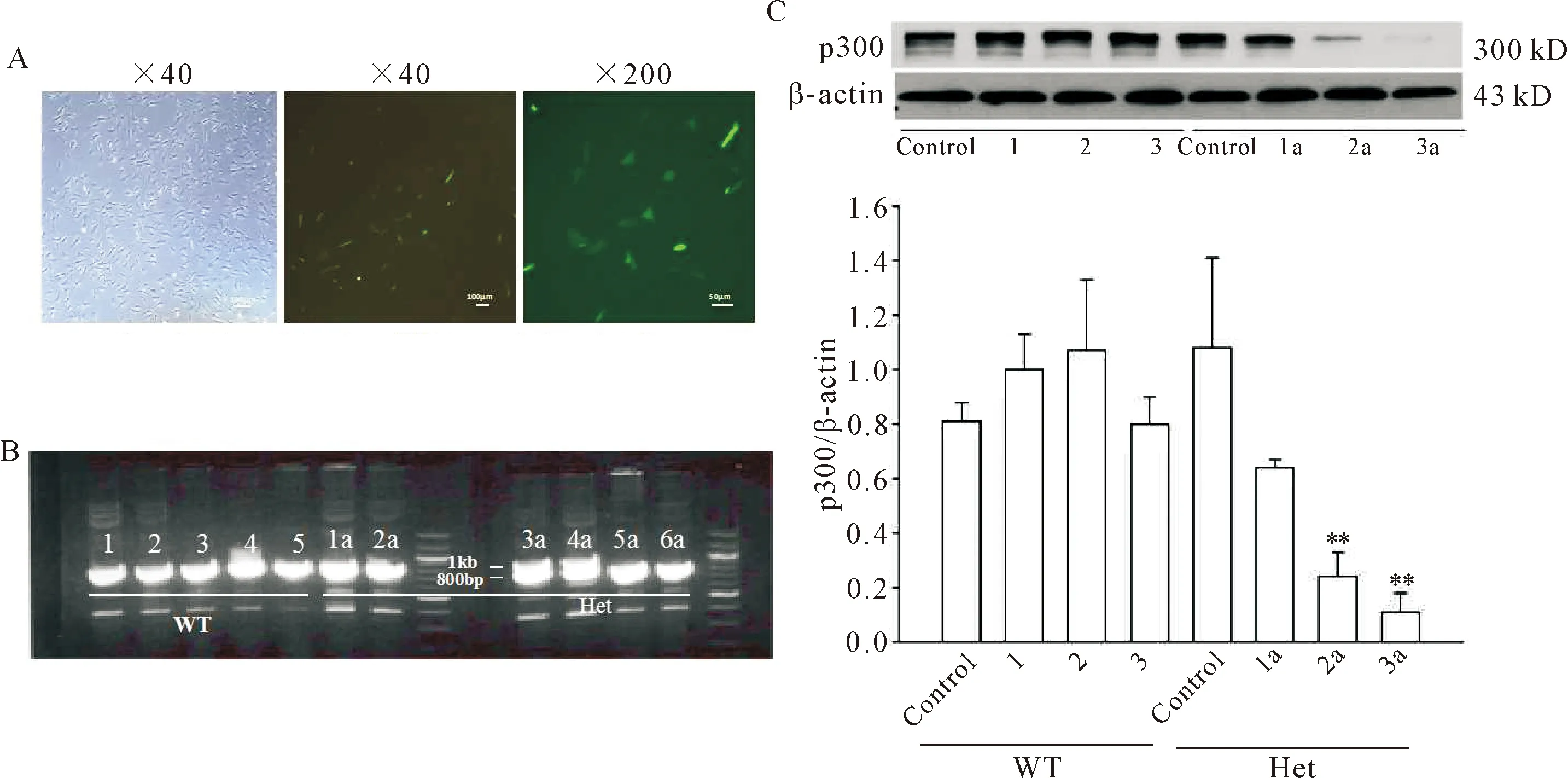
Figure 3.Cell fluorescence and p300 expression after plasmid transfection. A: cell fluorescence after plasmid transfection for 24 h; B: PCR results for genotypes of WT (1, 2, 3, 4 and 5) and Het (1a, 2a, 3a, 4a, 5a and 6a); C: the protein expression of p300 in cardiac fibroblasts after p300 knockout in WT and Het mice. Mean±SEM. n=3. **P<0.01 vs Het control.
4 p300敲除小鼠心脏成纤维细胞的衰老率明显低于对照组
WT组和Het组(p300-/+)的细胞分别予以传代,取第12、15和18代细胞观察2组细胞衰老率的不同。SA-β-Gal染成绿色的提示为衰老细胞。结果发现,WT组各代均有核染成绿色的衰老细胞,且随着细胞代数的增加,衰老细胞增加;而Het组各代均无衰老细胞出现,见图4A。这些结果提示部分敲除p300的CFs,随着培养代数的增加,衰老细胞明显少于野生型对照组。
5 p300敲除小鼠心脏成纤维细胞的生长速度明显快于对照组
WT组和Het组(p300-/+)的细胞传代至第12代,每日予以细胞计数,并绘制细胞增殖曲线,结果发现与WT组细胞相比,Het组细胞增殖明显较快(P<0.01),见图4B。此结果提示,随着细胞衰老模型的建立,细胞增殖速度减慢,而敲除p300可保护细胞免于增殖速度减慢,进而减少衰老。
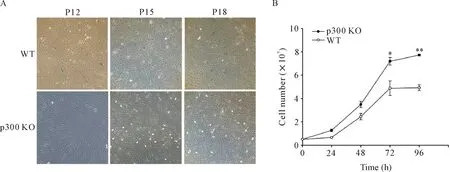
Figure 4.Cell senescence and proliferation in p300 KO Het and WT CFs. A: representative images of SA-β-Gal staining in p300 KO Het and WT cell clones in passages 12, 15 and 18 (×40); B: the cell growth curve of Het and WT cell clones in passage 12. Mean±SEM. n=3.*P<0.05, **P<0.01 vs WT group.
讨 论
综合以上研究结果,C57BL/6小鼠心房组织中,p300随着年龄的增加而增加,并伴随着衰老相关因子p53和p21及纤维化相关因子Col1A1、MMP-2和TGF-β表达的增加;p300参与心脏成纤维细胞衰老和衰老相关纤维化的发生;敲除p300表达有助于延缓成纤维细胞衰老的发生。
细胞衰老是指可增殖细胞细胞周期停滞于G1期,是对应激的一种反应,表现为细胞形态扁平,体积增大,并出现染色质集落、衰老相关的半乳糖苷酶和脂褐素颗粒等特异性标志物。细胞衰老分为复制性衰老和过早衰老,现有研究表明高糖、D-半乳糖等刺激因素均可用于诱导细胞衰老模型建立[13]。正常成纤维细胞在体外培养时,表现为有限生长,即传代代数有限,通常被用作生物体衰老模型[14]。尽管细胞衰老是对应激的一种适应性反应,可增加器官寿命,但亦可对器官生存起负面作用。机体衰老时,衰老细胞在增殖性组织中聚集,释放多种降解酶、生长因子和炎症因子,影响周围非衰老细胞的功能,从而导致一系列疾病。现有研究表明衰老心脏成纤维细胞在疾病相关心脏纤维化中起重要作用[6, 9],但其在衰老相关纤维化中的作用及具体机制尚不明确。因此,通过传代心脏成纤维细胞建立复制性衰老模型模拟心脏衰老,探讨其潜在机制,对于防治衰老相关心脏纤维化具有重要的生理病理意义。
p300是一种转录辅激活因子和乙酰基转移酶,具有内在乙酰基转移酶活性,其分子中富含半胱氨酸/组氨酸区域(CH1~CH3)、KIX 区域、溴区、组蛋白乙酰转移酶(histone acetyltransferase,HAT)区和C末端富含谷氨酰胺区[15-17]。乙酰化酶和组蛋白去乙酰化酶是一对相反的调控因子,参与调控细胞凋亡,DNA损伤修复,细胞周期控制,自噬和代谢等等[18-21]。研究表明去乙酰化酶激活可通过介导卡路里的限制和抑制胰岛素信号,延长寿命[22],参与衰老。因此可推测乙酰化酶p300也参与衰老的发生。转录共激活因子 p300作为一种乙酰转移酶,其功能已得到广泛的关注与研究,而直接关注p300在衰老中作用的研究较少。但已有研究表明,显性失活p300转基因抑制p300 HAT后,正常人黑素细胞经历生长停滞,细胞周期蛋白抑制和细胞衰老激活[23]。此外,在肿瘤研究中发现,p300/CBP HAT 活性抑制剂 C646 可抑制人类黑色素瘤和其他肿瘤细胞的生长,促进细胞衰老[24]。
尽管多种细胞信号通路参与细胞衰老过程,但最终都集中于2个经典的信号通路,p53/p21通路和p16/Rb通路。通常正常细胞内MDM2(mouse double minute 2)与p53相互结合,抑制p53活性,维持p53低表达。细胞分裂时,MDM2活性被抑制,p53激活下游细胞周期依赖激酶抑制蛋白p21,从而使细胞周期停止。当细胞发生复制性衰老时可通过p53/p21通路启动细胞衰老过程。另一条通路,当细胞受到外界刺激或DNA损伤时,可上调细胞内p16表达,抑制CDK4/6与细胞周期蛋白形成复合物,激活视网膜母细胞瘤蛋白Rb,抑制转录因子E2F活性,诱发细胞衰老[25]。当细胞发生过早衰老时,可通过p53/p21和p16/Rb通路启动细胞衰老。本研究显示,随着动物或细胞衰老的发生,p300/p53/p21表达亦上调,这与以往在人脐静脉血管内皮细胞中的研究发现p300在高糖刺激诱导的衰老内皮细胞中表达上调的报道一致[24]。人原代成纤维细胞中的研究也有报道p300/CBP是衰老途径中p53的转录共激活因子,而E1A或siRNA对p300/CBP的失活可通过阻止p53活化来延缓衰老[26]。
此外,p300还可参与纤维化,如p300参与糖尿病患者心肌肥厚的同时,促进心肌纤维化[27]。但是p300参与衰老相关心脏纤维化的具体机制仍未被阐明。TGF-β是心房纤维化调控中的核心生长因子,由成纤维细胞生成。TGF-β1过表达可导致心房纤维化和心房传导异常,产生心房折返通路诱发AF[2]。本研究证实,p300随着衰老的发生增加,同时心脏成纤维细胞胶原蛋白和TGF-β表达也升高,最终小鼠心脏纤维化发生。这提示,p300不仅参与衰老的发生,还可能通过调控TGF-β相关纤维化通路参与心脏衰老相关纤维化的发生。
综上所述,本文证实p300参与CFs衰老的发生,且可能通过调控纤维化相关蛋白表达参与CFs衰老相关纤维化,而抑制p300可延缓CFs衰老相关纤维化的发生。本研究进一步拓展了我们对于p300在CFs衰老中作用的认识,但其具体机制仍进一步深入研究去论证, 以期为临床上衰老所致AF的防治提供新的策略。

