铅离子导致神经胶质细胞毒性的代谢组学机制
穆岩,李丽丽,马双双,宋月,王泉博*
(齐鲁工业大学(山东省科学院)山东省分析测试中心 a.环境与健康免疫研究室; b.山东省中药质量控制技术重点实验室,山东 济南 250014)
铅污染及相关中毒事件是世界性环境和医学问题。2017年,全球铅生产量超过400万吨,而中国是最大的铅生产国和消费国[1-2]。相当一部分铅通过电子垃圾、铅基汽油、化妆品、含铅涂料等不同形式污染自然环境,然后通过直接接触,或食物链、PM 2.5等间接接触方式进入人体[3]。研究表明,谷物、动物和人类体内都已发现显著的铅积累。人体的铅积累会导致严重的健康问题,包括肝损伤、中枢神经系统损害和炎症等[4-5],尤其儿童,铅积累会引起神经损伤和骨骼异常等不可逆的发育毒性[6]。据世界卫生组织报道,2016年有54万人死于铅中毒[7]。铅一旦进入人体,则很难完全迅速排出,临床对铅中毒的治疗主要是基于螯合疗法,使用乙二胺四乙酸二钠(EDTA二钠钙)或二巯基琥珀酸等螯合剂治疗[8-9]。然而,螯合疗法主要应用于高剂量的急性铅中毒,对长期暴露而导致的微量铅中毒作用有限。另一方面,螯合剂的使用也伴有严重的副作用,包括脱水、低血钙和肾脏损害,甚至死亡[10-12]。
目前对铅中毒的机制,主要研究其抑制体内多种酶的活性和导致超氧化合物刺激等[13],但铅对神经细胞代谢组学的影响研究较少。因此,本文以正常神经胶质细胞BV-2为模型,采用UPLC-QTOF液质联用技术研究铅离子诱导下的BV-2细胞代谢组学变化,为铅毒性缓解药物的研发提供参考,为临床铅中毒的治疗提供理论基础。
1 仪器与试剂
1.1 仪器
生物安全柜(上海力康生物科技有限公司);倒置显微镜(美国奥林巴斯公司);BSA124S分析天平(德国Sartorius公司);超声波清洗机(SB-3200DT,宁波新芝生物科技股份有限公司);流式细胞仪(美国BD Biosciences公司);二氧化碳培养箱(美国Thermo公司);冷冻离心机(美国Thermo公司);超高效液相色谱仪(Acquity H-Class,美国Waters公司);四极杆飞行时间质谱仪(Impact Ⅱ,德国Bruker公司)。
1.2 试剂
色谱级甲醇、乙腈,购自美国Thermo公司;分析纯甲酸、乙酸、碳酸氢铵、醋酸铅,购自天津市科密欧化学试剂有限公司;去离子水,美国Thermo公司纯水机制备;细胞培养级胎牛血清,购自巴西Lonser公司;细胞培养级二甲基亚砜、磷酸盐缓冲液、青霉素-链霉素溶液、细胞凋亡试剂盒,购自北京索莱宝有限公司;细胞培养级高糖DMEM(Dulbecco's modified eagle medium)培养基、溴化噻唑蓝四氮唑,购自美国Sigma公司。
2 实验方法
2.1 细胞培养
使用添加10%胎牛血清和青霉素-链霉素的高糖DMEM培养基培养神经胶质细胞系BV-2,细胞培养箱温度37 ℃,二氧化碳浓度5%。根据细胞生长密度,每2~3 d用细胞刮刀传代培养。
2.2 醋酸铅溶液的配制
取醋酸铅粉末适量,精密称定后溶解于对应体积的纯乙酸中,加入20倍体积去离子水稀释制成储备液,处理细胞时,按照0.1%比例加至培养基中暴露。
2.3 细胞形态学和增殖活力试验
收集BV-2细胞悬液后,在400 g离心力下离心5 min,然后加入5 mL培养基重悬,测定细胞浓度;调整BV-2细胞浓度至按照1×105/mL,每孔100 μL接种于96孔板;细胞贴壁后分别加入1、10、20 μmol/L铅离子(醋酸铅溶液)或空白溶剂染毒暴露;处理48 h后,置于显微镜下拍照记录细胞形态;然后加入MTT溶液,孵育4 h,加入二甲基亚砜溶解结晶后,在酶标仪495 nm波长下测定吸光度,以处理孔的吸光度与正常对照孔的吸光度比值计算细胞存活率。
2.4 细胞凋亡实验
调整BV-2细胞浓度至1×105/mL,每皿3 mL接种于6 cm培养皿中,加入10 μmol/L铅离子(醋酸铅溶液)或相同体积的空白溶剂处理48 h。收集各组细胞后,用磷酸盐缓冲液洗涤2次,然后用Annexin V-PE/7-AAD 染色20 min,放入BD流式细胞仪中进行细胞凋亡检测和分析。
2.5 细胞代谢物提取
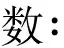
2.6 细胞代谢物液相及质谱测定
超高效液相色谱仪参数为:Waters C18色谱柱(1.7 μmol/L,3.0 mm×100 mm);柱温40 ℃;样品室温度4 ℃;流速0.4 mL/min;洗脱溶剂为0.1%甲酸水溶液(A)和0.1%甲酸乙腈溶液(B)。洗脱梯度依次为0~2 min:99% A~A 70%;2~8 min:70% A~1% A;8~17 min:1% A;17.0~17.1 min:1% A~99% A;17.1~20.0 min:99% A;进样量10 μL。
四极杆飞行时间质谱仪参数为:离子源ESI;正离子模式;扫描质荷比50~1500m/z;端板偏移电压-500 V;毛细管电压3.5 kV;雾化和干燥气体为高纯度氮气,流速8.0 L/min,压力2.0 bar;干燥温度220 ℃。
2.7 细胞代谢物的液质数据生物信息学分析
将铅离子暴露组和正常对照组所测全部液相和质谱原始数据,包括保留时间、离子流峰高及相应离子片段分子量信息等,上传至XCMS online数据库[14],选择Pairwise模式进行数据处理,包括峰识别、特征峰提取、保留时间校正、特征峰对齐、自动t-test显著性差异检验、主成分分析(principal component analysis,PCA)等。差异代谢物分析选择P<0.05,变化倍数为1.5~40,分子量小于1000的特征峰。导出处理后的质谱数据,上传至MetaboAnalyst数据库[15],选择Peaks to Pathway模式,进行代谢通路富集分析,设定参数如下:Mummichog算法,P<0.001,分子量比对精度0.000 5%,KEGG Mus musculus 代谢通路数据库[16]。最终得到代谢通路富集图及其相应的差异代谢物。
2.8 数据分析
使用Graph pad prism 7.0软件进行作图,显著性差异分析采用Student’s t-test,双侧检验,P<0.05视作具有显著性差异。
3 试验结果
3.1 铅离子对神经胶质细胞形态和数量的影响
如图1所示,BV-2细胞在暴露不同浓度铅离子48 h后,随着铅离子的浓度升高,在同等放大倍数和视野下的BV-2细胞数显著减少,细胞形态由正常的多边形略带触角变化为膨大的细长型,并伴有大量细胞碎片和膜塌陷的细胞圆球。整体看,铅离子对细胞形态和数目的改变具有显著的浓度依赖性,在10 μmol/L浓度下即产生显著的毒性变化。
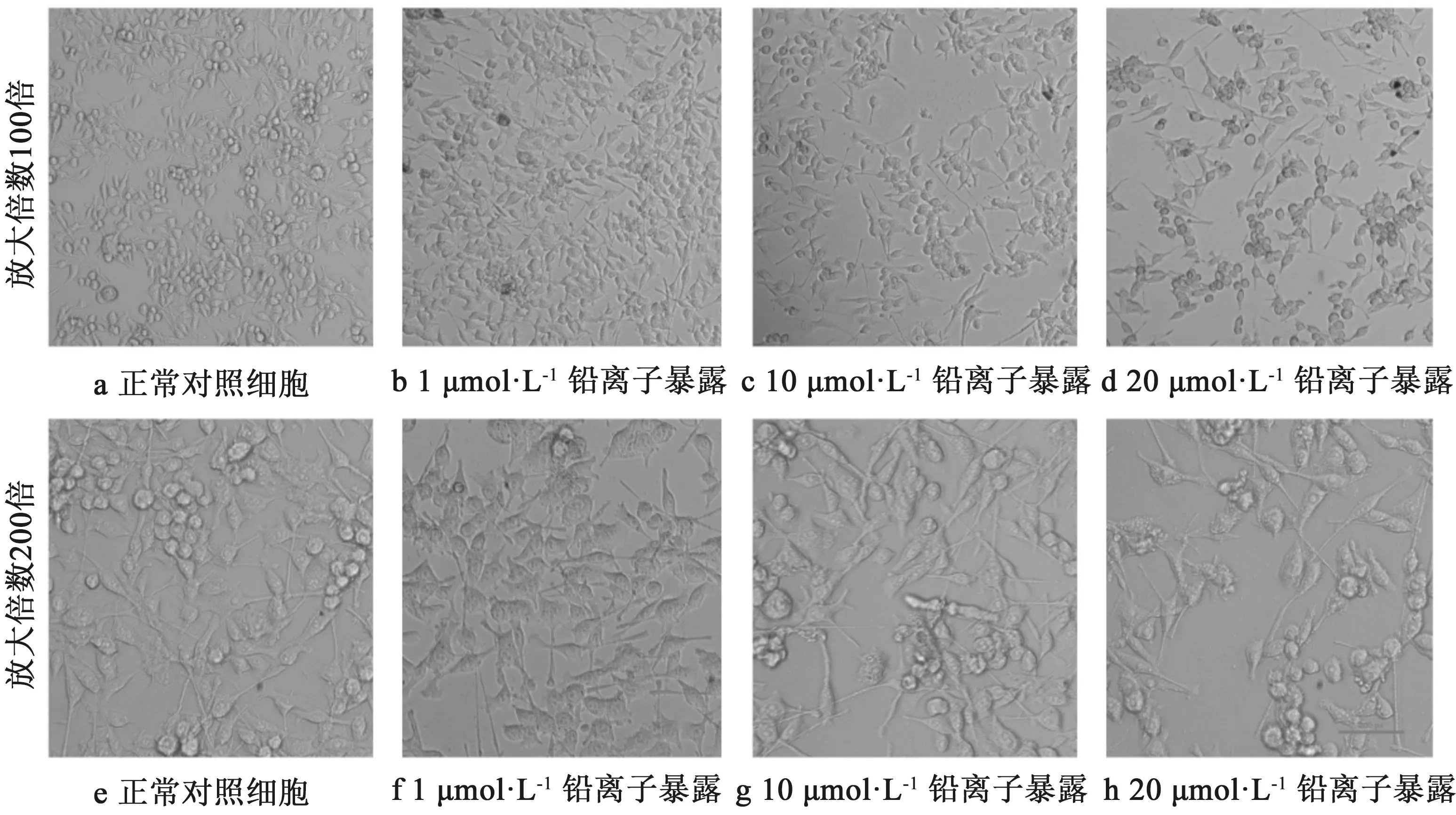
图1 铅离子对BV-2细胞形态的影响
3.2 铅离子对神经胶质细胞存活率的影响
BV-2细胞存活率的测定采用MTT法进行。通过铅离子暴露孔与正常对照孔的吸光度比值得出细胞存活率。结果如图2所示,铅离子处理BV-2细胞48 h后,相比正常对照组(空白溶剂处理),1 μmol/L铅离子暴露的细胞存活率没有显著性差异,而10 μmol/L铅离子导致细胞存活率下降了40%左右,20 μmol/L铅离子导致细胞存活率下降超过50%,说明铅离子对神经胶质细胞的存活率具有显著毒性,且具有浓度依赖性。

*代表与正常对照组(空白溶剂处理)相比,P<0.05
基于上述实验结果可知,20 μmol/L高剂量铅离子组细胞存活率严重降低,因此本文选择10 μmol/L铅离子暴露浓度进行进一步研究。
3.3 铅离子对神经胶质细胞凋亡的影响
对正常对照组与10 μmol/L铅离子暴露组BV-2细胞的凋亡状态分析发现,10 μmol/L铅离子显著增加BV-2细胞晚期凋亡或坏死比例,其从0.5%升高至6.1%;而细胞膜破损的细胞比例从2%增至12%(7-氨基放线菌素D阳性),结果如图3所示。实验结果说明10 μmol/L铅离子对神经胶质细胞具有明显凋亡诱导效应。
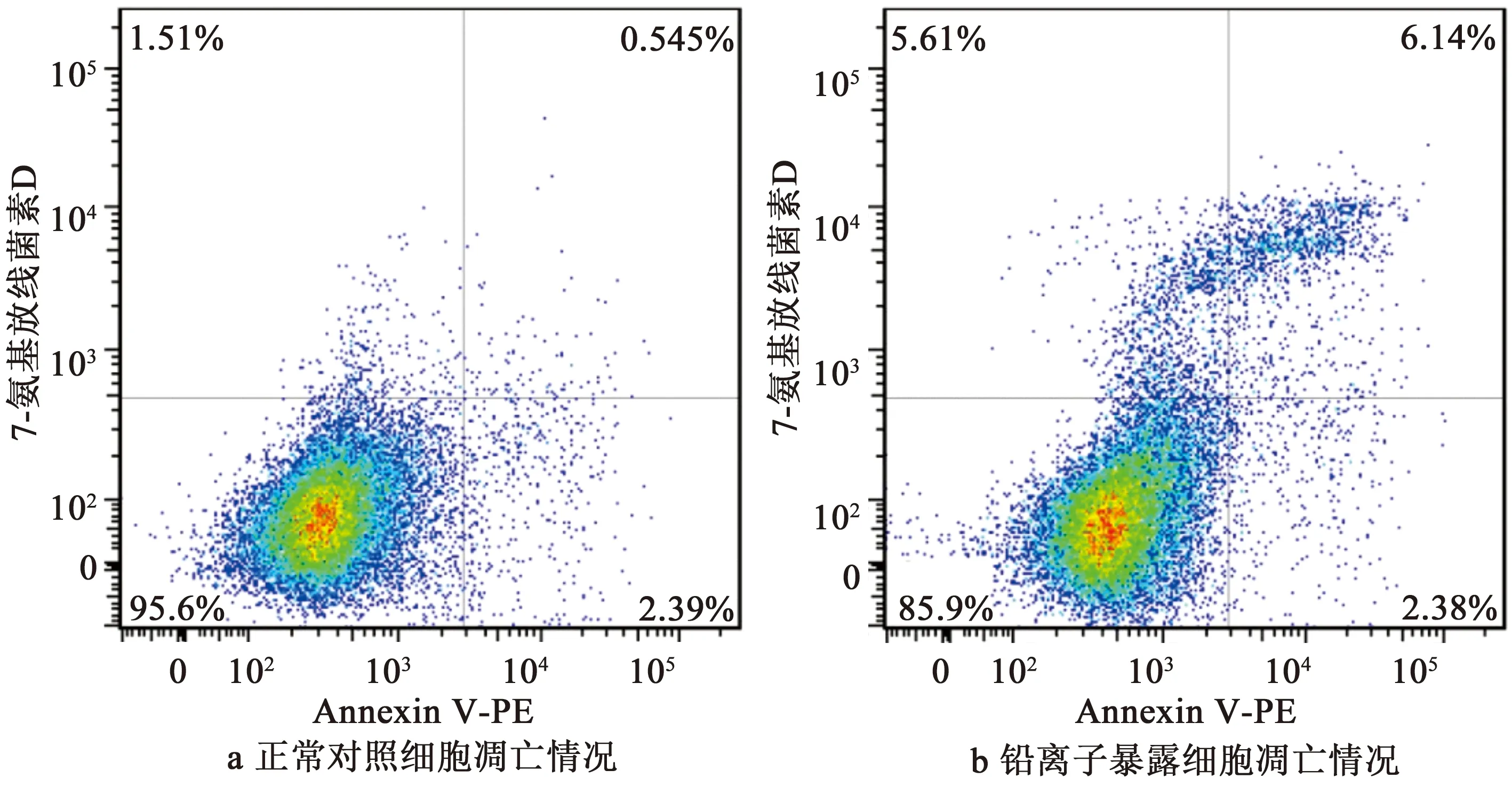
图3 铅离子对BV-2细胞凋亡比例的影响
3.4 铅离子对神经胶质细胞代谢物的影响
通过XCMS online数据库对BV-2细胞正常对照组与10 μmol/L铅离子暴露组的液相及质谱数据分析结果如图4所示。由图4a和4b可知,以离子峰高计,铅离子对细胞总代谢物水平没有产生显著差异,各组6个样品离子峰平行性良好。图4c针对单个代谢物的数据分析显示,两组差异主要集中于10~12 min色谱区间,变化倍数大于1.5且具有显著性差异(P<0.05)的特征峰数目为973个,图中,气泡个数代表差异特征峰,气泡大小代表差异特征峰变化倍数大小,红色代表铅离子暴露组相应代谢离子峰比正常对照组升高,绿色代表铅离子暴露组相应代谢离子峰比正常对照组下降。实验说明,10 μmol/L铅离子导致神经胶质细胞产生了显著的代谢物的水平变化,显著影响了细胞的生命过程。
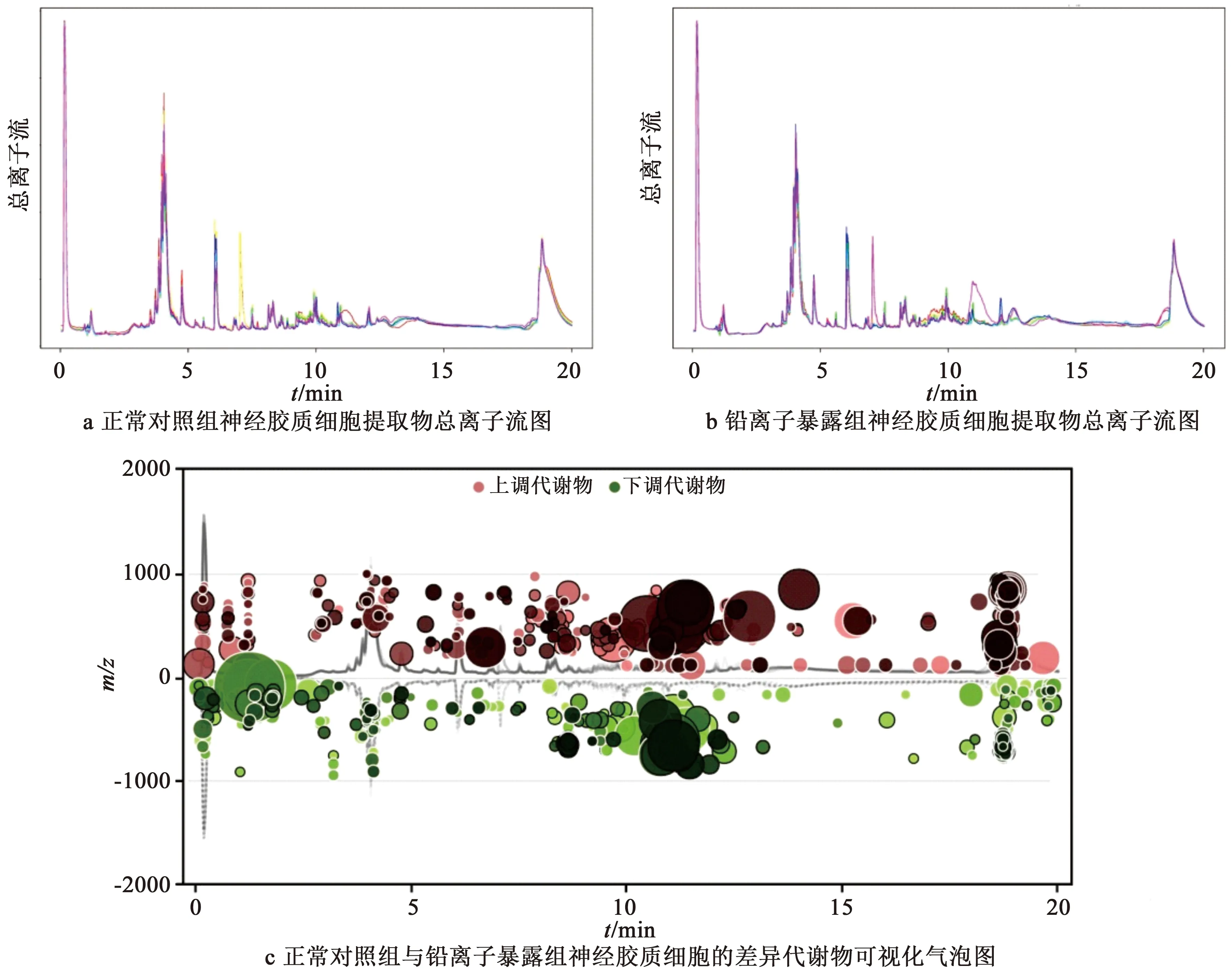
图4 正常对照组与铅离子暴露组的BV-2细胞总离子流图与差异代谢物可视化气泡图
3.5 神经胶质细胞正常对照组与铅离子暴露组的PCA分析
通过PCA分析发现,BV-2细胞正常对照组与10 μmol/L铅离子暴露组具有明显不同的聚类趋势,以PC1(方差18%)特征为界限,正常对照组分布于左侧区域而铅离子暴露组全部分布于右侧区域,组间表现出良好的分群特点。实验显示,作为外来污染物(刺激物),铅离子显著改变了神经胶质细胞的代谢行为和模式,干扰了其正常代谢平衡和生理活动。详见图5。

图5 BV-2细胞正常对照组与铅离子暴露组的PCA得分图
3.6 铅离子对神经胶质细胞代谢通路的影响
将处理后的质谱数据上传至MetaboAnalyst数据库,设定P<0.001,将差异代谢物进行代谢通路富集分析,结果如图6和表1所示,其中显著程度由数据库根据指定代谢通路的代谢物预期数量与实际测得数量的一致性情况计算得出,并以-logP值表示[15]。铅离子显著改变了代谢物谷氨酸、谷氨酰胺、多个葡糖糖代谢中间产物、3-羟基-3-甲基戊二酰乙酰辅酶A、乙酰辅酶A、烟酰胺腺嘌呤二核苷酸磷酸(NADP)、原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)、谷胱甘肽等数十个代谢物水平,干扰了BV-2细胞中谷氨酰胺和谷氨酸盐代谢、抗坏血酸和醛酸代谢、丁酸盐代谢以及谷胱甘肽代谢等多个涉及氧化还原功能等共33条重要代谢通路。根据图6,越靠近右侧,其权重值越高,越靠近上侧,其显著性越强。这些代谢通路大体可以分为以下3类:氨基酸和葡萄糖代谢通路、维持氧化还原状态的代谢通路以及脂类代谢通路。
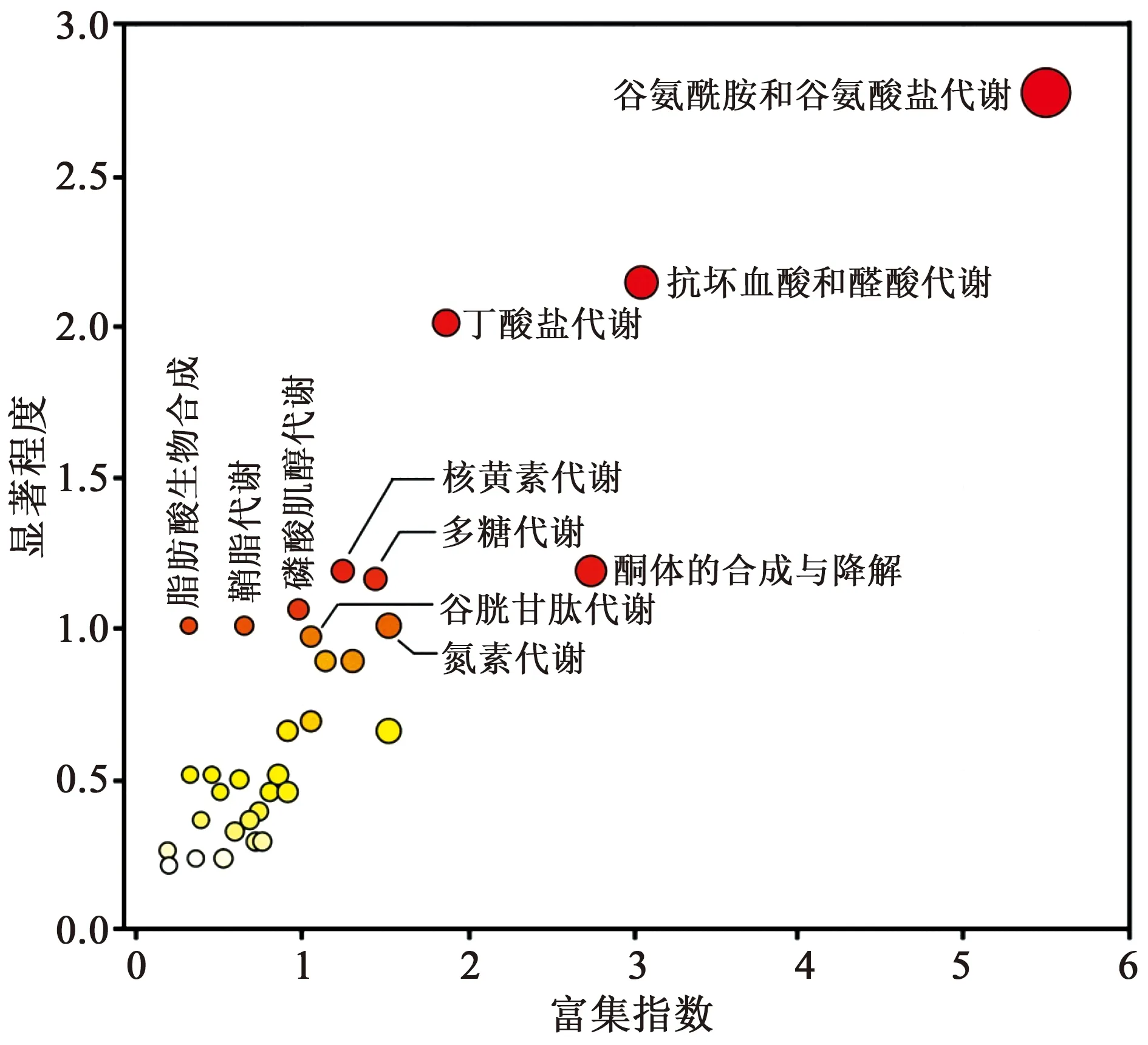
图6 神经胶质细胞被铅离子显著改变的代谢通路富集图
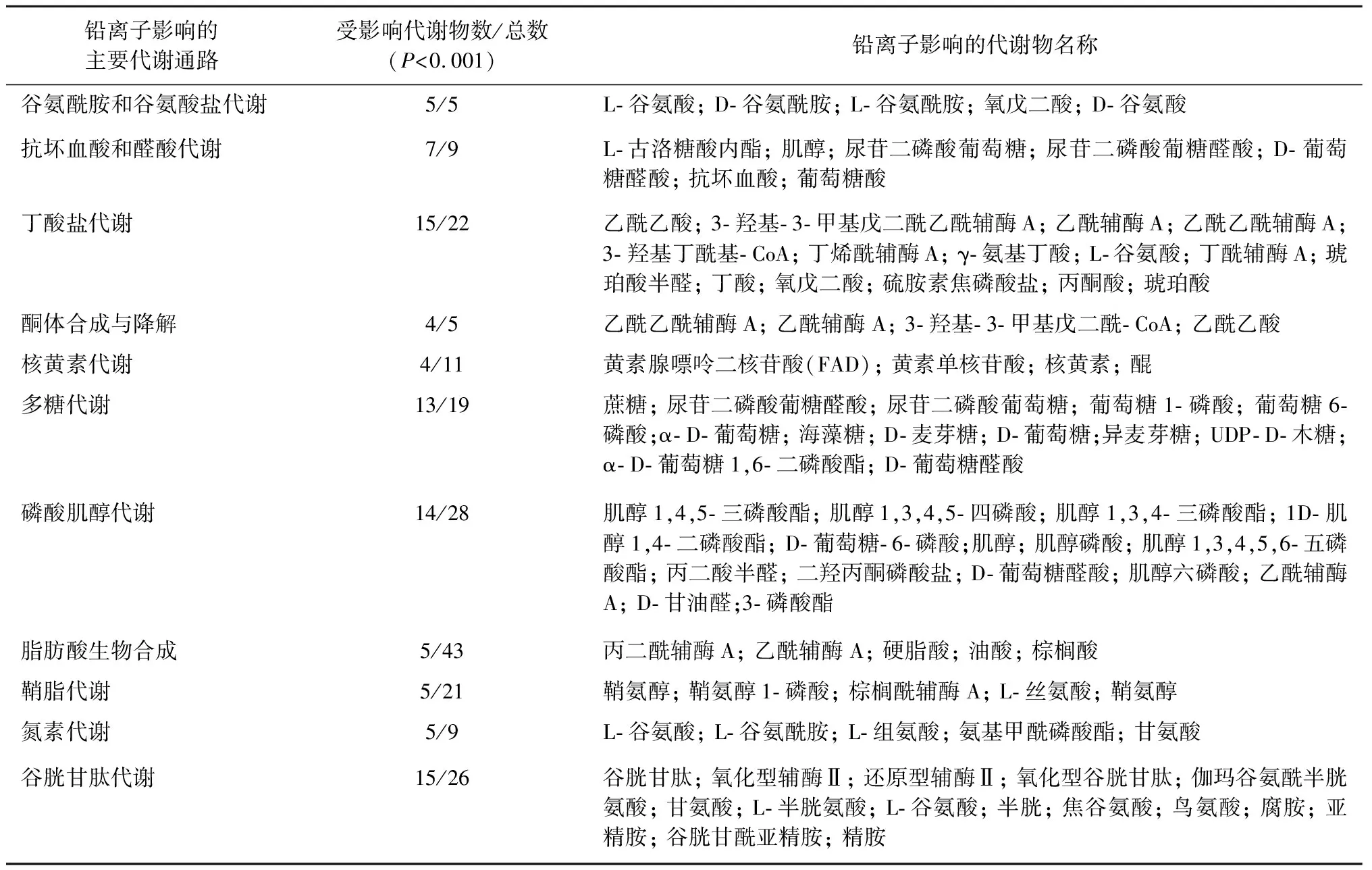
表1 铅离子影响的BV-2神经胶质细胞的主要代谢通路及其代谢物
代谢通路分析结果提示,针对性地修复铅离子造成的代谢通路紊乱可能会缓解其毒性,例如在受影响的谷胱甘肽代谢通路中,带有活性巯基的谷胱甘肽和半胱氨酸的抗氧化和解毒作用,在维持细胞氧化还原平衡等生理活动中具有重要作用,可以使细胞膜免受过氧化耦合反应,免于氧化应激的损伤。有文献报道天然产物槲皮素可以通过抑制氧化应激减轻铅离子造成的组织损伤[17]。
4 结论与讨论
本文为了探索铅离子生物毒性的细胞代谢组学作用机制,以神经胶质细胞为模型,对铅离子导致的细胞形态变化、细胞存活率和凋亡等进行了研究,并基于UPLC-QTOF液质联用技术测定了铅离子暴露组和正常对照组的神经胶质细胞中代谢物的水平。结果显示,10 μmol/L 铅离子即可引起神经胶质细胞的形态发生显著变化、存活率下降以及凋亡比例的上升。这些结果与文献[18]报道一致,表明铅离子对神经胶质细胞具有显著的生物毒性。与文献[19]报道的正常肾细胞HEK293等细胞模型相比,本文发现BV-2细胞在10 μmol/L铅离子暴露下存活率更低。进一步通过UPLC-QTOF质谱测试发现,铅离子暴露后的神经胶质细胞中多达973个潜在代谢物水平变化大于1.5倍(P<0.05),而且PCA分析显示铅离子暴露组和正常对照组BV-2细胞具有显著不同的聚类趋势,差异代谢物的通路富集分析显示铅离子显著改变了神经胶质细胞中谷氨酰胺和谷氨酸盐代谢、抗坏血酸和醛酸代谢、丁酸盐代谢以及谷胱甘肽代谢等多个涉及氧化还原等功能的重要代谢通路。这些结果表明铅离子显著影响了神经胶质细胞的代谢行为和模式,干扰了其正常代谢平衡和生理活动,这可能是铅离子引起细胞毒性的作用机制之一。
综上所述,铅污染及其引起的中毒事件仍然是一个全球性问题,对铅中毒尤其是低剂量铅的毒性机制和治疗需要进一步地深入研究,本文通过对铅离子神经胶质细胞毒性和细胞代谢组学的研究,为铅离子的毒性作用机制提供了理论参考,为缓解铅毒性药物研发提供了实验基础。

