幽门螺杆菌感染与儿童过敏性紫癜早期肾损害的相关性研究
殷海斌, 周 承
(南京医科大学附属常州第二人民医院 儿内科, 江苏 常州, 213000)
幽门螺杆菌(Hp)感染与慢性胃炎、消化性溃疡病、缺铁性贫血、特发性血小板减少性紫癜(ITP)、慢性荨麻疹以及儿童生长发育迟缓等相关,还与过敏性紫癜(HSP)的发病关系密切。HSP是儿童期最常见的血管炎,其特征是白细胞性血管炎及皮肤、关节、胃肠道、肾脏小血管免疫球蛋白A(IgA)沉积,总体预后良好,但1%~2%的HSP患儿会发生慢性肾脏疾病,而约8%的过敏性紫癜性肾炎(HSPN)可能进展为终末期肾病[1]。早期发现HSP患儿的肾损害并进行早期治疗,对于改善患儿预后极为重要。近年来,越来越多的研究[2-4]探讨了尿微量蛋白与HSP早期肾损害的关联性。本研究探讨了Hp感染与HSP的相关性及其对患儿早期肾损害的影响,现报告如下。
1 资料与方法
1.1 一般资料
选取2017年1月—2018年12月本院收治的资料完整、未经Hp根除治疗、随访时间超过6个月的151例HSP患儿作为研究对象,其中男79例,女72例,年龄2~12岁,诊断均符合第8版《诸福棠实用儿科学》中的HSP诊断标准。151例HSP患儿中,有52例检出Hp阳性,检出率为34.44%。将合并Hp感染的52例HSP患儿随机分为A组25例与B组27例,另将未合并Hp感染的99例HSP患儿设为C组。A组男14例,女11例,平均年龄(7.24±2.24)岁; B组男16例、女11例,平均年龄(6.63±2.80)岁; C组男49例、女50例,平均年龄(6.85±2.42)岁。3组患儿年龄、性别等一般情况比较,差异无统计学意义(P>0.05)。
1.2 方法
所有患儿均行病原学检测,经胃镜取胃黏膜组织行快速尿素酶试验或13C-尿素呼气试验[测定结果以超基准值(DOB)表示, DOB≥4.0为阳性, <4.0为阴性,仪器为北京华亘安邦科技有限公司生产的HG-IRIS200型13C红外光谱仪,试剂盒由北京勃然制药有限公司提供],任意1项检查阳性可诊断为Hp感染[5]。采用散射比浊法对每位患儿初诊时和病程1、3、6个月时的尿微量蛋白进行检查,包括尿β2微球蛋白(β2-MG)、尿α1微球蛋白(α1-MG)、尿微量转铁蛋白(TRF)、尿白蛋白(UAlb)、尿免疫球蛋白G(UIgG), 标本为24 h小便,仪器采用贝克曼库尔特公司生产的IMAGE800特种蛋白分析仪器。各指标正常参考值: 尿β2-MG 0~0.23 mg/L, 尿α1-MG 0~12.00 mg/L, 尿TRF 0~2.18 mg/L, 24 h UAlb 2.00~13.40 mg, UIgG 0~9.60 mg/L。肾功能损害: 仅尿β2-MG和/或尿α1-MG升高,提示单纯肾小管功能损害; 仅尿TRF和/或UAlb和/或UIgG升高,提示单纯肾小球功能损害; 尿β2-MG和/或尿α1-MG升高且伴尿TRF和/或UAlb和/或UIgG升高,提示混合性肾功能损害。
1.3 治疗方案
B组、C组采用HSP常规治疗,主要包括抗过敏、抗血小板聚集、抗凝、激素等支持治疗和对症治疗。A组在常规治疗基础上加用HP根除治疗,采用标准序贯疗法,即奥美拉唑[0.6~1.0 mg/(kg·d)餐前口服, 2次/d]+阿莫西林克拉维酸钾片[10.0~20.0 mg/(kg·d), 2次/d]治疗5 d, 奥美拉唑+克拉霉素(15.0~20.0 mg/(kg·d), 2次/d]+甲硝唑[20.0 mg/(kg·d), 2次/d]治疗5 d[6]。
1.4 统计学分析

2 结 果
2.1 3组患儿早期肾损害情况
广义估计方程分析结果显示,初诊时, 3组间肾损害率差异无统计学意义(P>0.05); B组的早期肾功能损害率高于C组,差异有统计学意义(P<0.05); A组、C组早期肾损害率差异无统计学意义(P>0.05), 见表1。
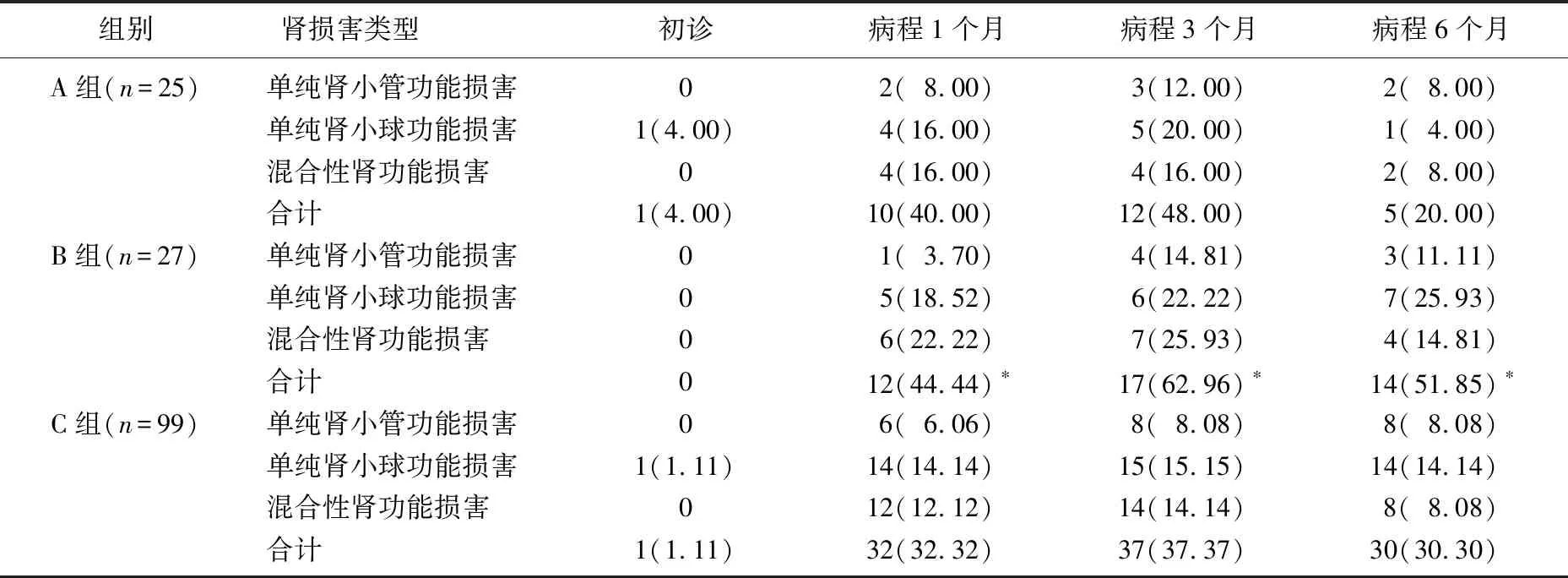
表1 3组患儿早期肾损害情况比较[n(%)]
与C组比较, *P<0.05。
2.2 3组患儿尿微量蛋白情况
病程3个月时, B组的α1-MG水平高于A组、C组,且B组的UAlb水平高于C组,差异有统计学意义(P<0.05); 病程6个月时, B组的β2-MG水平高于A组、C组,差异有统计学意义(P<0.05)。见表2。

表2 3组患儿各时点尿微量蛋白情况比较
β2-MG: β2微球蛋白; α1-MG: α1微球蛋白; TRF: 转铁蛋白; UAlb: 尿白蛋白; UIgG: 尿免疫球蛋白G。与B组比较, *P<0.05。
3 讨 论
儿童是HSP的主要发病人群,主要临床表现为非血小板减少性可触性紫癜,关节炎或关节痛,腹痛伴或不伴有消化道出血以及肾脏受累[6]。HSP患儿预后良好,大部分为急性、自限性病程,平均病程4周,但15%~60%的HSP患儿会在确诊后4~6个月经历1次及以上的复发,其长期预后取决于胃肠道或肾脏损害的严重程度和持续时间。HSP发病可能与感染、疫苗接种、食物、药物及遗传等因素有关[7], 越来越多的研究[8-10]表明Hp感染与HSP以及HSPN的发生有关。
本研究中, HSP患儿的Hp感染率为34.44%, 略低于相关研究[11-12]的结果,考虑可能与检测方法、地域差异有关。此外, B组的早期肾损害率高于C组,且B组的相关尿微量蛋白指标水平高于A组、C组,提示合并Hp感染的HSP儿童较非Hp感染者更易出现早期肾损害,而根治Hp可降低肾损害的发生率。分析机制,可能为Hp根除治疗后,减少了Hp对机体的刺激,从而减少了特异性抗体的产生,并清除了形成的抗原-抗体免疫复合物,减少了在肾脏的沉积,阻止了HSPN的发生、发展[13]。Hp感染可在患儿体内产生一些代谢产物,如细胞毒素(CagA)、空泡毒素(VacA)、热休克蛋白60(Hsp60)等,还可刺激机体产生细胞因子白介素(IL)-1、IL-6、IL-10、IL-12、肿瘤坏死因子(TNF)-α、TNF-γ等,这些细胞因子的紊乱在Hp致病机制中发挥着一定作用,同时可能加重了HSP患儿的免疫紊乱,加剧患儿肾损害[14]。本研究还发现,Hp根除治疗后,HSP患儿肾损害率显著下降,但其早期肾损害不会立即改善,可能与Hp感染后机体免疫紊乱的持续时间有关。
目前,明确肾脏受累严重程度的金标准是肾脏穿刺术,但其技术要求较高,为有创操作,很多患儿家属不能接受,故临床应用受限。尿微量蛋白检测具有高度敏感性、无创伤、与肾脏组织病理具有高度相关性的特点,是目前用于判断儿童早期肾损害的理想方法。尿β2-MG是体内除胎盘滋养层细胞及成熟红细胞外的所有细胞,特别是肿瘤细胞及淋巴细胞膜上组织相容性抗原(HLA)的轻链蛋白组分,由于分子量小且不与血浆蛋白结合,可自由经过肾小球滤入原尿,但原尿中99.9%的β2-MG在近端肾小管被重吸收,并在肾小管上皮细胞分解破坏,仅微量自尿中排出[15]。α1-MG是淋巴细胞和肝细胞产生的一种糖蛋白,原尿中的α1-MG约99%被近端肾小管上皮细胞重吸收并分解,故仅微量从尿中排泄[15]。β2-MG、α1-MG均是评估早期肾小管功能损伤的较理想的指标。正常情况下,血中的TRF无法通过肾小球滤过膜,当肾小球滤过膜损伤时,尿液中会出现较多大分子量的转铁蛋白[16]。生理状况下,UAlb几乎不能滤过肾小球,即使少量滤入原尿,也可被肾小管重吸收[17]。正常情况下,由于肾小球滤膜的分子筛作用,血中的IgG无法通过肾小球滤过膜,肾小球损伤时,会导致尿液中出现IgG。尿TRF、UAlb、UIgG指标可用于评估肾小球损伤程度,且当表现为TRF与UAlb异常而UIgG为阴性时,提示为选择性蛋白尿,如同时出现UIgG, 则提示非选择性蛋白尿[17]。本研究中, 71例HSP儿童出现尿微量蛋白异常,其中47例(66.20%)在尿微量蛋白异常时尿常规正常,故采用尿微量蛋白判断HSP患儿的早期肾损害情况是非常有益的。本研究还发现,HSP患儿肾损害以肾小球以及混合性肾功能损害为主,单纯肾小管受累较少,且α1-MG判断肾小管功能早期损害可能比β2-MG更敏感,而UAlb判断肾小球功能早期损害可能比TRF和UIgG更敏感。
综上所述,合并Hp感染的HSP儿童较非Hp感染者更易出现早期肾损害,行Hp根除治疗可降低肾损害的发生率。尿微量蛋白可作为监测HSP儿童早期肾损害的可靠指标,且其中α1-MG、UAlb比较敏感。本研究尚存在一些不足,如单一地区、样本量较小、随访时间偏短等,期待将来能进行大样本、多中心的前瞻性研究以及更长期的随访研究。

