转录因子XBP-1在胃癌组织中表达及其临床相关性分析*
李松翰, 罗 颖, 李朝晖, 颜决涌, 朱娉逸, 岑 威, 朱晓阳, 王锐东, 孙双一, 林刻智
(温州医科大学 1第一临床医学院, 2基础医学院形态学实验教学中心, 浙江 温州 325000)
胃癌是全球最常见的消化系统恶性肿瘤之一,中国作为胃癌发病的高危区域之一,我国每年新发病例在全球所占比例可达42%[1-2]。除肿瘤微环境与遗传易感因素外,幽门螺旋杆菌感染、基因调控及氧化应激等因素可能影响胃癌的发生、发展[3-4]。研究表明,需肌醇酶1α(inositol-requiring enzyme 1α, IRE-1α)-X盒结合蛋白1(X-box binding protein 1,XBP-1)信号转导通路作为内质网应激最重要的通路之一,与肿瘤生长、侵袭转移及耐药密切相关[5-6]。
XBP-1是一种含有锌指结构的转录因子。通常情况下,转录因子可以与信号通路共同作用,参与调控胚胎发育过程中的细胞分裂和分化。 XBP-1有2种剪切形式,即未剪切(XBP-1U)和已剪切(XBP-1S)。在内质网应激情况下,IRE1α激活XBP-1U转变为XBP-1S,这种动态平衡转变过程,将会诱导肿瘤细胞的凋亡或增殖[7]。相关研究指出,XBP-1的表达与急性髓系白血病、乳腺癌和多发性骨髓瘤等肿瘤发生发展相关[8-9],而在胃癌组织中XBP-1的表达水平及临床意义未见报道。我们前期采用胃癌基因芯片分析的方法,发现XBP-1基因在胃癌组织中表达较癌旁正常组织呈下调趋势,通过GEO数据库比对XBP-1基因在胃癌组织中表达与芯片检测结果一致。为进一步探究XBP-1在胃癌组织中的表达情况,本研究通过免疫组化、real-time PCR和Western blot等技术,结合临床病理数据以及患者生存期分析,明确XBP-1在胃癌组织中mRNA和蛋白水平的表达,并分析其临床意义。
材 料 和 方 法
1 材料
TRIzol试剂购自Invitrogen;ReverTra Ace逆转录试剂盒和SYBR Master Mix 荧光定量PCR试剂盒购自Toyobo;Gelred染料购自Biotium;配胶试剂盒购自上海碧云天生物公司;兔抗人XBP-1蛋白单克隆Ⅰ抗购自Abcam;HRP标记羊抗兔Ⅱ抗、羊血清和DAB显色剂购自北京中杉金桥生物公司;引物由华大基因科技股份有限公司合成。
2 方法
2.1组织标本采集及处理 本研究涉及的48对胃癌标本均取自温州医科大学附属第一医院2014~2015年期间接受手术的胃癌术后患者。胃癌的病理学诊断由医院病理科术后根据WHO的标准确诊。所有患者术前均未接受放疗或化疗,且在术后根据 NCCN临床实践指南:胃癌(2014.v1)接受严格化疗。胃癌组织及相对应癌旁组织(取自距癌灶2 cm处)的配对标本被分为2部分:一部分标本在手术切除后30 min内直接液氮冻存,以备RNA、蛋白的提取;另一部分标本经4%多聚甲醛固定,石蜡包埋,用于免疫组化检测。
2.2免疫组化观察 5 μm 的石蜡切片经二甲苯脱蜡、梯度乙醇至水、经微波修复,室温冷却, 3% H2O2阻断内源性过氧化氢酶,PBS清洗,羊血清封闭1 h后。甩去血清,直接滴加XBP-1特异性抗体,4 ℃冰箱孵育过夜。次日,室温下复温1 h。参照说明书,滴加羊抗兔II抗,37 ℃孵育30 min。PBS清洗,甩干。DAB显色。苏木素复染、盐酸酒精分化、流水蓝化、中性树胶封片。以Image-Pro Plus 6.0生物医学图像处理系统,测量XBP-1蛋白的表达量。
2.3Real-time PCR实验 cDNA第1链由提取自组织的RNA参照ReverTra Ace逆转录试剂盒说明书逆转录而来。反应结束后置于-20 ℃保存。以20 μL反应体系进行real-time PCR。相关引物序列信息见表1。反应体系包括:2 μL反逆转录产物,2 μL转录产物,2×SYBR Green I Master Mix,6 pmol上游引物,6 pmol下游引物。程序设定为:95 ℃ 10 min;95 ℃ 15 s、62 ℃ 1 min、72 ℃ 1 min,循环40次(StepOne Plus Real-Time PCR system)。所有样品均严格按照3个复孔进行实验。根据待测标本的Ct值,以GAPDH为内参照,采用相对定量法,以2-ΔΔCt表示标本中XBP-1相对表达量,其中ΔΔCt=(肿瘤CtXBP-1-肿瘤CtGAPDH)-(癌旁CtXBP-1-癌旁CtGAPDH)。在1×TAE缓冲液环境中,以琼脂糖凝胶电泳对PCR产物进行跑胶显影以进一步验证产物的特异性。
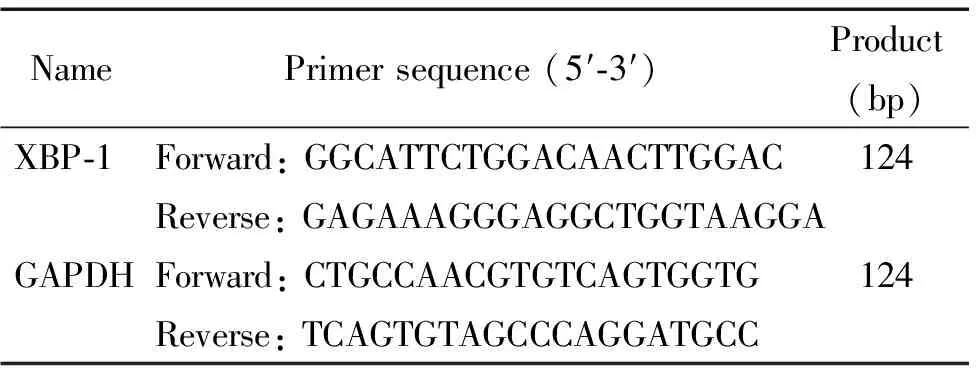
表1 引物序列
2.4Western blot实验 利用细胞核蛋白提取试剂盒提取胃癌组织和癌旁组织蛋白,每个点样孔中加入50细胞蛋白,90 V电泳30 min,120 V继续电泳至溴酚蓝条带迁移至底部。100 V、低温转膜45 min, 使用5%脱脂奶粉室温封闭2 h,加入1∶2 000稀释比例的I抗4 ℃封闭过夜, 加入1∶5 000浓度的II抗室温反应2 h,DAB法进行显色反应,利用ImageJ软件分析条带的灰度值,目的条带与内参照条带灰度值的比值表示XBP-1的相对表达量。
3 统计学处理
应用SPSS 19.0统计软件进行数据分析,所涉及的数据均以均数±标准差(mean±SD)表示,对免疫组化、real-time PCR及Western blot结果与各临床病理因素的相关性进行独立样本t检验、配对样本t检验。用Kaplan-Meier法对XBP-1高表达组与低表达组生存分析进行3年生存率分析,组间差异比较用log-rank检验。以P<0.05为差异有统计学意义。
结 果
1 胃癌组织中XBP-1 mRNA的表达下调
琼脂糖凝胶电泳结果显示XBP-1和GAPDH可在相应的位置见单一条带,见图1A。同时XBP-1与GAPDH的熔解曲线均为单一的尖峰,证明我们所建立的体系能够特异地扩增目的基因,见图1B。使用2-ΔΔCt法分析显示,肿瘤组织中XBP-1的mRNA 表达量相对于癌旁组织而言明显降低,仅为癌旁组织的0.439(P<0.01),见图1C。
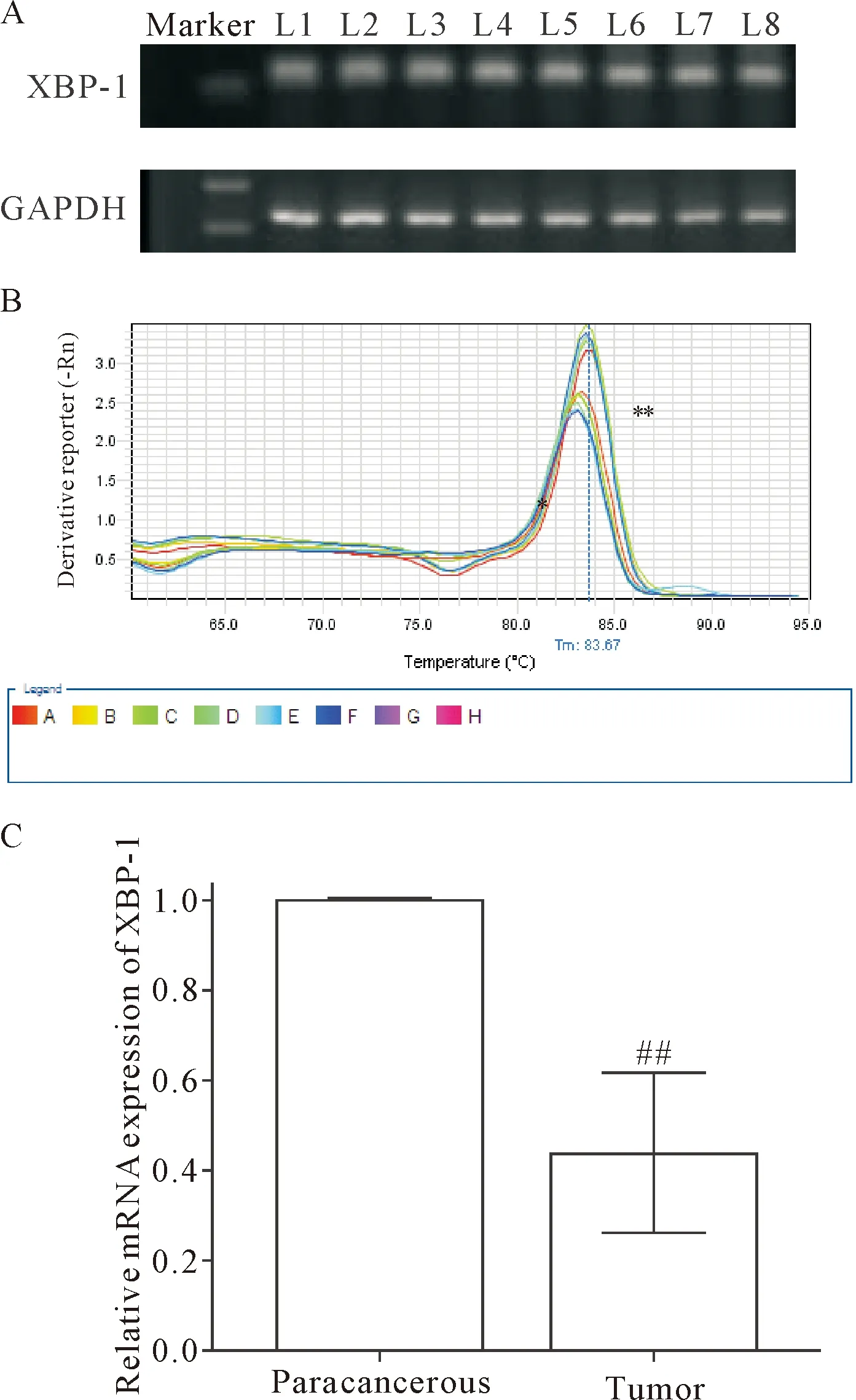
Figure 1.The expression of XBP-1 in human gastric cancer and paracancerous tissues at mRNA and protein levels. A: XBP-1 mRNA expression (L1~L8: paracancerous 1, tumor 1, paracancerous 2, tumor 2, paracancerous 3, tumor 3, paracancerous 4 and tumor 4, respectively); B: melting curve (*: GAPDH; **: XBP-1); C: the mRNA expression of XBP-1 was detected with real-time PCR. Mean±SD. n=20. ##P<0.01 vs paracancerous.
2 Western blot实验结果显示胃癌组织中XBP-1蛋白的表达下调
胃癌组织中XBP-1蛋白的表达水平显著低于与其配对的癌旁组织(P<0.01),总趋势与mRNA的表达情况相一致,见图2A。
3 免疫组化结果表明XBP-1蛋白在胃癌组织中表达下降
免疫组化结果显示在癌旁组织中,XBP-1主要表达在胃底腺壁细胞中,且染色呈强阳性,为棕褐色颗粒状,然而,在肿瘤组织中,XBP-1的表达显著降低甚至不表达。半定量分析免疫组化结果可见,XBP-1蛋白在胃癌组织中的表达水平显著低于癌旁组织(P<0.01),与real-time PCR及Western blot的结果一致,见图2B。同时通过对染色部位的分别统计,细胞核和细胞质中XBP-1蛋白表达的平均吸光度分别为0.225和0.141,其在胞核中的表达明显高于胞质(P<0.01)。
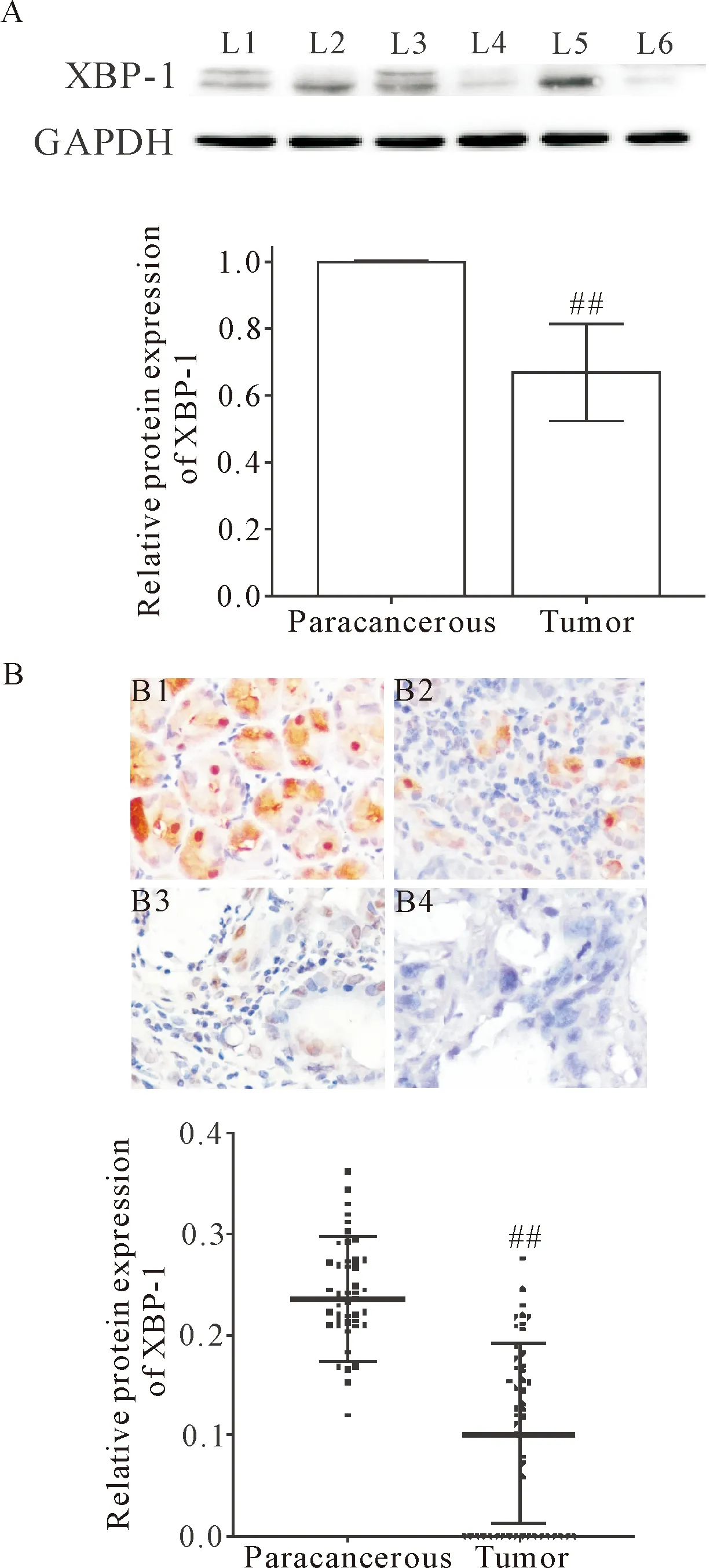
Figure 2.The protein expression of XBP-1 in the gastric cancer and paracancerous tissues detected by Western blot (A) and immunohistochemical staining (B, ×400). L1~L6: paracancerous 1, tumor1, paracancerous 2, tumor 2, paracancerous 3 and tumor 3, respectively. The Western blot images of XBP-1 showed two nearby bands, standing for its two isoforms, XBP-1U and XBP-1S. B1: paracancerous gastric tissue; B2: well differentiated tumor; B3: moderately differentiated tumor; B4: poorly differentiated tumor. Mean±SD.n=24 in A; n=48 in B. ##P<0.01 vs paracancerous.
4 XBP-1蛋白表达水平与胃癌临床病理特征的相关性分析
临床资料显示,XBP-1的表达水平与肿瘤分化程度有关,低分化或未分化的胃癌组织XBP-1蛋白表达水平相比中、高分化的组织显著降低(P<0.01);XBP-1的表达与性别、年龄、肿瘤大小、淋巴结转移、浸润深度和癌胚抗原等未见显著相关(P>0.05),见表2。
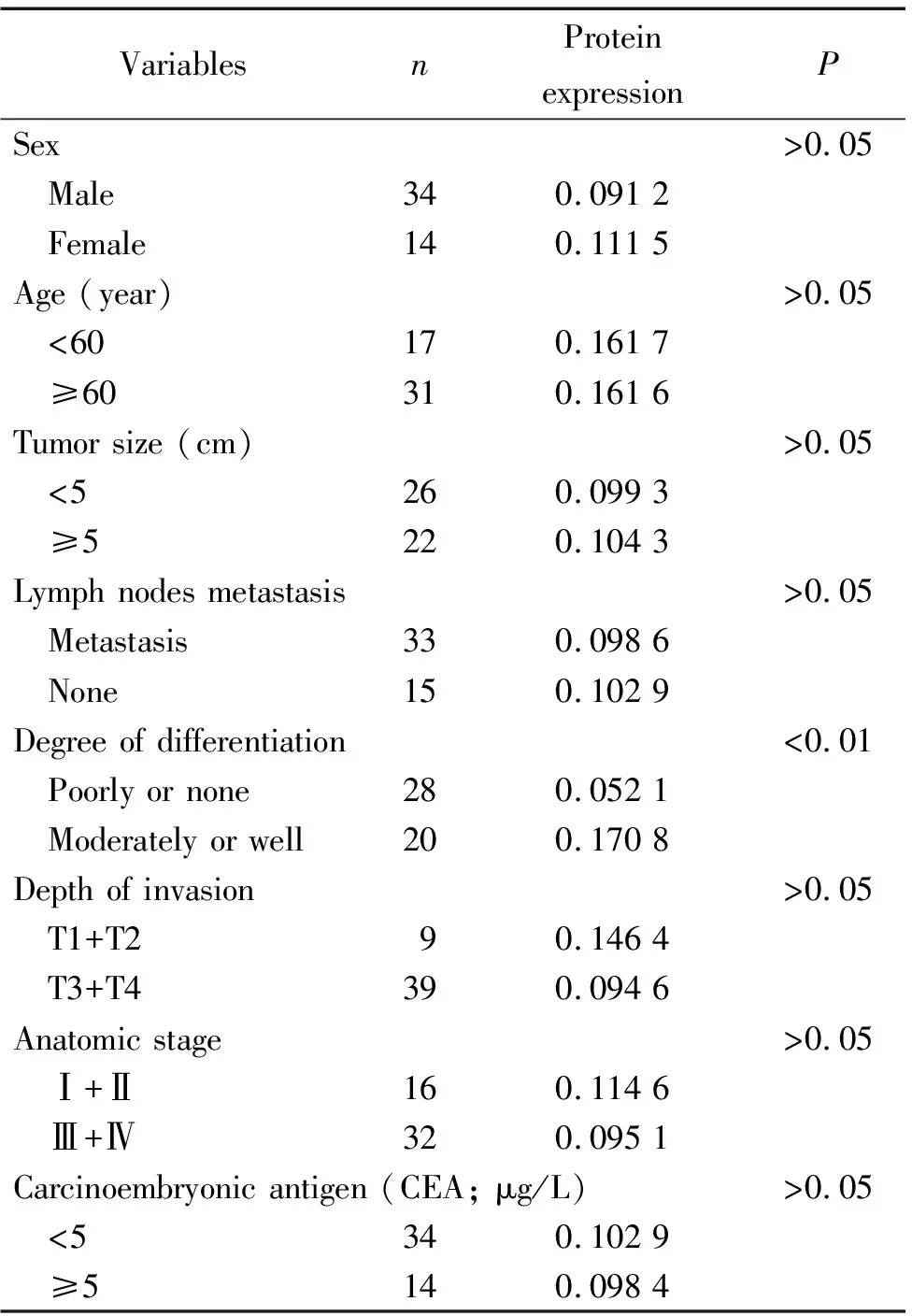
表2 48例胃癌组织中XBP-1蛋白表达水平与临床相关性分析
5 肿瘤组织中XBP-1表达水平与胃癌预后的相关性
根据成对的肿瘤组织和癌旁组织中XBP-1蛋白的平均吸光度值,将相对值≥1/3的样本设为高表达组,而相对值<1/3的样本设为低表达组(肿瘤vs癌旁组织),以Kaplan-Meier法对2组生存情况进行3年生存率分析,并使用log-rank检验对生存曲线的差异进行显著性检验。Kaplan-Meier生存分析表明,高表达组相对低表达组而言有明显的生存延长,表明XBP-1高表达的胃癌患者手术预后情况更优(P=0.007),见图3。因此,XBP-1可能是影响胃癌患者术后生存率的独立参考因素。
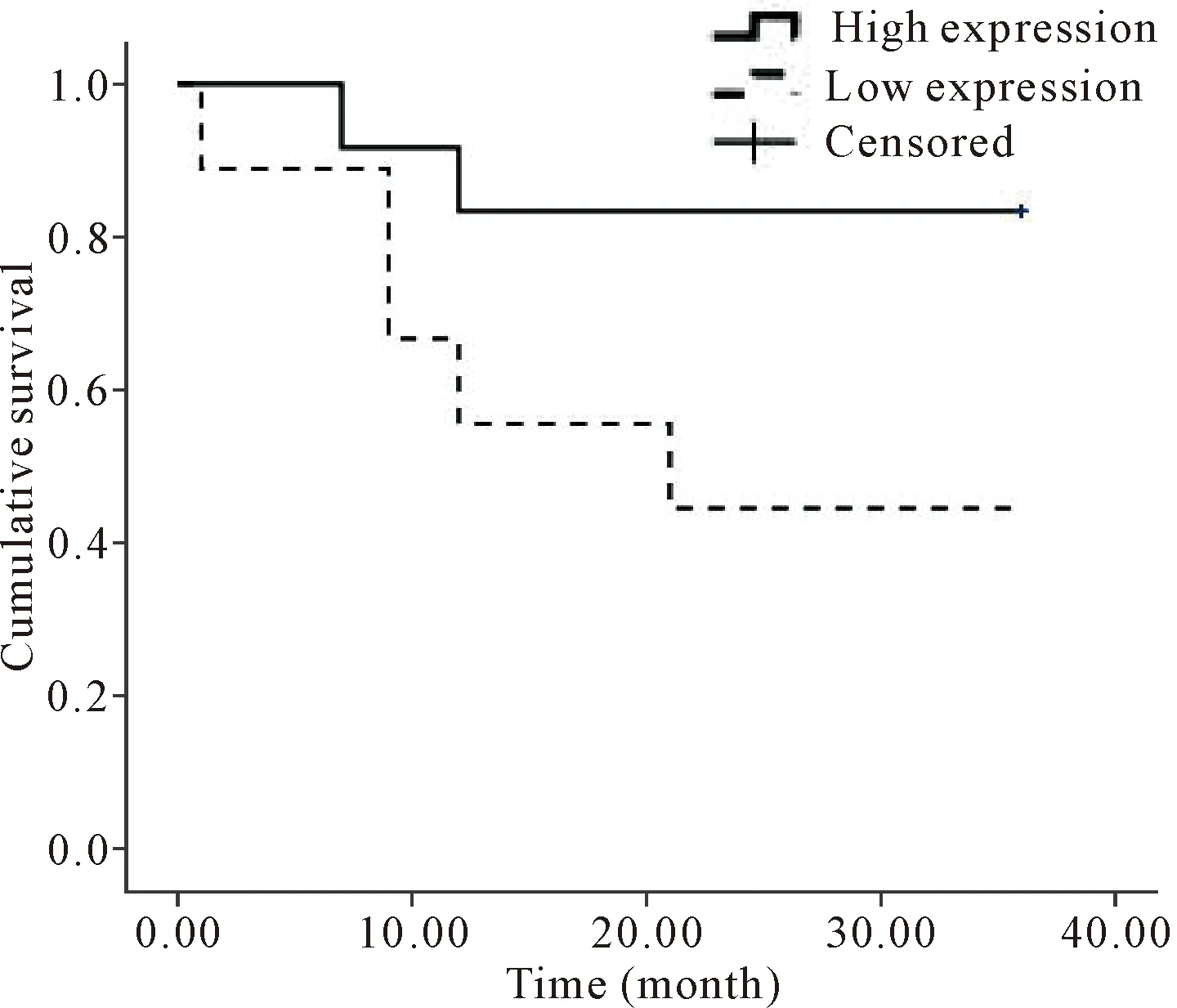
Figure 3.The survival curves for the patients with high and low expression of XBP-1 determined by immunohistoche-mistry.
讨 论
XBP-1蛋白与内质网(endoplasmic reticulum,ER)应激反应和未折叠蛋白反应(unfolded protein reaction,UPR)紧密相关,具有调节、控制免疫功能和细胞应激反应的相关基因的作用[10-11]。在分子生物学中, 转录因子是一类通过与特定DNA序列结合,激活或抑制下游基因,从而将遗传信息从DNA转录到信使RNA的过程的蛋白质[12]。有研究指出,转录因子具有MHC II类基因调控浆细胞分化,嗜酸性粒细胞分化,血管生成,病毒复制及内质网应激反应等功能。XBP-1还可能与阿尔茨海默病和克罗恩病的发生发展有关[13-14]。
我们通过免疫组织化学,Western blot法和real-time PCR方法分别检测了XBP-1的mRNA和蛋白水平表达情况,发现胃癌组织中XBP-1下调。免疫组化结果提示XBP-1蛋白主要表达在胃癌细胞的胞核中,而在细胞质中的表达明显低于核中的表达。与大多数其他基因在细胞核内进行转录生成mRNA不同的是,XBP-1的mRNA剪接发生在细胞质中,称为细胞质剪接,即为XBP-1U剪接生成XBP-1S的过程[15]。在这种情况下,可以解释为何在细胞核和细胞质中均有XBP-1表达但表达水平有明显差异。本研究发现XBP-1在胃组织中的细胞定位似乎位于壁细胞中。在胃底腺中主细胞和壁细胞占细胞的多数,而不同于主细胞和颈黏液细胞,壁细胞具有更多的内质网结构。XBP-1参与内质网应激反应的这一功能,在结构和功能相统一的角度上解释了其在生物学定位上表达于壁细胞中的原因。生存分析显示XBP-1与胃癌的预后显著相关。低表达水平反而预后较不乐观。临床病理特征分析表明,尽管XBP-1表达与性别、年龄、肿瘤大小、淋巴结转移、病理分期及常见肿瘤标志物CEA的临床病理特征无关,但提示XBP-1表达与分化程度呈正相关,在高分化、中分化和低分化的胃癌组织中,XBP-1的表达依次降低。病理分化程度是反映肿瘤恶性程度的重要指标,XBP-1表达水平与分化程度的关系提示了XBP-1表达的下调可能提示更具侵袭性的胃癌表型。
据报道有2种不同的XBP-1亚型,在UPR刺激下的非常规剪接将未剪接的XBP-1U的mRNA转化为剪接的XBP-1S[7]。而这2种亚型可能具有截然相反的生物学功能,将分别导致细胞凋亡或存活。XBP-1U可能上调过氧化氢酶的表达,而XBP-1S的作用则相反[16]。一些研究表明XBP-1S的上调可以保护细胞免于凋亡[11,17]。研究还表明,XBP-1U促进细胞凋亡,反应在临床随访上即具有良好的预后,而XBP-1S有利于肿瘤细胞存活,并与内分泌抵抗和不良预后相关[7],其促癌的机制可能和XBP-1S通过负调控抑癌基因TAp73的转录活性相关[18]。因此我们推断XBP-1在胃癌中的下调机制可能与XBP-1U/XBP-1S的比例失调有一定关系。这2种亚型在胃癌中的表达情况与相互关系可能与胃癌的发生发展机制密切相关,值得进一步的研究。
总之,作为一个潜在的肿瘤抑制因子,XBP-1基因在胃癌的发生和进展中起重要作用,其在胃癌肿瘤组织中蛋白与基因表达水平及临床相关分析的特点可为进一步研究胃癌相关转录因子XBP-1发挥抑癌效应及机制提供依据。为胃癌的未来治疗和预后评估提供新的临床辅助指标。

