齐墩果酸对肺腺癌A549细胞增殖及凋亡的影响及机制
李开瑞 刘 洁 李小娜 何迎春 徐朝军 宋 岚
1.湖南中医药大学研究生院,湖南长沙 410208;2.湖南中医药大学医学院,湖南长沙 410208;3.中医药防治眼耳鼻喉疾病湖南省重点实验室,湖南长沙 410208;4.湖南省中医药防治眼耳鼻咽喉疾病与视功能保护工程技术研究中心,湖南长沙 410208;5.湖南中医药大学第一附属医院胸心外科,湖南长沙 410000;6.湖南中医药大学中医学国内一流建设学科,湖南长沙 410000
肺癌是目前发病率和死亡率均居于首位的恶性肿瘤[1],肺腺癌是肺癌最常见的组织学类型,约占所有肺癌的50%。目前肺腺癌治疗主要以手术和放化疗为主,但术后的复发转移、放化疗等不良反应,严重影响患者的生活质量和生存率。目前靶向治疗[2]对非小细胞肺癌疗效较好,但前期基因检测、后期靶向药物费用高以及耐药问题都不容忽视[3]。因此,寻找更为安全有效适合的治疗方法是目前肺腺癌研究热点之一。中药在治疗癌症中效果明显,安全性高,能提高患者生活质量和生存率。齐墩果酸[4]是一种五环三萜类化合物,广泛存在于山楂、女贞子、夏枯草等中药材中,作为广谱抗菌药临床上用于护肝降酶、治疗急性肝炎[4]等,研究发现其还具有降脂、降糖、抗癌[5-6]等作用,本文主要研究齐墩果酸对A549细胞增殖及凋亡的影响,探究其相关作用机制。以期为其临床应用于治疗肺腺癌提供实验依据和理论支持。
1 材料与方法
1.1 细胞株
人肺腺癌A549细胞购自苏州北纳创联生物技术有限公司,由本实验室传代培养。
1.2 实验药物
齐墩果酸(上海金穗生物有限公司,货号:201804 03);顺铂(Cis,Sigma 公司,货号:P4394-25MG)。
1.3 主要试剂
DMEM-高糖培养基(Hyclone,货号:SH30022 02B);胎牛血清(Gibco,货号:A3160802);线粒体膜电位检测试剂盒(JC-1)(Solarbio,货号:M8650),Annexin VFITC/PI apoptosis Kit(联科生物,货号:70-AP101-100)。
1.4 主要仪器
全自动酶标分析仪(ELX800,BioTek 公司)、Cellometer Image Cytometer(K2,Nexcelom 公司)、CytationTM5细胞成像多功能检测系统(cytation5,BioTek 公司)、Odyssey-CLX 双色红外荧光成像系统(9140S/N CLX-1801,Gene 有限公司)。
1.5 实验方法
1.5.1 细胞培养 将A549置于含10%胎牛血清、1%青霉素-链霉素混合液的DMEM-高糖培养基,在37℃、5%CO2、湿度饱和培养箱中培养,取对数生长期细胞进行实验。
1.5.2 MTT 法检测细胞增殖 取对数生长期细胞,调整单细胞悬液浓度,铺于96孔板,每孔100 μL、4000个细胞,随机分为对照组、不同浓度齐墩果酸(0.625、1.25、2.5、5、10 μmol/L)组、阳性对照组(Cis,0.004 g/L)。待细胞贴壁后,弃尽原培养基,按实验分组每孔加入200 μL 药物,每个浓度设置5个复孔,分别培养24、48、72 h 后,弃尽原培养基后每孔加入100 μL 0.5 g/L MTT 溶液,于培养箱中继续培养4 h,弃尽MTT 溶液,每孔加入100 μL 二甲基亚砜(DMSO)于脱色摇床上室温避光震荡10 min,用酶标仪检测490 nm 处各孔吸光度值(A),计算细胞相对增殖率,细胞增殖率=(实验组A 值-空白组A 值)/(对照组A 值-空白组A 值)×100%。实验重复3次。
1.5.3 实时无标记细胞分析技术(RTCA)监测细胞增殖 取对数生长期的细胞,调整单细胞悬液浓度,铺于RTCA 电子检测板(E-Plate),每孔100 μL、4000个细胞,实验分组同“1.5.2”。待细胞指数(CI)达到1.0时,按实验分组每孔加入200 μL 药物,每组3个复孔,监测72 h 以上,实验重复3次。
1.5.4 Hoechst 33342染色法检测细胞凋亡 取对数生长期的细胞,调整单细胞悬液浓度,均匀铺于6孔板,1×105个细胞/孔,随机分为对照组、不同浓度齐墩果酸(1.25、5 μmol/L)组、阳性对照组(Cis,0.004 g/L),处理48 h 后,弃尽原培养液,PBS 清洗2次,每孔加入Hoechst 33342染色液(0.01 g/L)1 mL,避光染色30 min,弃尽染色液,PBS 清洗3次,CytationTM5拍照。实验重复3次。
1.5.5 线粒体膜电位检测细胞凋亡 取对数生长期的细胞,调整单细胞悬液浓度,均匀铺于6孔板,1×105个细胞/孔。实验分组同“1.5.4”,处理48 h 后,弃尽原培养液,PBS 清洗2次,每孔加入1 mL JC-1染色工作液,避光染色30 min,弃染色液后PBS 洗涤2次,于CytationTM拍照。实验重复3次。
1.5.6 Annexin V-FITC/PI 双荧光染色法检测细胞凋亡 取对数生长期的细胞,调整单细胞悬液浓度,均匀铺于100 mm 培养皿,6×105个细胞/皿,实验分组同“1.5.4”,处理48 h,收集细胞离心(1000 r/min,3 min),PBS 清洗2次,每管加入1×Binding Buffer 100 μL 重悬,随后加入5 μL FITC 和10 μL PI,室温避光染色5 min,最后加入1×Binding Buffer 100 μL 终止染色,于K2检测。实验重复3次。
1.5.7 Western blot 检测蛋白表达水平 取对数生长期的细胞,调整单细胞悬液浓度,均匀铺于100 mm培养皿,实验分组同“1.5.4”,处理48 h 后,PBS 清洗两遍,每皿加入80 μL 裂解液于冰上裂解30 min,离心(12 000 r/min,10 min)收集蛋白,定量,配制上样体系,于12% SDS-PAGE 胶电泳,转至PVDF 膜,5%脱脂牛奶室温封闭1 h,敷育一抗过夜,TBST 洗膜5次,每次6 min,室温敷育荧光二抗2 h,TBST 洗膜5次,每次6 min,于Odyssey-CLX 扫膜。实验重复3次。
1.6 统计学方法
采用SPSS 21.0统计软件处理数据,计量资料服从正态分布用均数±标准差()表示,多组间比较采用单因素方差分析,满足方差齐性,多重比较采用LSD-t 检验,方差不齐者采用Dunnet T3检验;计量资料不服从正态分布采用秩和检验。以P <0.05为差异有统计学意义。
2 结果
2.1 齐墩果酸对A549细胞增殖的影响
MTT 法检测结果显示,不同浓度齐墩果酸组分别处理A549细胞24、48、72 h 后的细胞增殖率均低于对照组(P <0.01)。见图1。RTCA 结果显示,不同浓度齐墩果酸能够抑制A549细胞增殖。见图2。RTCA 和MTT 实验结果基本一致,选择增殖抑制效果较好的低浓度齐墩果酸(1.25、5 μmol/L)作用48 h 进行后续实验。
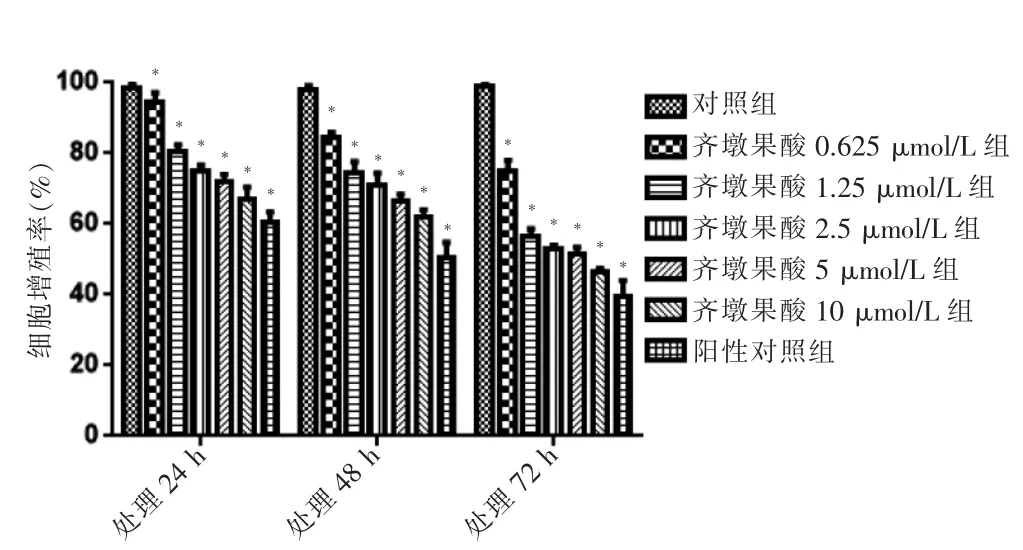
图1 MTT 法检测齐墩果酸对A549细胞增殖的影响(n=3)
2.2 齐墩果酸对A549细胞凋亡的影响
Hoechst 33342染色法结果显示,对照组细胞核染成均匀淡蓝色,而各加药组细胞部分细胞核呈颗粒状亮蓝色,伴有细胞核固缩、边集、碎裂等。与对照组比较,各加药组荧光强度明显增强,差异有统计学意义(P <0.05或P <0.01)。见图3(封三)。JC-1染色结果显示,与对照组比较,各加药组染色后的红色荧光强度明显下降,绿色荧光强度显著增强(P <0.05或P <0.01),提示细胞线粒体膜电位下降。见图4(封三)。Annexin V-FITC/PI 双荧光染色结果显示,与对照组比较,各加药组细胞凋亡明显增加(P <0.05或P <0.01)。见图5。

图2 RTCA 监测齐墩果酸对A549细胞增殖的影响

图3 Hoechst 33342染色法检测齐墩果酸对A549细胞凋亡的影响(n=3,200 um,100x)

图4 线粒体膜电位检测齐墩果酸对A549细胞凋亡的影响(n=3,100μm,200x)

图5 流式细胞仪检测齐墩果酸对A549细胞凋亡的影响(n=3)
2.3 齐墩果酸对A549细胞增殖及凋亡相关蛋白表达水平的影响
齐墩果酸能够下调抗凋亡蛋白XIAP、Survivin、Bcl-2的表达,上调促凋亡蛋白Bax、cleaved caspase 3、cleaved caspase 8的表达,与对照组比较,差异有统计学意义(P <0.05或P <0.01)。见图6。
3 讨论
肺癌作为发病率和死亡率增长最快的恶性肿瘤,严重威胁了人们健康和生命安全,现常用的治疗手段,具有一定的局限性、昂贵的治疗费用、难以逆转的毒副作用等不容忽视的缺点,因此从安全性高、疗效确切、不宜耐药、相对廉价的中药入手,寻找更合适的治疗方法及药物是研究的重点。
在以往的研究中发现,齐墩果酸对肝癌[7]、乳腺癌[8]、胰腺癌[9]、结肠癌[10]、肺癌[11]等肿瘤细胞均有一定的作用,但在A549细胞方面相关研究较少且不够深入,有待进一步研究拓展。本研究通过MTT 及RTCA检测齐墩果酸对A549细胞增殖的影响,结果发现,不同浓度齐墩果酸对A549细胞增殖均有显著的抑制作用,且通过RTCA 图像可以初步判断齐墩果酸能够造成A549细胞DNA 损伤[12-13]使其失去复制能力,进而抑制其增殖。Hoechst 33342染色观察细胞形态,发现对照组呈均一的淡蓝色,齐墩果酸干预的实验组部分细胞核呈颗粒状亮蓝色,并伴有细胞核固缩、边集、碎裂,出现凋亡小体等明显的凋亡特征。有研究显示,齐墩果酸可以下调线粒体膜电位促进细胞凋亡[7],本研究采用JC-1检测也发现,与对照组的红色荧光比较,随着齐墩果酸浓度的提高绿色荧光的占比也随之升高,提示线粒体膜电位降低,出现细胞凋亡。同时流式细胞仪检测结果显示,与对照组比较,不同浓度齐墩果酸均能诱导A549细胞凋亡,以早期凋亡为主,高浓度组的抑制率优于低浓度组。已有研究提示,齐墩果酸的诱导凋亡作用主要通过调节Bcl-2家族表达[14]、上调抑癌基因p53的表达[15]、诱导活性氧的产生[16]等途径发挥作用。本研究发现,齐墩果酸可以抑制A549细胞Bcl-2表达、上调Bax 表达。另外,本研究还发现,齐墩果酸可以下调A549细胞XIAP 和Survivin 的表达。XIAP[17]和Survivin[18]是凋亡抑制蛋白家族的两个重要成员,许多中药单体,如阿魏酸[19]、白藜芦醇[20]等均通过下调其表达发挥抗肿瘤作用。以上均表明齐墩果酸可以诱导A549细胞凋亡。根据以上结果推测齐墩果酸可能通过诱导A549细胞凋亡抑制细胞增殖。
另外,研究显示,齐墩果酸可以激活caspase 蛋白酶家族[21],进一步实验表明,齐墩果酸处理后A549细胞中cleaved caspase 3和cleaved caspase 8均表达上调。死亡受体途径由caspase 8直接激活caspase 3或是caspase 8通过激活Bid 增加线粒体通透性触发线粒体释放促凋亡因子激活caspase 3导致细胞凋亡。线粒体途径可能是通过DNA 损伤等激活Bcl-2家族促凋亡因子增加线粒体的通透性进而导致细胞凋亡。因此,推测齐墩果酸可能是通过死亡受体途径或线粒体途径诱导A549细胞凋亡,具体机制有待进一步研究。
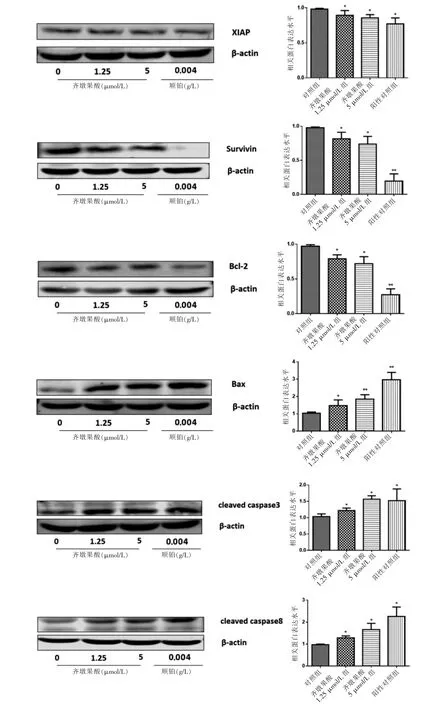
图6 齐墩果酸对A549细胞增殖及凋亡相关蛋白表达水平的影响(n=3)
综上所述,齐墩果酸可能通过死亡受体途径或线粒体途径诱导A549细胞凋亡,抑制其增殖。

