急性痛风性关节炎大鼠中IL-17和NF-κB 的表达和意义
沈瑞明 钟良宝 郑颜萍 梁海琴
海南医学院第一附属医院肾病风湿科,海南海口 570102
急性痛风性关节炎(acute gouty arthritis,AGA)是尿酸盐沉积关节而引起的一种强烈的急性炎性反应,然而其确切机制尚未完全明了。其中,炎性反应中有诸多机制参与该过程,研究表明,白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素18(interleukin-18,IL-18)、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)等炎症因子参与了痛风的进程,且它们之间相互作用、相互促进[1-2]。白细胞介素17(interleukin-17,IL-17)主要由辅助性T 细胞17(T helper cell 17,Th17)产生,参与先天和适应性免疫应答,与多种自身免疫病的发病有关[3-4]。迄今为止,对IL-17在AGA 中的作用知之甚少。近期的研究表明,先天免疫参与了痛风的发病,痛风患者血清IL-17表达水平明显升高[5-6]。研究表明,核因子κB(nuclear factor kappa-B,NF-κB)是炎症、免疫等细胞反应的初级转录因子,调节众多的细胞因子的表达。NF-κB 是许多炎症相关基因转录调控的枢纽[7]。IL-17与NF-κB 在AGA 中的表达尚鲜见报道。本研究通过建立AGA 模型,研究IL-17、NF-κB等在AGA 患者血清中的表达,从而探讨两者在AGA 中作用机制。
1 对象与方法
1.1 实验动物
SPF 级雄性Wistar 大鼠,质量(200±20)g,由海南医学院实验动物中心提供,实验动物生产许可证号:HNXK(琼)2017-0018。
1.2 主要仪器与试剂
尿酸钠购自美国Sigma 公司,其他试剂均为分析纯。p-NF-κB p65抗体购于美国Abcam 公司,大鼠IL-1β、IL-17及TNF-α 试剂盒均为美国R&D 公司进口分装酶联免疫吸附法(ELISA)检测试剂盒。
1.3 实验分组与处理
1.3.1 动物分组 45只SD 大鼠按随机数字表法分为对照组(9只)和模型组(36只),模型组分为4个亚组:6、12、24 h 及72 h,每组9只。
1.3.2 造模 适应性喂养1周,AGA 大鼠模型造模方法参照Coderre[8]方法制作,对照组注射等体积生理盐水。造模后各组大鼠右后踝关节均出现肿胀,造模成功。
1.4 观察指标及检测方法
1.4.1 一般情况观察 观察大鼠造模前后活动、进食、精神情况、体重、步态等情况。
1.4.2 各组大鼠血清炎症因子测定 造模后于相应时间点,用3%戊巴比妥钠(40 mg/kg)腹腔注射麻醉,腹静脉取血4~6 mL,室温静置25 min 后置3500 r/min离心机离心10 min,用吸液管取上清液,ELISA 法测定IL-1β、IL-17及TNF-α 水平。
1.4.3 各组大鼠滑膜组织炎症因子测定 造模后于相应时间点,过量麻醉处死各组大鼠,置于有冰块的干燥托盘内快速分离出右踝关节及周围软组织,切取滑膜组织,制成匀浆,4℃下8000 r/min 离心5 min 后取上清液,ELISΑ 法测定IL-1β、IL-17及TNF-α 水平。
1.4.4 蛋白印迹法(Western blot)检测关节滑膜组织NF-κB 的表达 过量麻醉处死大鼠,取受试关节上下5 mm 的滑膜组织,置于冰上匀浆,按照说操作明书提取总蛋白,BCA 法测定蛋白浓度,Western blot 检测滑膜组织中p-NF-κB 的表达。
1.5 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料数据用均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用LSD 检验;以P <0.05为差异有统计学意义。
2 结果
2.1 一般情况
45只大鼠均进入结果分析,造模后大鼠烦躁,右后踝关节明显红肿、活动受限,对照组无烦躁等表现,右后踝关节较造模前相比略有增粗,72 h 后模型组大鼠烦躁、关节红肿、活动受限明显减轻。
2.2 AGA 大鼠血清及滑膜中的炎症因子变化
模型组血清和滑膜中IL-1β、IL-17及TNF-α 的水平均明显高于正常对照组,差异有高度统计学意义(P <0.01)。模型组中,6 h 后随时间的变化,大鼠血清和滑膜中IL-1β、IL-17及TNF-α 的水平逐渐下降(P <0.01)。见表1~2。
表1 各组大鼠血清中各炎症因子水平的比较(ng/L,,n=9)
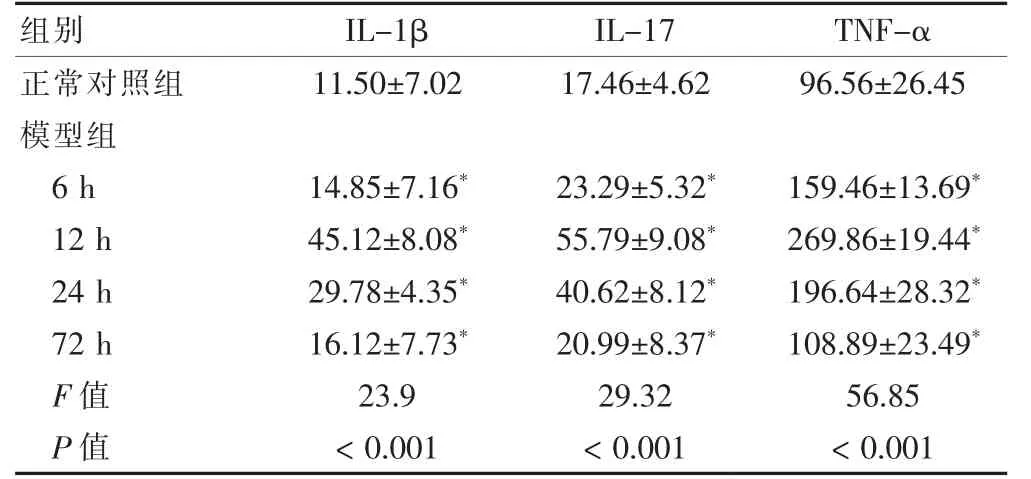
表1 各组大鼠血清中各炎症因子水平的比较(ng/L,,n=9)
注:与对照组比较,*P <0.01。IL-1β:白细胞介素1β;IL-17:白细胞介素17;TNF-α:肿瘤坏死因子-α
表2 各组大鼠滑膜中各炎症因子水平的比较(ng/L,,n=9)
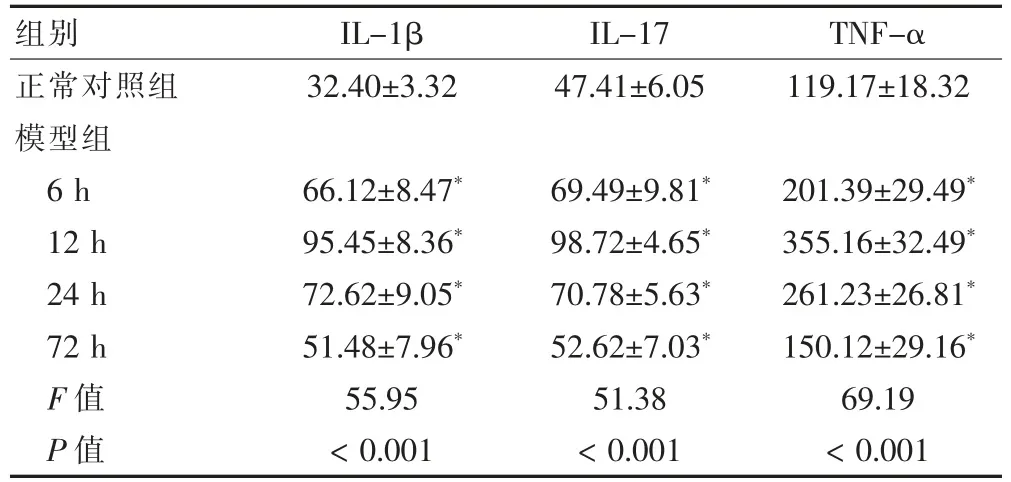
表2 各组大鼠滑膜中各炎症因子水平的比较(ng/L,,n=9)
注:与对照组比较,*P <0.01。IL-1β:白细胞介素1β;IL-17:白细胞介素17;TNF-α:肿瘤坏死因子-α
2.3 关节滑膜组织中p-NF-κB p65的表达
造模后6 h,p-NF-κB p65的表达量较对照组明显升高(P <0.01),12 h 其表达量达到顶峰,但在造模后24 h 开始下降,72 h 表达量显著下降,但仍高于正常;造模后12 h,p-NF-κB p65的表达量显著高于6 h(P <0.01),24 h 后其表达量明显低于12 h(P <0.01),72 h 后其表达量显著低于24 h(P <0.01)。见图1。
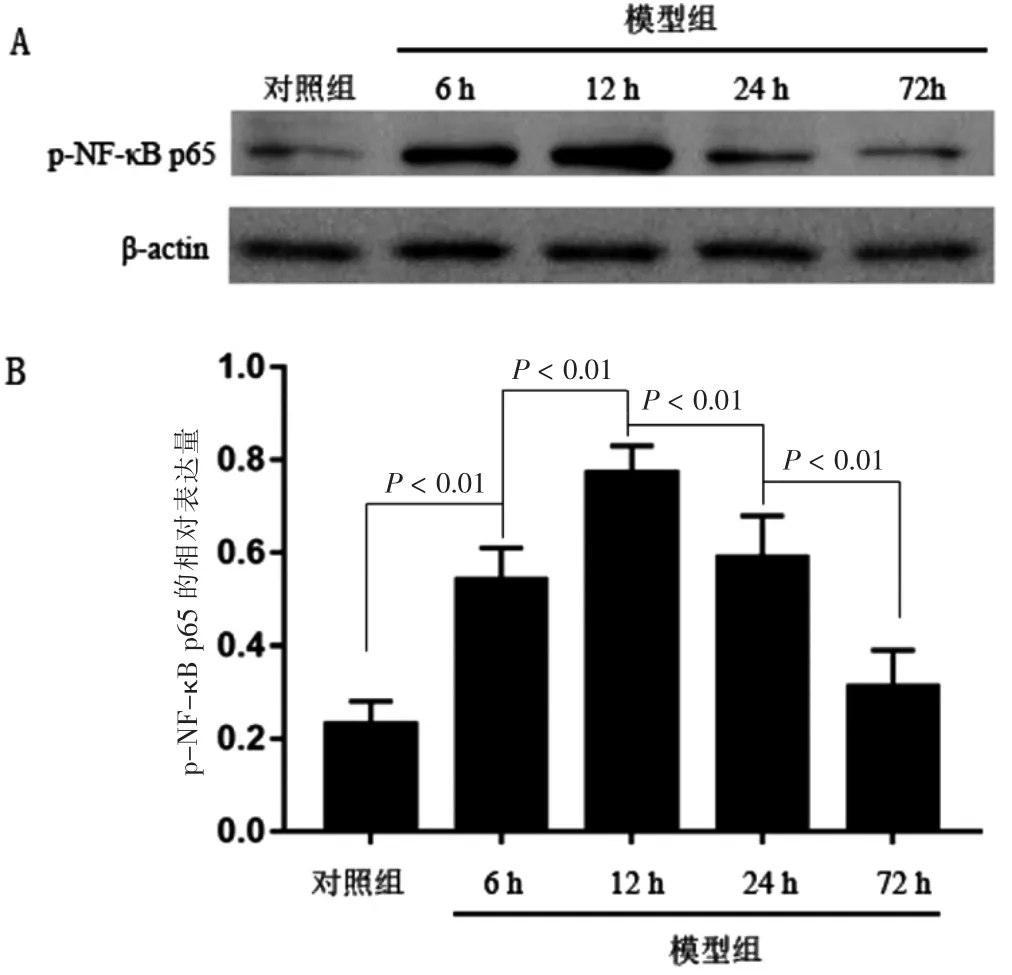
图1 急性痛风性关节炎大鼠关节滑膜组织中p-NF-κB p65的表达
3 讨论
痛风是由关节和软组织中的尿酸单钠(MSU)晶体沉积诱发的具有自限性和剧烈疼痛等特点的炎症性疾病,可导致急性或慢性关节炎。目前,普遍认为痛风性关节炎主要是由中性粒细胞介导的炎性反应,尿酸盐晶体能够引发白细胞和滑膜细胞的炎性反应,触发细胞因子和其他炎症介质的释放,从而吸引更多的中性粒细胞聚集,吞噬结晶的中性粒细胞释放溶酶体酶,导致组织损伤,从而放大局部炎性反应[9]。MSU 晶体是炎症的有效诱导剂,可以引发、放大和维持强烈的炎性反应[6,10]。然而,这些晶体引发急性炎症的机制尚不清楚。
IL-17是具有广泛生物学活性的细胞因子,参与了体内大量的炎性反应,在炎症性疾病的发生及发展过程中发挥重要作用[11-12]。NF-κB 是重要的转录调节因子,调控体内诱导趋化因子、细胞因子、补体等细胞因子的转录[13]。近年来,NF-κB 信号通路被认为与AGA 的发病及炎性反应密切相关[14]。NF-κB 参与了调控AGA 重要细胞因子的表达,这些细胞因子对免疫细胞的活化、增殖、浸润、趋化和分泌起着直接的调控作用[15]。在AGA 时,活化的核转录因子NF-κB 进入细胞核,启动靶基因并促使靶基因转录,进而调控下游基因的表达,从而诱导IL-1β、IL-18、TNF-α等细胞因子的分泌,IL-1β、IL-18、IL-23等相互作用,促进Th17细胞分化,从而产生增强局部炎症的IL-17[16]。相关性分析表明IL-17表达不仅与AGA 活动呈正相关,而且与IL-1β 的血清水平相关[12]。既往研究认为,IL-1β 被认为是AGA 调节的关键因素[17-18]。近期的研究表明,IL-1β 在IL-17-γδT 细胞向IL-17+γδT 细胞的分化中起了重要的作用,IL-17可能是IL-1β 的下游促炎细胞因子[3,19],它可作为AGA 的生物标志物之一。
本研究结果表明,大鼠在AGA 造模后,精神、进食、活动明显减少,右后踝关节肿胀、活动受限,随时间的变化,其精神、活动逐渐改善,踝关节肿胀逐渐减轻。与对照组比较,造模后6 h,大鼠血清及滑膜中IL-1β、IL-17及TNF-α 表达明显增高,12 h 达顶峰,24 h 逐渐降低。表明大鼠关节腔注射尿酸钠后,迅速诱发关节及周围组织的炎性反应,激活IL-1β 促使趋化因子、炎性因子等细胞因子发挥促炎作用,导致单核巨噬细胞分化、中性粒细胞释放、炎症复合体活化等,T 细胞分化产生IL-17,诱发痛风急性炎症[20];此外,IL-1β 可激活破骨细胞使其分化,并作用于神经元,触发机体对炎症所致疼痛反应的过度敏感[21]。而TNF-α 又能通过相关信号通路促使IL-1β、IL-17等细胞因子分泌,中性粒细胞、单核巨噬细胞出现吞噬活性并释放氧自由基及蛋白水解酶,导致尿酸盐沉积处出现充血、水肿,促使大量炎症细胞浸润,并不断加重。同时,磷酸化NF-κB p65的表达水平在造模后6 h明显增高,12 h 表达最高,24 h 逐渐下降,提示AGA 后,NF-κB 被激活,活化的NF-κB 进入细胞核,完成相关炎性基因的转录,启动IL-17、IL-1β、TNF-α等炎症因子的表达,促进炎症级联反应,导致AGA 炎性反应发生,随实验的进展,关节炎逐渐改善,炎症逐渐减轻,p-NF-κB p65的表达水平逐渐下降,进一步证实了NF-κB 信号通路与AGA 的发病密切相关。
综上所述,AGA 后,IL-17与NF-κB 的表达先迅速增高,随时间的变化,逐渐下降,两者之间变化与AGA 过程密切相关。预示IL-17可能作为AGA 的一种新的生物标志物,可用于AGA 的诊断与治疗评估。尽管AGA 免疫机制尚未完全明了,然而痛风急性炎症过程中IL-17与NF-κB 之间的相互关系,为该病的治疗提供了新思路和切入点。

