组蛋白在脓毒症相关细胞因子分泌及细胞毒效应中的作用研究
赵宏霞,梁奕洋,刘 瑜,余洁明,刘海英
(南方医科大学附属深圳市妇幼保健院PICU,深圳518028)
脓毒症(Sepsis)是指疑似或证实感染引起的失控性全身炎症反应,是PICU最常见病种,也是导致患儿死亡的主要原因[1,2]。组蛋白是真核细胞中一类高度保守的蛋白质,近年研究显示游离组蛋白可与以TLR-4为主的多种TLR结合,激活下游信号转导通路,引起内皮细胞损伤、免疫细胞快速凋亡等类内毒素效应,是脓毒症始动和进展的重要因素[3,4]。作者前期研究发现血清hH4与儿童脓毒症疾病严重程度及预后可能存在相关性[5]。本研究通过以不同浓度组蛋白刺激THP-1细胞,采集不同时间节点的上清液,测定其中炎症反应相关细胞因子白细胞介素(interleukin,IL)1β、IL-10、肿瘤坏死因子α (tumor necrosis factor-α,TNF-α) 的含量,并对比用IgG及TLR-4抗体干预后,高浓度组蛋白组中上述细胞因子的变化,研究组蛋白对THP-1的作用及其可能机制;以TLR4抗体干预组蛋白环境中孵育的THP-1及HMEC,通过LDH水平及流式细胞计数评价组蛋白致细胞损伤及凋亡情况,对比未干预及IgG干预组,探讨组蛋白对内皮细胞及单核细胞的作用及其可能机制,并比较TLR-4抗体干预后THP-1上清细胞因子水平的变化率和凋亡细胞比例的变化率,研究TLR-4抗体在抗组蛋白致炎作用中的可能机制。
1 材料与方法
1.1 实验材料
人微血管内皮细胞、人单核细胞购自上海中乔新舟生物科技有限公司,小牛胸腺组蛋白购自瑞士Roche公司,鼠源IgG2b单克隆抗体及抗人TLR-4抗体购自英国Abcam公司。
1.2 实验方法
1.2.1组蛋白介导THP-1细胞因子产生作用研究
① 组蛋白刺激实验
细胞饥饿后,将细胞分成对照组(细胞+10 μl/ml PBS),低(10 μg/ml)、中(25 μg/ml)、高(50 μg/ml)实验组,IgG干预组和TLR-4抗体干预组,各组在37℃、5% CO2培养箱内孵育培养24 h,分别收集第6、24 h上清液。
② 测定IL-1β、IL-10、TNF-a水平
各细胞因子水平检测过程严格按试剂盒说明书操作。
1.2.2组蛋白致THP-1及HMEC损伤作用研究
① 组蛋白刺激(两种细胞方法相同)及抗体干预
细胞饥饿后分为低对照组(仅细胞+无血清培养液)、高对照组(细胞+无血清培养液,后续加入2% Triton X-100)、组蛋白处理组(加入50 μg/ml组蛋白)、IgG处理组(加入50 μg/ml组蛋白+5 μg/ml IgG2b)、TLR-4抗体处理组(加入50 μg/ml组蛋白+5 μg/ml TLR4抗体)、空白对照组;各组继续培养箱内孵育24 h,最后1 h在高对照组中加入Triton X-100,收集孵育后各组细胞上清液。
② 测定两种细胞上清液LDH值
按LDH分析试剂盒说明操作。
③ 流式细胞术检测细胞凋亡情况
对各组细胞行Annexin V-FTTC/PI染色后以流式细胞仪检测,步骤如下:收集各组细胞,PBS洗涤一次,重悬细胞后加入5 μl FITC-Annexin V和10 μl PI染色液;充分混匀后室温下避光染色15 min;补充缓冲液并上机分析各组凋亡情况。
1.3 数据处理与分析
数据整理及分析应用SPSS 23,图表绘制釆用Prism 8.0,流式细胞检测结果以Flowjo 10.4进行处理。THP-1细胞各实验组细胞因子水平分别与对照组两两间比较采用Student’s t检验;LDH漏出率组间比较采用Mann-Whitney U检验。均以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度组蛋白环境中THP-1上清液各细胞因子水平分析
与空白组比较,在加入外源性组蛋白处理的实验组中,10 μg/ml处理组THP-1上清液中IL-1β水平无明显变化,IL-10、TNF-α水平不同程度升高,差异显著;25 μg/ml及50 μg/ml处理组中三种细胞因子水平均有不同程度升高,组间比较有统计学差异,其中IL-1β、IL-10浓度变化呈剂量及时间依赖性(见图1)。
2.2 TLR-4及IgG抗体干预高浓度组后各细胞因子水平分析
加入IgG抗体的培养基培育6 h、24 h后THP-1细胞上清液中各炎症因子水平与不含抗体的组别无显著差异;加入TLR-4抗体组中各炎症因子水平与较照组及IgG干预组相同时间节点所测炎症因子水平均显著下降(见表1)。
2.3 组蛋白体外细胞毒作用分析
与空白对照组比较,加入50 μg/ml外源性组蛋白处理后孵育24 h的THP-1及HMEC细胞上清液中LDH含量显著升高,细胞凋亡比例也显著升高;加入组蛋白及普通IgG的培养基中,细胞上清液LDH含量与单纯加入组蛋白的实验组比较无统计学差异;与仅加入组蛋白的组别相比,同时加入组蛋白及TLR-4抗体的组别,LDH含量显著降低,细胞凋亡比例亦显著下降(见表2,图2至图3)。THP-1细胞组中,经TLR-4抗体干预的与仅接受组蛋白刺激组比较,凋亡细胞比例的变化率高于细胞因子水平变化率(见表3至4)。
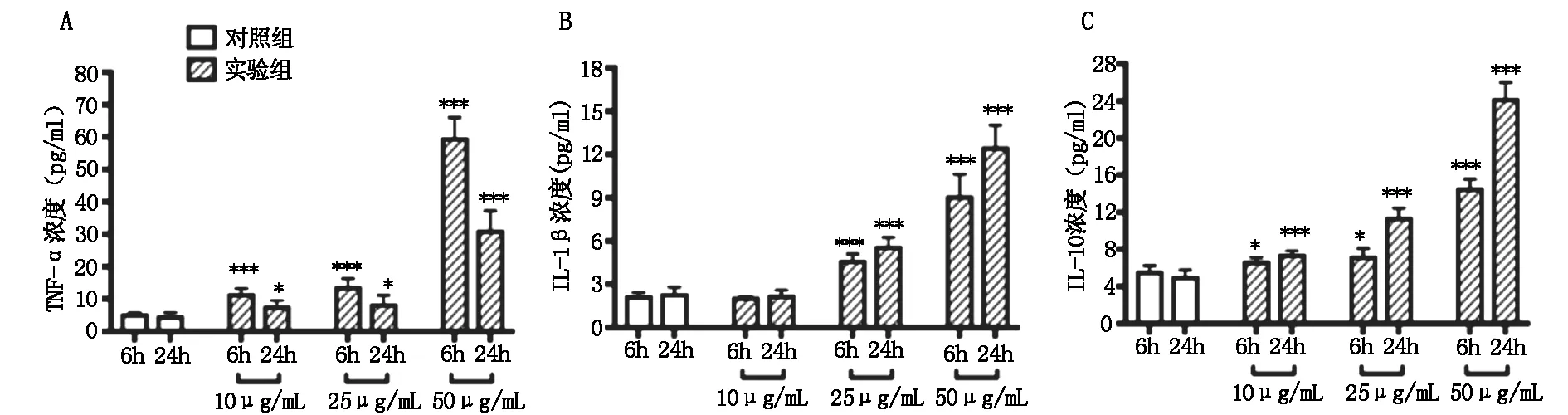
图1 不同浓度组蛋白刺激后THP-1上清液中各细胞因子浓度变化
不同浓度组蛋白刺激6 h、24 h后TNF-α(图A)、IL-10(图B)水平均有显著升高;10 μg/ml组蛋白刺激对IL-1β水平影响无统计学差异,25 μg/ml及50 μg/ml组蛋白IL-1β水平显著升高(图C)。各组以Student’st检验与对应时点的对照组比较,*表示P<0.05,***表示P<0.001.

表1 不同干预条件下各细胞因子分泌水平(Mean±SD,pg/ml)
*表中P值为该组别与相同时间节点的对照组样本比较结果,采用Student’sT检验

表2 不同干预条件下两种细胞LDH漏出率(Mean±SD,%)
*P值为TLR-4抗体干预组与IgG干预组比较,采用Mann-WhitneyU检验,均为精确P值
3 讨论
脓毒症发生发展的过程复杂,其中内皮细胞的活化与功能障碍是脓毒症疾病发展过程中的重要环节。近年来,胞外组蛋白作为一种DAMPs,在全身性炎症反应综合征中的重要作用逐渐被认识。Xu等[3]通过一系列动物及离体细胞实验,首次证实胞外组蛋白是导致脓毒症加重、引起死亡的主要介质。后续研究发现组蛋白可能从以下几个方面参与该病理过程:①激活TLR:组蛋白可以与多种TLR结合,刺激下游的IL-1、IL-6等促炎性细胞因子释放。研究提示TLR-4是组蛋白介导炎症反应中的主要受体[6]。Huang等[7]发现TLR-9是组蛋白诱导肝脏损害过程中的重要受体。②介导NOD-like receptor protein 3(NLRP3)炎性小体激活:NLRP3是高浓度组蛋白组细胞凋亡比例显著高于空白对照组,加入TLR-4抗体的实验组细胞凋亡比例较IgG组及高浓度组蛋白组比例显著下降,与HMEC细胞组所显示结果一致。
图2 HMEC细胞Annexin V-FTTC/PI双染色流式细胞仪检测结果图
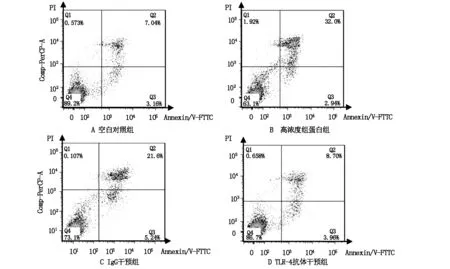
图3 THP-1细胞Annexin V-FTTC/PI双染色流式细胞仪检测结果图

表3 TLR-4抗体处理24 h后THP-1细胞上清液各细胞因子变化率

表4 TLR-4抗体处理24 h后THP-1细胞凋亡率
NLRs家族的一员,与接头蛋白形成蛋白-炎性小体复合物,后者既可进一步招募和结合多种炎症相关分子,亦可增强半胱天冬酶-1(caspase-1)的活性。Caspase-1可使IL-1β前体活化为IL-1β,同时增加IL-18的分泌,二者均为强促炎症因子[8]。研究发现组蛋白可能通过NLRP3炎症小体参与致炎过程[9];③激活凝血系统:经静脉给予C57BL/6雄性小鼠纯化组蛋白刺激后,小鼠的肺毛细血管床出现大量微血栓,继而出现凝血功能障碍及右心衰竭,选择性减少小鼠的血小板可延缓此过程,而为小鼠注射可中和外周游离组蛋白的重组血栓调节蛋白后,可减少新发血栓,降低死亡率[10]。
内皮细胞承担着凝血-纤溶系统平衡、调节体液免疫强度、抗炎性反应等多种生物学功能,而细胞完整性是其实现上述功能的基础。而组蛋白可直接损伤包括内皮细胞等多种细胞及组织。研究表明,细胞在凋亡阶段中,包括组蛋白在内的多种核内物质可被主动或被动地释放至细胞外。Barrero等[11]发现,慢性阻塞性肺病患者肺内凋亡的细胞周围超乙酰化组蛋白H3.3含量显著增加。组蛋白H3.3可结合于其他细胞表面,影响细胞钙平衡、内质网及线粒体功能,损害微环境中其他的健康结构细胞;Kawai等[12]发现,以不同剂量的纯化组蛋白刺激健康小鼠后,血清组蛋白H3在肺部及肝脏毛细血管内皮细胞上分布密度明显较高,同时这些器官的内皮细胞通透性增加并出现血浆成分外渗、凝血激活等与脓毒症高炎症反应相似的现象,提示组蛋白对肺部及肝脏内皮细胞具有细胞毒作用。
本研究中,HMEC在添加50 μl/ml组蛋白的混合培养液孵育24 h后,上清液中LDH水平均较空白对照组显著升高,流式细胞术检测的凋亡细胞比例较不含组蛋白培养基孵育的对照组显著升高,提示离体环境下,组蛋白对HMEC和THP-1具有毒性作用;而同时加入抗TLR-4抗体的培养基中孵育的细胞,其上清液中LDH水平及凋亡细胞比例均显著低于单纯组蛋白干预组及普通IgG对照组,提示抗TLR-4抗体可拮抗组蛋白H4对内皮细胞的细胞毒作用。
免疫细胞是机体实现免疫应答的基础,研究证实,组蛋白可以介导p38丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)磷酸化,从而激活MAPK途径、引起线粒体损伤及caspase-3活化,介导淋巴细胞的凋亡。组织细胞及免疫细胞的短期内大量凋亡均是脓毒症疾病进展的重要原因。单核细胞是免疫细胞的另一重要组成部分,受病原体、内毒素等活化后,单核细胞可以分泌TNF-α,IL-1β、IL-10等炎性因子,引起多种生物学效应。TNF-α,IL-1β等促炎性细胞因子可以正反馈激活单核细胞,抑制单核细胞的凋亡,延长单核细胞寿命[13]。然而,由于TNF-α与肿瘤坏死因子受体(tumor-necrosis-factor receptor,TNFR)结合后可招募相关效应蛋白,激活核因子κB(nuclear factor kappa-B,NF-κB)、 c-Jun氨基末端激酶(c-Jun N-terminal kinases,JNK)、MAPK等多条信号通路,引发巨噬细胞程序性坏死、单核细胞凋亡等多种炎性生物学效应[14],而脓毒症早期的高炎症反应状态下,TNFR被过度激活,TNF-α的细胞毒效应被进一步放大,故TNF-α被认为是脓毒症疾病发生和进展的核心因素之一[15,16]。IL-10是主要由免疫细胞分泌的一类抑炎因子,可拮抗TNF-α,IL-1β等促炎因子,是调节炎症反应的重要细胞因子,但已有研究证实,IL-10亦可通过激活caspase-8/FLICE通路[17],介导单核细胞的凋亡。
本研究显示,外源性组蛋白干预可刺激单核细胞活化,增强其分泌与脓毒症起病、进展密切相关的细胞因子TNF-α,IL-1β及IL-10的能力,表现出与内毒素类似的作用,且该作用具有剂量依赖性,TLR-4抗体可使上述细胞因子的分泌水平显著下降,表现出拮抗组蛋白促炎效应的作用,与既往研究结果一致;经50 μg/ml组蛋白刺激后,单核细胞培养基上清液中LDH漏出率及凋亡细胞比例亦显著升高,提示组蛋白对单核细胞的细胞毒效应与其对内皮细胞相似。加入TLR-4抗体后LDH漏出率及凋亡细胞比例显著降低,提示TLR-4抗体亦可拮抗组蛋白H4对单核细胞的细胞毒作用,外源性组蛋白对单核细胞的激活作用可能是其导致脓毒症进展的重要原因之一,与对内皮细胞的作用机制类似,TLR-4受体介导的细胞信号转导通路可能为组蛋白对单核细胞的细胞毒作用途径之一。与仅含组蛋白的对照组比较,加入TLR-4抗体的实验组凋亡细胞比例及细胞因子水平均显著下降,且凋亡细胞比例的变化率较细胞因子水平的变化率大,提示TLR-4抗体可能主要通过拮抗组蛋白的细胞毒效应发挥抗炎作用。
本研究还发现,THP-1细胞孵育24 h后采集的上清液中,TNF-α浓度较第6小时样本出现显著下降,另两种细胞因子无此现象,与早前文献报道结果一致,此结果仍需进行大样本研究。
本研究可得出以下结论:①离体环境下组蛋白可以活化单核细胞,增加TNF-α、IL-1β、IL-10等细胞因子的分泌,该作用呈剂量依赖性;②离体环境下组蛋白对内皮细胞及单核细胞表现出细胞毒作用,且该作用可被抗TLR-4抗体拮抗,提示胞外组蛋白可能通过TLR-4途径在脓毒症的起病及进展过程中发挥作用。③TLR-4抗体可能主要通过拮抗组蛋白的细胞毒效应发挥抗炎作用。后续将继续研究组蛋白促炎反应过程中的其他可能作用位点,为加深对脓毒症的认识、提高临床诊断水平及研究更有针对性的治疗方案提供理论依据。

