温阳健脾祛痰颗粒含药血清对非酒精性脂肪性肝病细胞模型TLR4/TRIF/NF-κB通路的影响
李 晖 ,张泽凤 ,2,杨 超 ,林俊芝 ,赵梓亦 ,陈昌金
(1.成都中医药大学附属医院中心实验室,四川 成都 610072;2.成都中医药大学临床医学院,四川 成都 610072;3.广东省中医院,广东 广州 510120)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是遗传-环境-代谢应激相关性肝病,包括单纯性脂肪肝及脂肪性肝炎(non-alcoholic steatohepatitis,NASH)[1]。 目前,NAFLD 已成为慢性肝病的主要病因,西方发达国家NAFLD发病率约为20%~30%,其中20%进展为肝硬化[2];亚洲发病率为5%~18%,我国发达地区发病率亦达到15%左右[3]。 NAFLD 发病机制复杂[4-6],现代医学目前对NAFLD尚无特效的治疗药物,主要采取生活方式干预、胰岛素增敏剂、抗氧化剂等治疗措施[7],干预作用有限,针对不同靶点及多层次靶向联合治疗是进行NAFLD干预的方向。中医药具有多途径、多层次、多靶点综合药理作用的特点,在治疗NAFLD方面具有优势[8]。 温阳健脾祛痰颗粒(WYJPQT)是笔者经验方,作为协定处方在临床上应用多年,对于NAFLD的治疗取得了良好疗效,且价格低廉,但需要进一步明确其作用机制。
本研究在应用HepG2细胞建立NAFLD细胞模型的基础上,研究WYJPQT含药血清对该细胞模型的治疗作用。由于慢性炎症在NAFLD发生、发展过程中发挥重要作用,TLR4/TRIF/NF-κB 信号通路是体内重要炎症通路,与NAFLD的进展具有明确的联系,以此为切入点,进一步探讨WYJPQT与TLR4/TRIF/NF-κB信号通路的相关性,明确其作用靶点,为推广WYJPQT的临床应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物和细胞株 Wistar雄性大鼠70只,体质量(220±20)g,购自成都达硕实验有限公司,SPF级,动物生产许可证编号:SCXK(川)2015-030;在温度(25±2)℃,12 h光照/d条件下,普通饲料,清水饲养于成都中医药大学附属医院实验动物房适应性喂养1周,大鼠无死亡,一般情况良好。肝癌细胞株HepG2由中心实验室保存。
1.1.2 实验药物 温阳健脾祛痰颗粒(WYJPQT)系笔者经验方,作为协定处方使用多年,由成都中医药大学附属医院药剂科制备为颗粒剂,主要由淫羊藿、炙黄芪、茯苓、炒白术、泽泻、陈皮、法半夏、焦山楂、丹参等组成。制备方法:全方药物加入8倍量水,浸泡 40 min,煎煮 3次,每次 50 min,合并 3次滤液,浓缩至相对密度1.3;加入糊精,混合,在75℃下鼓风干燥6 h,粉碎过筛;加入80%乙醇,制粒,65℃下鼓风干燥4 h,整粒,分包装至10 g。阳性对照药物多烯磷脂酰胆碱胶囊(赛诺菲北京制药有限公司),购于成都中医药大学附属医院。
1.1.3 实验试剂及主要仪器 DMEM培养基、胰蛋白酶(美国 Gibco 公司);油酸(Oleic acid,OA,美国MP公司);油红O、二甲基亚砜(美国Sigma公司);BCA蛋白检测试剂盒(美国Thermo公司);三酰甘油(TG)检测试剂盒(南京建成生物科技有限公司);异丙醇(成都科龙化工试剂厂);4%多聚甲醛(天津市进丰化工有限公司);Toll样受体 4(TLR4)上下游引物为 F:5'TTCACTTCCTCTCACCCTTT 3',R:5'GCATCATCCTCACTGCTTC 3';核因子 κB(NF-κB)上下游引物为F:5'TCATCCACCTTCATTCTCAAC 3',R:5'ATCCTCCACCACATCTTCC 3';髓样分化因子88(MYD88)上下游引物为 F:GCTGACTTGGAGCCTG ATTC;R:GATAGGCATGTCAGGGGAGA;Toll样白介素-1受体结构域适配子诱导干扰素-b(TRIF)上下游引物为 F:CAGGAGCCTGAGGAGATGAG,R:CTG GGTAGTTGGTGCTGGTT;内参β-actin上下游引物为 F:5'TCTCCCAAGTCCACAAGG 3',R:5'GGGCA CGAAGGCTCATCA 3';TLR4多克隆抗体(英国Abcam公司,ab13556);TRIF单克隆抗体(英国Abcam公司,ab180689);MYD88单克隆抗体(英国 Abcam公司,ab133739);NF-κB 单克隆抗体(美国 CST 公司,#6956);CO2培养箱(美国 Nuare 公司);倒置显微镜(日本Olympus公司);实时荧光定量PCR仪(美国 Applied Biosystems公司,型号:ABI 7500);超纯水仪(法国Milipore公司)。
1.2 方法
1.2.1 含药血清制备 将Wistar雄性大白鼠70只随机分成WYJPQT高、中、低剂量组,阳性对照组及空白对照组,每组各14只。以上5组大鼠中,除空白对照组外,均予以药物干预,其中,WYJPQT高、中、低剂量组服用 WYJPQT 生药 8.8、4.4、2.2 g/(kg·d),将颗粒稀释后等体积灌胃;阳性对照组予多烯磷脂酰胆碱胶囊 0.122 g/(kg·d);每日药量分 2 次灌胃,间隔8 h;空白对照组予生理盐水,连续7 d。标本采集前,所有大鼠禁食12 h;于末次给药1 h后,采取下腔静脉取血的方式,收集全血,4℃静置过夜后离心,4 000 rpm×15 min,取血清,56℃ 30 min灭活,以除去可能存在的生物活性物质对实验结果的影响,0.22 μm过滤器过滤除菌,-80℃保存备用。
1.2.2 NAFLD细胞模型的制备及鉴定 HepG2细胞用含10%FBS的DMEM完全培养基,置于5%CO2孵箱中,37℃培养,观察细胞形态变化,待细胞汇合度为70%~80%时,0.25%胰蛋白酶消化,按1∶2或1∶3传代,将处于对数生长期的HepG2细胞以1×105个/孔接种于12孔培养板中,细胞贴壁后,弃掉原有培养液,加适量PBS缓冲液洗两遍;模型组加入含0.25 mM OA的培养基继续培养24 h。
取对数生长期的HepG2细胞以1×105个/孔接种于12孔培养板中,吸弃培养孔的培养基,预热的PBS洗3次,每次约5 min;用预热的4%多聚甲醛固定30 min,弃多聚甲醛液,PBS洗2次,每次2 min;每孔加入60%异丙醇同步化液 1 mL 1~2 min,加入油红O工作液每孔1 mL室温下避光放置30 min;吸弃油红O工作液,每孔加入1 mL 60%异丙醇进行分色约30 s;每孔加入1 mL双蒸水(ddH2O)洗3 min,每孔加入1 mL苏木素染色3~5 min,每孔加入 1 mL ddH2O洗 3次,每次 2 min;每孔加入1 mL ddH2O液封,倒置显微镜下观察,取不同倍数不同视野拍照。BCA蛋白检测试剂盒检测细胞内蛋白含量,按说明书操作;三酰甘油检测试剂盒检测细胞内三酰甘油(TG)含量,计算细胞内TG/蛋白比值。
1.2.3 含药血清处理NAFLD的细胞模型 将对数生长期的HepG2细胞以5×104个/孔的密度接种于24孔细胞培养板中,培养24 h后,待细胞汇合度为70%~80%时,吸弃培养基,NAFLD模型组给予含0.25 mM OA培养基造模24 h后,吸弃培养基,用PBS清洗每孔细胞两遍后,将NAFLD细胞模型随机分为5组(WYJPQT高、中、低剂量组,阳性对照组,模型组),同时设置空白对照组,每组4个复孔。WYJPQT高、中、低剂量组分别加入相对应的不同浓度10%WYJPQT含药血清培养基处理48 h,阳性对照组给予10%多烯磷脂酰胆碱含药血清培养基处理48 h,模型组和空白对照组则给予含10%大鼠血清培养基处理48 h后,分别进行油红O染色和细胞内TG含量、蛋白含量测定,确定TG/蛋白比值。
1.2.4 逆转录-实时荧光定量PCR(RT-qPCR)法检测细胞中的 TLR4、TRIF、MYD88 和 NF-κB mRNA表达情况 收集细胞,抽提细胞总RNA,mRNA逆转录为cDNA,进行定量PCR检测。设定20 μL体系,包括 cDNA 4 μL、Forward primer (F1) 0.5 μL、Reverse primer (F2) 0.5 μL、SYBR®Green PCR Master Mix 10 μL、Nuclease-Free Water 5 μL,反应条件为预变性95℃ 10 min;变性95℃ 15 s;退火、延伸60℃ 1 min,共40个循环。以β-actin为参照基因,观察CT值的变化,测基因表达相对含量。各组基因相对表达含量计算公式:ΔCT=目标基因-内参基因,ΔΔCT=ΔCT(实验组)-ΔCT(空白对照组),计算 2-ΔΔCT(实验组包括 WYJPQT 高、中、低剂量组,阳性对照组,模型组)。
1.2.5 蛋白印迹法(Western blot)检测细胞中TLR4、MYD88、TRIF、NF-κB蛋白的表达情况 RIPA裂解液裂解细胞,提取细胞总蛋白,BCA检测蛋白浓度,SDS-PAGE电泳、转移至PVGF膜,5%脱脂奶粉封闭,分别加一抗、二抗孵育,经ECL发光,X线胶片曝光、显影及定影,并以计算机图像扫描进行图像分析,测定灰度值以代表蛋白的表达量。
1.3 统计学方法 用SPSS 21.0统计软件分析。若各组满足正态分布、方差齐,同一指标间可采用单因素方差分析;组间两两比较,可采用LSD-t检验或非参数检验。
2 结 果
2.1 WYJPQT含药血清处理NAFLD细胞模型后的油红O染色结果 0.25 mM OA诱导HepG2细胞24 h,油红O染色发现,空白对照组细胞边缘清晰,胞浆丰富,核膜完整,细胞核被染成蓝色,细胞内未见明显红色脂滴;而模型组细胞内出现很多大小不等的红色脂滴,脂肪变严重,部分甚至融合成片,确定NAFLD细胞模型成功建立。含药血清处理48 h后,油红O染色示,空白对照组细胞胞膜光滑,细胞核染成蓝色,细胞内未见明显红色脂滴颗粒;模型组,WYJPQT高、中、低剂量组,阳性对照组中细胞核被染成蓝色,细胞内均出现红色脂滴颗粒。与模型组相比,WYJPQT高、中、低剂量组及阳性对照组细胞内红色脂滴颗粒略微减少;WYJPQT高、中、低剂量组与阳性对照组相比,细胞内红色脂滴颗粒数差异不明显,见图1。
2.2 6组TG/蛋白比值比较 0.25 mM OA诱导HepG2细胞24 h,检测细胞内TG/蛋白比值变化,与空白对照组比较,模型组细胞内TG/蛋白比值明显增高,确定NAFLD细胞模型成功建立。WYJPQT高、中、低剂量含药血清处理48 h后,各组TG/蛋白比值见表1。
2.3 6 组 TLR4、TRIF、MYD88 和 NF-κB mRNA 相对表达水平结果 见图2。
2.4 6组 TLR4、TRIF、MYD88和 NF-κB 的蛋白相对表达水平结果 见图3。
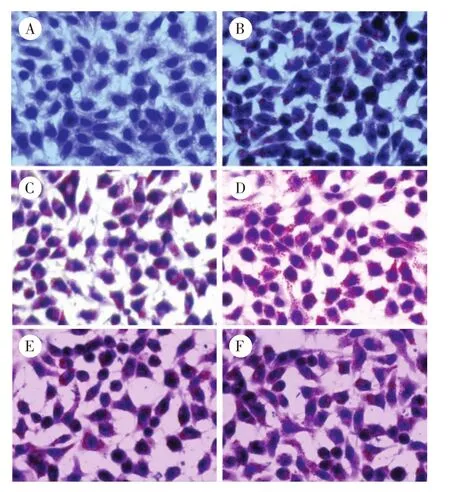
图1 6组NAFLD细胞模型的油红O染色图(×400)
表1 各组TG/蛋白比值比较()

表1 各组TG/蛋白比值比较()
注:与空白对照组比较,1)P<0.05;与模型组比较,2)P<0.05;与阳性对照组比较,3) P<0.05。
TG/蛋白比值 /(mmoL/gprot)1.17±0.24 3.18±0.291)2.46±0.292)3)2.51±0.222)3)2.19±0.252)1.97±0.222)组别空白对照组模型组高剂量组中剂量组低剂量组阳性对照组

图2 6组TLR4、TRIF、MYD88和NF-κB mRNA相对表达水平结果图
3 讨 论
NAFLD隶属于中医学的“胁痛”“痰证”“瘀血”“积聚”“肥气”“肝癖”等范畴。清代叶天士指出:“夫肌肤柔白属气虚,外似丰溢,里真大怯,盖阳虚之体,惟多痰多湿……”,阐明肥胖人多为本虚标实——气虚阳虚为本、多痰多湿为标。该病主要由饮食不节或体虚湿滞,导致肝失疏泄,脾失健运,肾虚气化不及,以致痰湿内生,脂膏沉积于肝。脾虚是本病的发病基础,痰湿为致病因素,本虚标实为病机特点[9]。
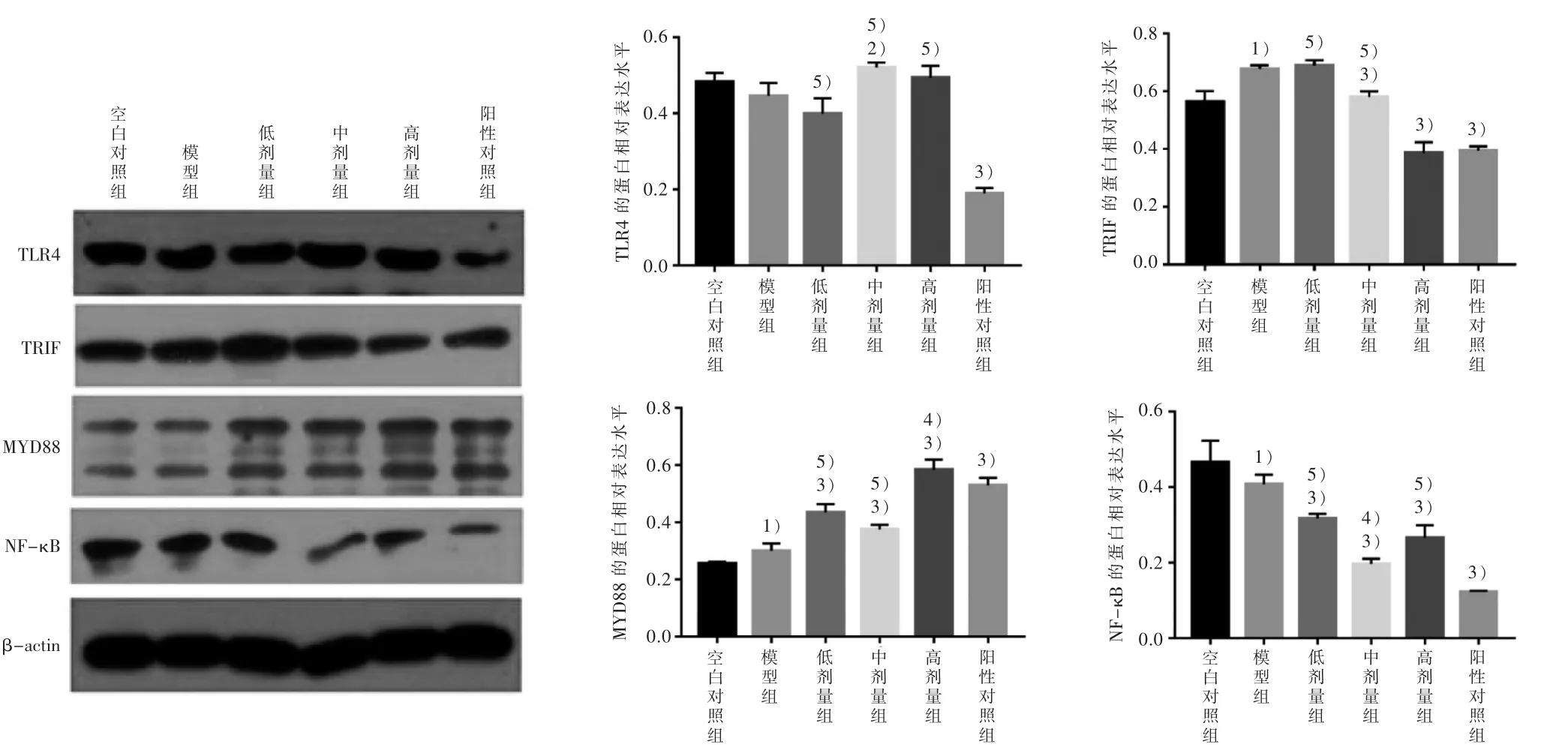
图3 6组TLR4、TRIF、MYD88和NF-κB的蛋白相对表达水平结果图
WYJPQT是以“脾肾亏虚,痰湿内蕴”为病机学说,以“温阳健脾,祛痰化湿”为基本治则,六君子汤合泽泻汤加减化裁而形成。由六君子汤是在四君子汤的基础上加入半夏和陈皮,补气健脾,燥湿化痰;而泽泻汤出自医圣张仲景《金匮要略》,为治疗痰饮水湿证经典方剂。两方合用,痰湿得除,脾得健运,标本兼治。WYJPQT全方配伍得当,首重健脾益气祛痰湿,做到“见肝之病,知肝传脾,当先实脾”。脾气旺,则痰湿生化无源。配伍淫羊藿,健脾补肾同时助阳化气,阳气盛则浊阴消,体现了标本兼治的原则。
本研究选用OA诱导HepG2细胞建立NAFLD细胞模型。NAFLD的细胞模型目前主要是通过利用不同比例浓度的油酸、棕榈酸、脂肪乳等来诱导HepG2、L02、Huh7 等细胞建立模型[10-11]。 大量的实验证明:HepG2细胞虽然是肿瘤细胞,但和正常肝细胞在生物学特点和功能上存在相似性,具备肝脏各种细胞特性,油酸、棕榈酸等诱导剂都可以促使肝细胞和HepG2细胞发生脂肪变性。相比而言,HepG2细胞对脂毒性的耐受力更强,因此是脂肪变性细胞模型中最具优势和前景的备选细胞[12]。目前利用OA诱导HepG2细胞建立NAFLD细胞模型已属于比较成熟的方法。本研究采取0.25 mM OA诱导HepG2细胞24 h,采用油红O染色后,发现OA诱导组细胞内可见大小不等的红色脂滴颗粒,部分融合成片,细胞脂质蓄积明显;检测细胞内TG含量,OA诱导组细胞内TG/蛋白比值明显高于空白对照组,说明0.25 mM的OA刺激HepG2细胞24 h构建NAFLD细胞模型成功。
本研究结果显示:WYJPQT高、中、低剂量含药血清和阳性对照组均能降低NAFLD细胞中TG/蛋白比值,从而改善NAFLD细胞内脂质蓄积的状况;WYJPQT低剂量组降低TG的作用与阳性对照组相当。
本研究应用OA刺激HepG2细胞,大量脂肪酸进入细胞内,游离的脂肪酸刺激TLR4产生,通过TRIF或MYD88信号通路向下传递激活NF-κB,使炎症因子IL-6、TNF-α等炎症因子大量释放,导致TG的沉积,从而引起肝细胞脂肪变性、坏死[13-16]。以此为出发点,我们分别应用RT-qPCR法和Western blot法检测细胞内 TLR4、TRIF、MYD88 及 NF-κB mRNA和蛋白的表达情况,结果显示,与模型组相比,WYJPQT高、中剂量组能够显著下调TLR4 mRNA表达,优于阳性对照组;高、中、低剂量组均能降低NF-κB mRNA表达量,中、低剂量组与阳性对照组作用相当。表明WYJPQT含药血清能够降低NAFLD细胞模型中TG/蛋白比值,其机制之一可能与下调TLR4基因表达量,抑制NF-κB的活性有关。而Western blot法检测结果与RT-qPCR法结果不完全一致:模型组TRIF、MYD88蛋白表达量较空白对照组明显上调;与模型组比较,WYJPQT高、中剂量组TRIF蛋白表达量明显下调,高剂量组TRIF蛋白表达量与阳性对照组相当;WYJPQT各剂量组NF-κB相对蛋白表达量出现显著下调,而MYD88相对蛋白表达量则明显升高。
因此,可以初步得出以下结论:WYJPQT对NAFLD细胞模型具有治疗作用,降低细胞内TG/蛋白比值,降低TRIF、NF-κB表达量;而对于TLR4的影响主要集中在mRNA水平,对蛋白表达水平影响不明显,其原因可能跟TLR4/NF-κB信号通路在不同的细胞发挥不同的作用有关[14];WYJPQT各剂量组MYD88的表达水平呈现升高态势,因此WYJPQT主要通过调控TLR4/TRIF/NF-κB信号通路达到对NAFLD细胞模型的治疗作用,对MYD88的表达影响则需要深入进行验证。
NAFLD发病机制非常复杂,本研究仅对其中TLR4/TRIF/NF-κB信号通路进行了初步探讨。后续研究考虑在动物实验模型上验证WYJPQT的疗效,深入探讨其作用机制,为临床上应用WYJPQT治疗NAFLD提供可靠依据。

