莱茵衣藻BBS1蛋白的原核表达、纯化及其多克隆抗体制备
刘雁霞,刘思佳,王 慧,黄梦倩,王 岩,樊振川
(天津科技大学大健康生物技术国家国际科技合作基地,天津科技大学食品工程与生物技术学院,天津 300457)
莱茵衣藻(C.reinhardtii)是当今国内外研究纤毛结构和组装的主要模式生物之一,是结构简单的单细胞真核藻类[1].纤毛缺失或信号传导功能障碍会造成一系列的疾病,统称为纤毛病,其中巴德-毕氏综合征(Bardet-Biedl syndrome,BBS)是一种罕见的常染色体隐性遗传纤毛病,其常见的症状有视网膜变性、肾囊肿、肝脏纤维化、肥胖、先天性心脏病等.目前已鉴定出的基因有21 种[1].
BBSome 复合物蛋白主要存在于纤毛膜与纤毛轴丝之间的区域,可与纤毛膜上的受体结合,具有信号传导作用.BBS1 最初由Mykytyn 发现,bbs1 是一种常见的BBS 综合征突变基因,由它引起的突变约占30%,BBS1 可与BBS3b 直接连接,通过BBS3b与纤毛内运输蛋白(IFT)结合,运送至纤毛顶端,参与完成信号传导[1-2].
为进一步研究BBSome 与IFT 蛋白的相互作用关系,本实验室需制备检测莱茵衣藻内BBS1 的抗体,通过扩增bbs1 基因片段,连接至pET-28a(+)表达载体,表达融合蛋白6×His-BBS1,获得多克隆抗体,为进一步研究BBSome 与IFT 蛋白的相互作用,以及BBSome 蛋白是如何完成纤毛的信号传导作用奠定分子基础.这也是首次用莱茵衣藻bbs1 全基因序列制备兔抗莱茵衣藻多克隆抗体.
1 材料及方法
1.1 材料
1.1.1 质粒及菌株
莱茵衣藻(C.reinhardtii)CC-125 野生型藻种、莱茵衣藻(C.reinhardtii)bbs1 突变型藻种、大肠杆菌(E.coli)XL1-blue、质粒pET-28a(+)、感受态细胞均由本实验室保存.
1.1.2 试剂
限制性内切酶、蛋白marker,美国Thermo 公司;100 bp、1 kbp DNA marker、T4 DNA 连接酶由北京全式金生物技术有限公司;质粒小提试剂盒,天津润泰科技发展有限公司;琼脂糖凝胶回收试剂盒,美国Omega Bio-Tek 公司;Protein A SepharoseTMCL-4B 抗体纯化介质,美国GE Healthcare 公司;其他试剂与报道文献一致[3].免疫实验由华大蛋白质研发中心有限公司进行.
1.2 方法
1.2.1 表达载体构建
莱茵衣藻bbs1 cDNA 长度为1 731 bp,且序列不含BamHⅠ和HindⅢ酶切位点,设计引物序列为F:5′-CCATGCTGCCATCAGTCAAG-3′、R:5′-GGCTCCACCTCCTCCGGCTC-3′,下划线部分为限制性内切酶切位点,由苏州金唯智生物有限公司合成.bbs1 cDNA 全基因序列通过PCR 获得[3]. PCR 产物纯化后,用BamHⅠ和HindⅢ双酶切,同时双酶切表达载体pET-28a(+),分别回收大小为1 731 bp 的目的基因和5 344 bp 的载体片段.回收后将载体和目的基因按照摩尔质量1﹕3 的比例室温连接1 h,同时设置对照组;转化至大肠杆菌(E.coli)XL1-blue,抗性平板(100 μg/mL 卡那霉素)37 ℃过夜培养14~16 h;挑取转化子至液体LB 培养基培养过夜,提质粒后BamHⅠ和HindⅢ双酶切进行验证,正确则测序.
1.2.2 诱导表达
将测序正确的重组质粒pET-28a(+)-bbs1 进行诱导表达,诱导方法参照文献[4],诱导16~18 h 后,4 ℃、8 000g 离心2 min,收集菌体.加入裂解液/结合液(50 mmol/L pH 7.4 Tris-HCl,0.5 mol/L NaCl,20 mmol/L 咪唑)将菌体重悬(20 mL 裂解液重悬200 mL 菌体),超声破碎细胞.分别收集部分全蛋白,上清液和沉淀进行12% SDS-PAGE 电泳,鉴定表达融合蛋白存在于上清液或沉淀[5].
1.2.3 蛋白纯化
400 mL 菌体高压破碎后,4 ℃、12 000g 离心20 min,蛋白以包涵体形式存在于沉淀中,弃上清液,将沉淀用裂解液重悬,清洗2 次.用含2 mol/L 尿素的裂解液清洗沉淀2 次后,最终用含8 mol/L 尿素的裂解液将沉淀完全溶解,4 ℃、12 000g 离心20 min,将上清液过0.22 μm 滤膜与1 mL Ni SepharoseTM6 Fast Flow 填料4 ℃结合1 h;弃流穿液,再用5 倍柱体积的裂解液(含8 mol/L 尿素)漂洗填料3 次;待漂洗液流干后加入用3 mL 洗脱缓冲液(50 mmol/L pH 7.4 Tris-HCl,0.5 mol/L NaCl,500 mmol/L 咪唑,8 mol/L 尿素)混匀,静置10 min 收集洗脱液,将收集到的洗脱液重新加入混匀,重复3 次,得到最终洗脱液,测定浓度和纯度.
1.2.4 免疫
首次免疫新西兰大白兔之前用75%酒精擦拭兔子耳部静脉[6],插入静脉抽取阴性血100~200 μL,全血在室温静置30~120 min 后,1 500g 离心10 min,收集血清.首次免疫取免疫原400 μg,采用生理盐水稀释至200~500 μL,加入等体积的弗氏完全佐剂[7]混匀,形成油包水状态.进行背部多点皮下注射免疫,每10 d 加强免疫1 次,共加强免疫2 次.加强免疫取 200 μg 免疫原,用生理盐水稀释到 200~500 μL,再加入等体积弗氏不完全佐剂;用混匀仪器将溶液和佐剂混匀,形成油包水状态.
1.2.5 多克隆抗体效价测定
采用间接ELISA 法测定抗体效价[4],用包被液(碳酸钠-碳酸氢钠缓冲液,pH 9.6)稀释抗原,终质量浓度为2 μg/mL,每孔100 μL,4 ℃过夜;后用PBS 洗涤2 次.封闭液(1% BSA 或脱脂奶粉/PBS)封闭,每孔200 μL,37 ℃孵育2 h;后用洗液洗涤1 次.将多抗血清从200 倍开始用PBS 作2 倍梯度稀释,空白对照为PBS,阴性对照为阴性血清200 倍稀释;每孔100 μL,37 ℃孵育1h;洗液洗涤3次,每 次10 min.以1﹕20 000 稀释比加入二抗,每孔100 μL,37 ℃孵育1 h,洗液洗涤3 次,每次10 min.加入显色液(1% A 液+10% B 液,A 液为1%TMB 溶于DMSO,B 液为 0.1% H2O2柠檬酸缓冲液)每孔100 μL,显色时间为5~15 min;每孔加入50 μL 终止液终止.双波长(450 nm、630 nm)测定吸光度,记录保存数据并作图分析.多抗血清效价为1/2 最大吸光度所对应的稀释倍数.
1.2.6 多克隆抗体纯化及检测
Protein A SepharoseTMCL-4B 纯化血清[5],稀释至1 mg/mL 后,留存备用.取20 μg 经过蛋白定量处理的莱茵衣藻上清液蛋白检测抗体特异性,进行12% SDS-PAGE 电泳,转膜,封闭后以1﹕1 000 的稀释比孵育多克隆抗体,二抗采用HRP 标记的羊抗兔IgG(1﹕10 000 稀释),进行ECL 显色.
1.2.7 免疫荧光定位莱茵衣藻中BBS1 蛋白
免疫荧光对莱茵衣藻内BBS1 蛋白定位,固定制片后,于室温下利用牛血清白蛋白(BSA)封闭1 h,用纯化后的BBS1 多克隆抗体(1﹕10 稀释比)室温孵育4 h,用荧光标记羊抗兔/小鼠二抗室温孵育1 h,封片后在荧光显微镜下拍照.
2 结果与分析
2.1 重组质粒pET-28a(+)-bbs1 的构建
通过RT-PCR 扩增获得1 731 bp 的bbs1 目的基因,连接至载体后,转化挑取单克隆提取质粒并酶切验证.图1 为C.reinhardtii CC-125 总RNA 提取结果;图2(a)显示PCR 扩增产物,条带单一且大小正确;图2(b)显示重组表达质粒pET-28a(+)-bbs1 阳性克隆双酶切验证结果,双酶切后两条带大小与预期结果一致,经测序验证结果正确,说明表达载体pET-28a(+)-bbs1 构建成功.
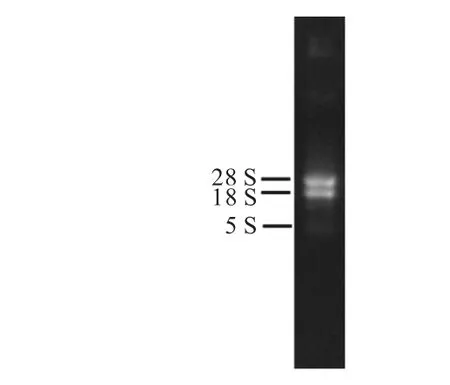
图1 C. reinhardtii CC-125总RNA的提取 Fig. 1 Total RNA extraction of C. reinhardtii CC-125
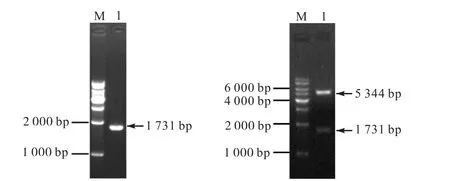
(a) bbs1 基因PCR 扩增(b) pET-28a(+)-bbs1 的双酶切验证 (a)中M. 100 bp DNA marker;1. bbs1 基因PCR. (b)中M. 1 kbp marker;1. pET-28a(+)-bbs1 的BamHⅠ和HindⅢ双酶切
2.2 6×His-BBS1诱导表达及纯化
融合蛋白6×His-BBS1 由DNAMan 预测大小约6.3×104,添加IPTG 诱导后,经SDS-PAGE 分析显示,在5.5×104~7.0×104间条带,表达量略低,且融合蛋白大多以包涵体形式存在于沉淀中;约1 L 诱导后菌体经亲和层析纯化后蛋白质量浓度可达到0.5 mg/mL,共2.5 mg,经考马斯亮蓝染色,TBST 脱色后,利用软件Image J 对其进行灰度分析,纯度可达90%以上,可作为免疫抗原(图3).
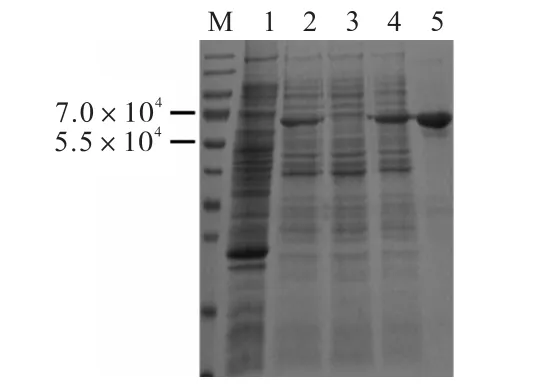
M.蛋白marker;1.诱导前对照;2.诱导后全细胞;3.诱导后上清液蛋白;4.诱导后沉淀蛋白;5.纯化后目的蛋白
2.3 抗体的效价及特异性检测
抗血清检测参照纤毛内运输蛋白IFT46 抗体制备方法[5],采用间接ELISA 法测定,1/2 最大吸光度所对应的稀释倍数为1﹕102 400,因此多抗血清抗血清滴定度达到 1﹕102 400(图 4).对抗血清进行SDS-PAGE 考马斯亮蓝染色检测,在5.5×104和 2.5×104处可见较纯的抗体重链和轻链(图5).免疫印迹法(Western blot)验证抗血清特异性结果如图6所示.
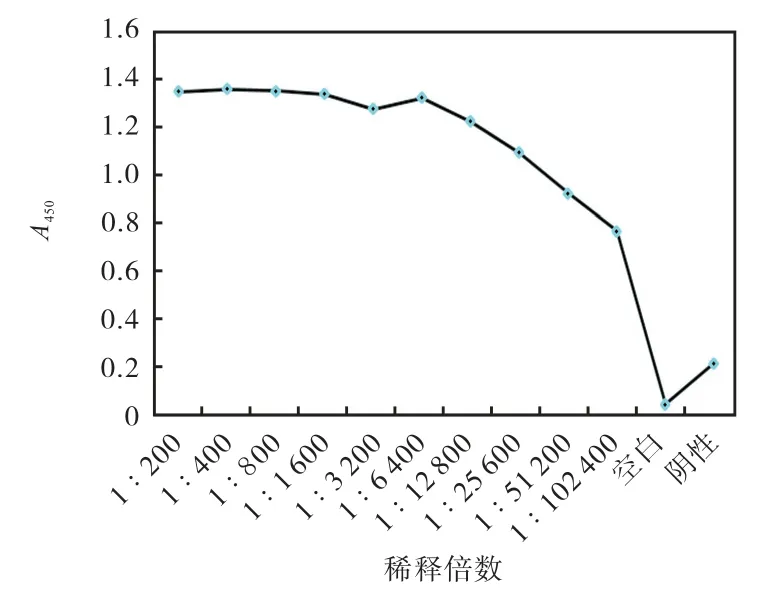
图4 间接ELISA法测定抗血清效价 Fig. 4 Determination of anti-BBS1 polyclonal antiserum with indirect ELISA
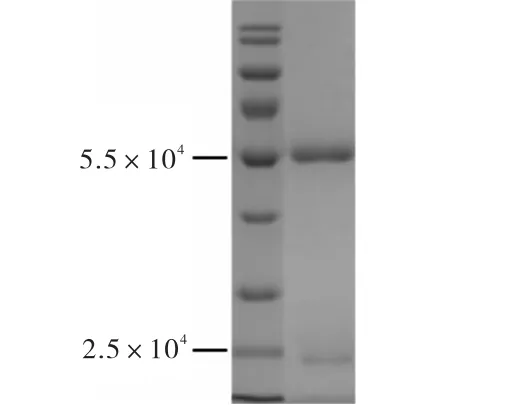
图5 抗血清SDS-PAGE纯度检测 Fig. 5 Determination of anti-BBS1 polyclonal antiserum purity with SDS-PAGE
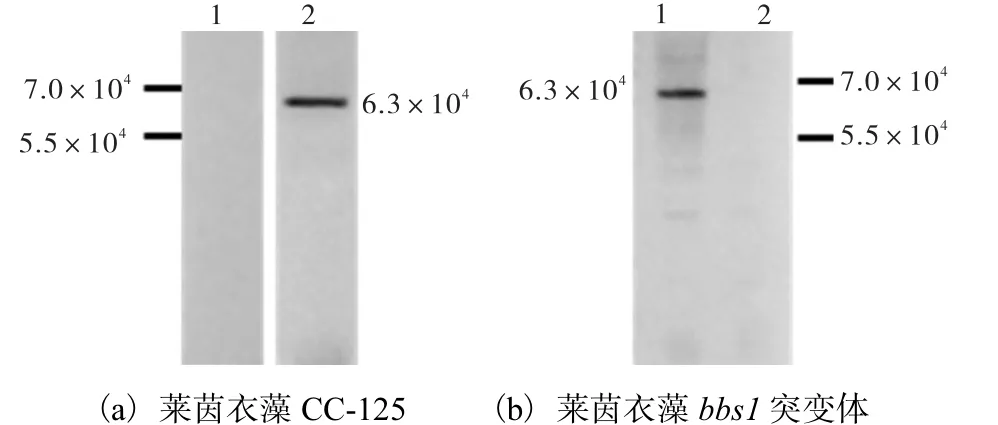
(a)中1. 免疫前阴性血清检测莱茵衣藻CC-125;2. Anti-BBS1 多克隆抗体检测莱茵衣藻CC-125.(b)中1. Anti-BBS1 多克隆抗体检测莱茵衣藻CC-125;2. Anti-BBS1 多克隆抗体检测莱茵衣藻bbs1 突变体
经免疫印迹实验分析显示,纯化后的抗血清在 1﹕1 000 的稀释比下,在6.3×104处可见特异性结合条带,而在bbs1 突变体藻株中,无特异性结合条带,由此可知抗血清可与莱茵衣藻BBS1 蛋白发生特异性结合(图6),表明所制备的多克隆抗体特异性好,灵敏度高.
2.4 BBS1蛋白在莱茵衣藻中的定位
通过免疫荧光技术对莱茵衣藻BBS1 蛋白进行定位分析,可通过荧光信号看出多克隆抗体可以与莱茵衣藻内的BBS1 蛋白进行特异性结合,且该蛋白可以进入莱茵衣藻纤毛内,该蛋白在细胞和纤毛中的分布可通过野生型藻种中红色荧光判断(图7).由图7可知莱茵衣藻中BBS1 蛋白分布于基体部位以及在鞭毛中呈点状分布.
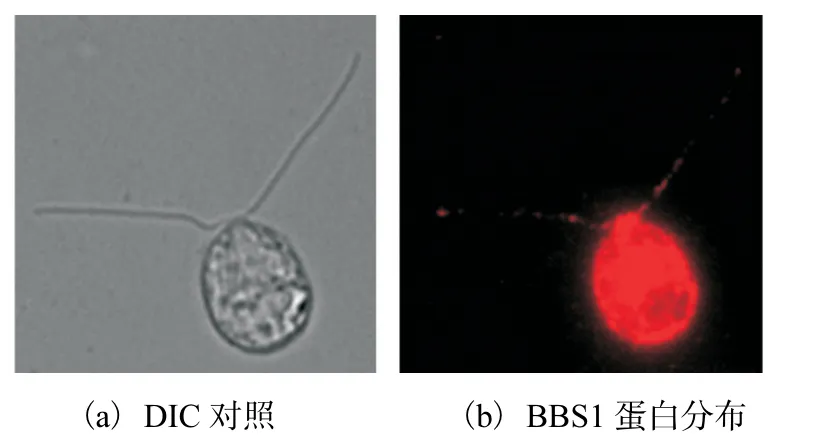
图7 免疫荧光检测BBS1蛋白在莱茵衣藻纤毛中的定位Fig. 7 Immunofluorescence detection of BBS1 protein localization in C. reinhardtii
3 结 语
BBSome 复合物蛋白主要存在于纤毛膜与纤毛轴丝之间的区域,与纤毛膜上分布的受体存在一定的关系,对纤毛的信号传导具有极其重要的作用,这也是大部分的BBSome 复合物蛋白在细菌内表达时,大多以包涵体的形式存在的原因.本文中与His 标签共表达的BBS1 蛋白也是以包涵体的形式存在,但GST 蛋白促溶与BBS1 融合表达时可以以上清液的形式存在.考虑到GST 标签过大,不易表达,且标签产生的抗体可能会影响后续抗血清的质量,因此选用His 标签蛋白与BBS1 融合表达作为免疫抗原.包涵体蛋白变性纯化后可直接免疫,整个标签大小约为4.3×103,一般不会影响蛋白的结构和功能;另外,通过组氨酸与金属离子(Ni2+)的螯合作用,对表达蛋白进行亲和层析纯化,方法体系很成熟.
免疫抗原的纯度越高所产生的抗血清质量越好,由于本次实验免疫抗原纯度达到90%以上,抗血清在经过一步纯化后就能够特异性地识别莱茵衣藻内的内源性BBS1 蛋白,为在莱茵衣藻中深入研究BBSome 复合物蛋白提供技术支持,为后续阐明其作用机理、纤毛病的预防和治疗提供理论依据.
——一道江苏高考题的奥秘解读和拓展

